Наличие у частиц дисперсных систем электрического заряда было открыто еще в 1808 г. профессором Московского университета Ф. Ф. Рейссом. Он показал, что при наложении разности электрических потенциалов на электроды, опущенные в заполненные водой стеклянные трубки, воткнутые в кусок сырой глины, как это (схематически показано на рис. VII, I, жидкость в трубке с положительным полюсом мутнела, а в трубке с отрицательным полюсом вода оставалась прозрачной. Это указывало на то, что частицы глины переносятся в электрическом поле к положительному полюсу. Более поздними исследованиями было установлено, что частицы переносятся в электрическом поле с постоянной скоростью. Эта скорость тем больше, чем выше приложенная разность потенциалов и диэлектрическая проницаемость среды, и тем меньше, чем больше вязкость среды. Перенос частиц, в электрическом поле получил название электрофорезя^шТ<^тафореза.
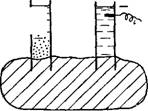
Рейсе заметил также, что если тонкий кварцевый песок поместить в среднюю часть U-образной трубки так, чтобы он образовал как бы пористую диафрагму, затем заполнить трубку водой и приложить электрический ток к электродам, помещенным в оба колена трубки (рис. VII, 2), то уровень воды в колене с отрицательным электродом будет повышаться до тех пор, пока разность уровней в обоих коленах не достигнет определенного значения. Подобно электрофорезу этот процесс идет с постоянной скоростью, и количество перенесенной жидкости прямо пропорционально приложенной разности потенциалов и диэлектрической проницаемости и обратно пропорционально вязкости среды. Исследованиями Ви — демана, проведенными в 1852 г., было установлено, что количество жидкости, прошедшей через капилляры пористой диафрагмы,
пропорционально силе тока и при постоянной силе тока не зависит от площади сечения или толщины диафрагмы. Это явление было Названо^электроосмосом, или электроэндоосмосом.
|
Рис. VII, 2. Схематическое изображение опыта Рейсса по электроссмосу. |
Причина обоих явлений, обнаруженных Ф. Ф. Рейссом, одна и та же — наличие разноименных зарядов у твердой и жидкой фазы. При электрофорезе в результате возникновения электрического поля между электродами, благодаря малому размеру частиц глины, происходит перенос отрицательно заряженной дисцерсной фазы к положительному электроду. При электроосмосе ввиду того, что частицы песка слишком тяжелы, под влиянием электрического поля по капиллярам, имеющимся в слое песка, к отрицательному электроду передвигается положительно заряженная жидкость.
|
Рис. VII, 1. Схематическое изображение опыта Рейсса по электрофорезу. |
В дальнейшем были обнаружены два явления, как бы противоположные электрофорезу и электроосмосу. Дорн в 1878 г.-обнаружил, что при оседании каких-либо частиц в жидкости, например песка в воде, возникает электродвижущая сила между двумя электродами, введенными в разные места столба Жидкости. Это явление, противоположное электрофорезу, получило название эффекта Дорна, или потенциала седиментации.
При п’родавливании жидкости через пористую перегородку, по обейм сторонам которой находятся электроды, также бцло обнаружено возникновение разности потенциалов. Явление это, открытое Квинке в 1859 г. и обратное электроосмосу, было названо потенциалом протекания, или потенциалом течения.
Все четыре указанных’ явления, поскольку* "в них происходит передвижение частиц или жидкости при приложении разности потенциалов или, наоборот, возникает разность потенциалов при передвижении частиц или жидкости, получили общее название Электрокинетических явлений. Эти явления, будучи связанными с наличием межфазной поверхности, проявляются легче всего в высокодисперсных системах с большой удельной поверхностью.
Рассмотрим подробнее электрофорез и электроосмос, так как эти явления весьма важны для изучения и понимания электрических свойств коллоидных систем.
Совершенно очевидно, что причина всех электрокинетических 5івлений заключена в противоположности знаков заряда твердой фазы и жидкости. Это положение было принято еще Квинке и Гельмгольцем во второй половине XIX столетия. Однако вопрос, почему возникают эти заряды на межфазной границе, оказался гораздо более сложным.
Причиной возникновения заряда коллоидных частиц вначале считали переход электронов из одной фазы в другую при контакте двух фаз. Однако если бы эта точка зрения была правильной, то при электрофорезе должно было бы соблюдаться известное правило Кёна, согласно которому тела с большей диэлектрической проницаемостью должны заряжаться положительно, а с меньшей— отрицательно, поскольку первые обычно являю 1ся донорами, а вторые — акцепторами электронов. Для некоторых коллоидных систем, например для гидрозолей серы или эмульсий масла в воде, это правило как будто соблюдается. Однако для большого класса коллоидных систем, а имеиио для коллоидных растворов металлов и их окислов в воде, оно оказалось^ совершенно неприемлемым Частицы металлов, обладающих бесконечно большой диэлектрической проницаемостью, как правило, иесут отрицательный заряд, тогда как вода, имеющая по сравнению с ними небольшую диэлектрическую проницаемость, оказывается заряженной положительно. Кроме того, опыт показал, что знак заряда коллоидной частицы может меняться на обратный под действием весьма небольших количеств некоторых электролитов, не влияющих сколько-нибудь заметно на диэлектрическую проницаемость среды. Эти наблюдения показали несостоятельность теории, связывающей возникновение заряда с контактом двух фаз.
С современной точки зрения заряд на коллоидных частицах лиозолей, проявляющийся при электрофорезе, обусловлен наличием на их поверхности двойного электрического слоя из ионов", возникающего либо в результате избирательной адсорбции одного из ионов электролита, находящегося в растворе, либо за счет ионизации поверхностных молекул веществ. Правильность такой точки зрения подтверждают опыты, показавшие, что электрокинетические явления не наблюдаются или почти не наблюдаются в жидких средах с очень малой диэлектрической проницаемостью, в которых не происходит заметной диссоциации электролитов. К таким жидкостям относятся хлороформ, петролейный эфир, сероуглерод. В то же время электрокинетические явления наблюдаются в нитробензоле в таких слабо полярных жидкостях, как ацетон, этиловый и метиловый спирты, и в особенности — в воде.
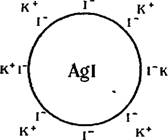
Образование двойного электрического слоя в результате избирательной адсорбции одного из ионов рассмотрено в гл. VI. На рис. VII, 3 в самом общем виде изображен двойной электрический слой, возникающий на кристаллах иодида серебра, находящихся в слабом растворе иодида калия [13]. Иодид-ионы (Потенциалопре — деляющие ионы) достраивают кристаллическую решетку иодида
серебра и тем самым придают частицам отрицательный заряд, а ионы калия (Противоионы) находятся в растворе вблизи межфазной поверхности. В целом, однако, весь комплекс, называемый Мицеллой, остается электронейтральным.
Впрочем, образование двойного электрического слоя в результате избирательной адсорбции одного из ионов, присутствующих в дисперсионной среде, может происходить и тогда, когда достройки кристаллической решетки нет. Например, двойной электрический слой образуется на частицах парафина, диспергированного в слабом растворе щелочи, за счет избирательной адсорбции гидр — оксильного иона, который в данных условиях проявляет лучшую адсорби — руемость, чем ион щелочного металла.
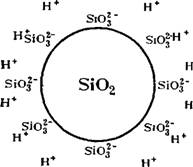
Возникновение двойного электрического слоя за счет ионизации можно проиллюстрировать образованием двойного электрического слоя на частицах водного золя двуокиси кремния. Молекулы Si02) находящиеся на поверхности таких частиц, взаимодействуют с дисперсионной средой, гидра — тируются и образуют кремневую кислоту, способную ионизироваться:
H2Si03 ^zt Siof" + 2Н+
При этом силикатные ионы SiO)~ остаются на поверхности частицы, об-1 условливая ее отрицательный заряд, а ионы водорода переходят в раствор. Схематически двойной электрический слой на поверхности частиц SiC>2 можно изобразить так, как это показано на рис. VII, 4. Понятно, что и в этом случае весь комплекс в целом будет электронейтрален. Конечно, вполне возможно, что не все молекулы Нг5Юз, находящиеся на поверхности, ионизируются. Кроме того, возможна — и одноступенчатая диссоциация на ионы БЮзН" и Н+. Но это не меняет сути дела.
|
К+ |
|
Рис. VII, 3. Схема образования двойного электрического слоя вокруг частицы иодида серебра, находящейся в растворе иодида калия. |
|
К+ |
Более подробно образование двойного электрического слоя на коллоидных частицах рассмотрено в следующей главе.
При действии электрического поля на частицы, несущие двойной электрический слой, происходит явление, напоминающее электролиз. Если дисперсная фаза заряжена отрицательно, коллоидные частицы вместе с адсорбированными на них отрицательными
потенциалопределяющими ионами движутся к аноду, а положительно заряженные противоионы — к катоду. Если дисперсная фаза заряжена положительно, направление движения частиц и ионов меняется на обратное. Следует отметить, что к электроду, имеющему заряд, одноименный с заряженными частицами, движется только часть противоионов. Другая часть противоионов, находящихся весьма близко от поверхности дисперсной фазы, под действием сравнительно значительных электрических и адсорбционных сил оказывается связанной с частицами и вынуждена двигаться вместе с ними. Явление электрофореза можно пояснить
Рис. VII, 5. Схема движения коллоидной частицы н противоионов прк электрофорезе.
Рис. VII, 4. Схема образования двойного электрического слоя вокруг частицы двуокиси кремния, находящейся н воде.
Схемой, изображенной на рис. VII, 5. При этом совершенно произвольно принято, что потенциалопределяющие ионы заряжены отрицательно, а противоионы — положительно. Конечно, электрофорез надо рассматривать не как простой перенос заряженных частиц и противоионов к соответствующим электродам, а как перенос, сопровождающийся постоянным взаимным обменом между противоионами соседних коллоидных частиц. В этом отношении электрофорез полностью сходен с электролизом, который осуществляется путем обмена ионов соседних молекул.
|
|
Изложенному представлению о существе электрофореза, казалось бы, противоречат сделанные ранее наблюдения об односторонности этого явления, т. е. наблюдения, показавшие, что при электрофорезе переносится только коллоидное вещество, но не происходит переноса ионов. Однако противоречие здесь только кажущееся, так как для образования на частицах двойного электрического слоя требуется ничтожно малое количество электролита, которое очень трудно определить количественно. Так, было найдено, что при получении золя сульфида мышьяка, для которого стабилизатором являются молекулы сероводорода, на 0,67 г AS2S3, выделившегося на аноде, приходилось всего ІО75 г водорода, выделяющегося на катоде. Понятно, что такое количество водорода с помощью обычных аналитических методов определить
невозможно, что и привело к возникновению в свое время неправильных представлений об одностороншети процесса электрофореза.
Аналогичное объяснение имеет и явление электроосмоса. Двойной электрический слой в этом случае образуется на внутренней поверхности капилляров пористого тела либо в результате избирательной адсорбции одного из ионов электролита, присутствующего в жидкости, заполняющей капилляр, либо вследствие ионизации молекул вещества, из которого состоят стенки капилляра, либо, наконец, в результате адсорбции на поверхности капилляра ионов ОН- или Н+, всегда присутствующих в воде.
На рис. VII, б изображен двойной электрический слой, образовавшийся в капилляре, причем условно принято, что потенциал- определяющие ионы заряжены отрицательно, а противоионы — положительно. При наложении на капилляр электрического поля путем введения в сосуды, которые он соединяет, электродов слой противоионов в капилляре будет смещаться параллельно неподвижному слою потен — циалопределяющих ионов к катоду, что вызовет и перемещение к катоду всей жидкости, заполняющей капилляр, под действием сил трения и молекулярного сцепления. Освободившиеся места противоионов немедленно занимают катионы, находящиеся в объеме жидкости, заполняющей капилляр, а соответствующие этим катионам ионы направляются к аноду (на рис. VII, 6 ионы, находящиеся в объеме жидкости, заполняющей капилляр, не изображены) .
К явлениям электрофореза и электроосмоса мы еще вернемся в конце этой главы, при рассмотрении количественной стороны обоих явлений.
 1 ноября, 2012
1 ноября, 2012  admin
admin 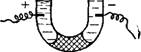
 Опубликовано в рубрике
Опубликовано в рубрике 