В предыдущих разделах рассмотрены свойства растворов полимеров, макромолекулы которых не содержат ионогенных групп. К таким полимерам относятся натуральный и синтетический каучуки, полиизобутилен, нитрат целлюлозы, ацетат целлюлозы и многие другие полимеры. Однако молекулы ряда высокомолекулярных веществ содержат ионогенные группы и в растворах способны распадаться на ионы. Такие высокомолекулярные электролиты, или полиэлектролиты, по природе содержащихся в них ионогенных групп можно разделить на три категории:
1. Полиэлектролиты, содержащие кислотную группу, например —СОО~ или —OSO3. Группу —СОО" содержат гуммиарабик, аль — гинаты, растворимый крахмал, а группу —OSO3 — агар.
2. Полиэлектролиты, содержащие основную группу, например —ЫНз. Такие вещества в природе не встречаются, но могут быть синтезированы.
3. Полиэлектролиты, содержащие одновременно как кислотную, так и основную группы (полиамфолиты). Сюда следует отнести белки, содержащие группы —СОО" и —NH3. В последнее время получены синтетические полиамфолиты, например сополимеры акриловой кислоты и винилпиридина, глютаминовой кислоты и лизина.
Свойства растворов полиэлектролитов
Полиэлектролиты, за исключением белков, характеризуются высокой плотностью расположения ионогенных групп — обычно на одно звено цепи приходится по одной ионогенной группе. У белков одна карбоксильная группа или амино-группа приходится на 6— 8 остатков аминокислот. Вследствие этого молекулы полиэлектролитов могут испытывать в растворах значительные электростатические взаимодействия, что приводит к сильной деформации цепей гибких молекул. Такая деформация, естественно, зависит от степени ионизации групп, которая в свою очередь является следствием
Присутствия в системе низкомолекулярных электролитов и рН раствора. Качальский показал, что при изменении рН раствора цепи полиакриловой кислоты могут самопроизвольно растягиваться и сокращаться в несколько раз.
Все высокомолекулярные электролиты растворяются в полярных растворителях, так как макромолекулы с ионогенными группами взаимодействуют с полярными жидкостями сильнее, чем с неполярными. Именно вследствие значительного взаимодействия высокомолекулярных электролитов (белков) со средой (водой) высокомолекулярные вещества одно время называли лиофильными коллоидами.
Рассмотрим важнейшие представители полиэлектролитов, а именно, белки, так как они ведут себя в растворах наиболее сложно. У других высокомолекулярных электролитов, содержащих либо одни кислотные, либо одни основные группы, исчезают только свойства, присущие отсутствующей ионогенной группе.
Молекулы белков, построенные из аминокислот, в водной среде содержат основные группы HONH3— и кислотные группы —СООН и поэтому являются амфотерными соединениями. Схематически белковую молекулу можно изобразить так: HONH3—R—СООН, где R — достаточно длинная углеводородная цепочка, обычно содержащая группы —CONH—. Однако следует помнить, что ионо — генные группы OHNH3— и —СООН могут располагаться не только на концах молекулы, но и в виде коротких боковых цепей, распределенных по всей длине основной цепи.
В водном растворе при определенной концентрации водородных ионов, отвечающей изоэлектрической точке, у всякого амфо — лита (амфотерного электролита) число ионизированных основных групп равно числу ионизированных кислотных групп. При этом число как тех, так и других групп минимально. Молекулу белка в изоэлектрическом состоянии следует считать в целом нейтральной, хотя она и имеет еще ионизированные группы. Условно ее мсіяно изобразить в этом состоянии следующим образом:
ОН" -f NH+—R—COO" + Н+
Поскольку белок обычно является более сильной кислотой, чем основанием, то изоэлектрическая точка его лежит при рН ниже 7. Иначе говоря, для достижения изоэлектрической точки в растворе белка должно содержаться некоторое количество кислоты, подавляющее избыточную ионизацию кислотных групп. Так как в изоэлектрической точке число взаимодействующих ионизированных основных и кислотных групп в молекуле одинаково, то гибкая макромолекула в этом состоянии свернется в клубок. Плотность клубка вследствие сил притяжения между разноименно заряженными группами будет больше той плотности, которая отвечает наиболее статистически вероятной форме макромолекулы или максимальной ее энтропии.
В кислой среде, например в присутствии НС1, когда в результате избытка водородных ионов подавлена ионизация карбоксильных групп, происходит следующая реакция:
ОН" + NH+—R—СООН + Н++ СГ —>- СГ + NHj—R—СООН + Н20
Молекула белка, ведущая себя в этом случае как основание, приобретает положительный заряд и при электрофорезе движется к катоду. Поскольку между одноименно заряженными группами, разбросанными по всей длине молекулы, действуют электрические силы отталкивания, свернутая в клубок цепная молекула белка в кислой среде будет стремиться распрямиться. Плотность молекулярного клубка в результате этого понизится и может стать даже ниже той плотности, которая соответствует наиболее статистически вероятной форме гибкой макромолекулы. Однако при большом избытке НС1 из-за наличия большого количества хлорид — ионов степень ионизации соединения CINH3—R—СООН, являющегося солью сильной кислоты и слабого основания, будет понижаться и молекула снова свернется в более плотный клубок.
В щелочной среде, например в присутствии NaOH, из-за большого количества находящихся в растворе гидроксильных ионов ионизация групп HONH3— подавлена и в растворе протекает следующая реакция:
HONH3—R—СОО" + Н’ — f Na+ + ОН" —>- HONH3—R—СОО" + Na+ + Н20
Молекула белка ведет себя здесь как кислота, она приобретает отрицательный заряд и при электрофорезе передвигается к аноду. В этом случае также в результате взаимодействия одноименно заряженных групп —СОО- цепная молекула стремится распрямиться и плотность молекулярного клубка уменьшается. Однако при избытке NaOH, из-за наличия большого количества ионов Na+ и снижения ионизации соли HONH3—R—COONa, заряд будет уменьшаться и макромолекула снова свернется в более плотный клубок.
На форму макромолекул действует не только изменение рН среды, но и введение в раствор индифферентного электролита. Не слишком большое количество электролита в растворе полиэлектролита подавляет ионизацию ионогенных групп и, очевидно, приводит к приближению формы макромолекул к наиболее статистически вероятным конформациям. При больших концентрациях электролитов начинает сказываться уже их высаливающее действие, что снижает растворимость высокомолекулярных веществ и приводит к образованию более плотных молекулярных клубков. При этом действие ионов низкомолекулярных электролитов, конечно, будет соответствовать тому порядку, в каком они стоят в лиотропном ряду.
Так как молекулы высокомолекулярного электролита обладают всеЪш свойствами обычных электролитов и в том числе способностью подавлять ионизацию других электролитов, то увеличение концентрации самого высокомолекулярного электролита в рас — творе будет действовать так же, как если бы в систему вводил» индифферентный электролит.
Из сказанного видно, что рН и введение электролитов влияют на заряд и форму молекул высокомолекулярных электролитов. Очевидно, эти факторы также должны влиять и на те свойства раствора, которые зависят от формы растворенных макромолекул. К таким свойствам относятся вязкость, осмотическое давление и объем студня набухшего высокомолекулярного вещества, если он не растворяется в данной среде.
Рассмотрим, как влияет рН — на свойства растворов белков.
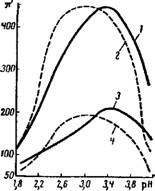
На рис. XIV, 13 изображена экспериментально найденная зависимость относительной вязкости 0,67%-ного раствора желатина от
|
|
|
?1—- 1—- 1 .1 , I—- I———— ——- L О 2 Ч 6 8 10 рН |
|
—- 1— 1— 1— 1__ і j. I 3 5 7 9 II РН |
|
Рис. XIV, 13. Зависимость относительной вязкости 0,67%-його |
|
Рис. XIV, 14. Зависимость набухания желатина от рН среды. |
Раствора желатина от рН среды.
РН этого раствора. Можно видеть, что наименьшая вязкость отвечает изоэлектрической точке (рН = 4,8), при которой молекула свернута в наиболее плотный клубок и благодаря малому объему этого клубка менее всего препятствует течению жидкости. Как с уменьшением, так и с увеличением рН вязкость раствора возрастает, так как в результате распрямления молекул объем клубка увеличивается. Однако при очень больших и очень малых значениях рН, вследствие уплотнения молекулярного клубка в результате подавления ионизации одноименно заряженных ионогенных групп,- вязкость раствора снова уменьшается.
Аналогичную форму должна иметь и кривая, выражающая зависимость объема студня желатина от рН жидкости, с которой студень находится в состоянии равновесия. Действительно, опыты Лёба показали, что степень набухания желатина в воде в зависимости от рН может быть представлена седлообразной кривой с минимумом, отвечающим изоэлектрической точке, и с двумя максимумами, лежащими по правую и левую сторону от минимума. Эта кривая изображена на рис. XIV, 14.
В связи с вопросом о влиянии ионизации ионогенных групп макромолекул на объем студня уместно хотя бы кратко остановиться на исследованиях,_ приведших к созданию общей теории набухания и «отбухания» студней высокомолекулярных электролитов при изменении степени ионизации.
Если к студню высокомолекулярного электролита приложить какую-нибудь нагрузку, то при поочередной ионизации и нейтрализации (моляризации) его мол’екул студень способен производить механическую работу. Таким образом, студень может служить не чем иным, как механо-химической машиной. Сетка из молекул высокомолекулярного электролита, подобно хорошо известным тепловым машинам, может производить работу, превращая химическую энергию в механическую, причем это может происходить при постоянной температуре. Работа мускулов живого организма тесно связана с механо-химическими процессами; именно ими объясняется способность человека производить работу.
Нетрудно представить, что кривая, выражающая зависимость осмотического давления раствора желатина от рН, также должна иметь седлообразную форму. В изоэлектрическом состоянии свернутая в плотный клубок, макромолекула обладает очень малой гибкостью и число сегментов, играющих роль кинетических единиц, минимально. При значениях рН выше и ниже изоэлектрической точки макромолекула желатина, распрямляясь, становится все более гибкой, что и обуславливает увеличение числа движущихся сегментов, а следовательно, и рост осмотического давления. При добавлении в раствор избытка кислоты или щелочи, как было показано выше, гибкость молекулярной цепочки начнет опять уменьшаться, уменьшится и число движущихся сегментов, в результате понизится также и осмотическое давление раствора.
На основании подобных же рассуждений нетрудно представить, как будет изменяться вязкость раствора высокомолекулярного электролита, его осмотическое давление или объем набухающего студня при введении в систему низкомолекулярного индифферентного электролита.
Мембранное равновесие Доннана. Зависимость свойств растворов высокомолекулярных электролитов от рН и содержания низкомолекулярных электролитов можно объяснить не только изменением формы макромолекулы в растворе, но и мембранным равновесием Д о н н а н а.’Правда, равновесие Доннана является формальным термодинамическим истолкованием процесса и с его помощью нельзя сделать вывода о молекулярном механизме явления. Кроме того, следует подчеркнуть, что равновесие Доннана, как и всякая термодинамическая интерпретация процесса, пригодно в том случае если имеет место равновесное состояние системы.
Рассмотрим зависимость осмотического давления растворов полиэлектролитов от рН и присутствия электролитов так, как ее представлял себе Дониан, А затем уже объясним, исходя из этой концепции, влияние рН и низкомолекулярных электролитов на объем набухшего студня и вязкость растворов полимеров
Как мы знаем, осмотическое давление растворов высокомолекулярных веществ можно определять гораздо более точно, чем осмотическое давление типичных лиозолей. Это обусловлено тем, что растворы высокомолекулярных веществ можно очищать с помощью длительного диализа или переосаждения, не опасаясь коагуляции. Однако практически обычно трудно удалить из раствора высокомолекулярного электролита все чужеродные электролиты, и осмотическое давление приходится определять в их присутствии. Чтобы исключить влияние низкомолекулярных электролитов на результаты определения, Дюкло и Маль — фитано пытались измерить осмотическое давление растворов высокомолекулярных электролитов, помещая диализуемый раствор в осмометре в ультрафильтрат. Однако, как показал Доннан, результаты этих исследований нельзя считать правильными.
Чтобы понять причину этого, представим себе, что при определении осмотического давления с помощью обычного осмометра с полупроницаемой мембраной в начале опыта в осмотическую ячейку налит раствор высокомолекулярного электролита, полностью распадающегося на не способные к диализу высокомолекулярные иоиы Rz+ н на малые ионы, например С1~, проникающие сквозь мембрану. Примем, что концентрация ионов RI+ во внутреннем растворе равна с і, тогда концентрация нонов в том же растворе будет гс,. Пусть во внешней жидкости осмометра содержится низкомолекулярный электролит, например хлорид натрия, оба иона которого (Na+ и С1~) способны проходить через мембрану. Обозначим концентрацию NaCl во внешнем растворе через с% Наконец, для упрощения допустим, что объемы внутреннего и внешнего раствора равны.
Тогда распределение ионов в начале опыта будет следующим:
Внутренняя жидкость (і) Внешняя жидкость (е)
[R*4l-ci [Na+]e = с2
[СГ], = 2Сі [С Г], = с2
Можно было бы предположить, как принимали Дюкло и Мальфитано, что хлорнд натрия в результате осмоса распределится равномерно по обе стороны полупроницаемой мембраны. Однако опыт показал, что это не так. Доннаном было установлено, что в рассматриваемом случае достигается равновесие общего вида:
Внутренняя жидкость (і) Внешняя жидкость (е)
[Rz+L = C, [т+]е = с2-х
[СГ], =»zc, + х [СГ]е = с2-*
При установлении равновесия иоиы низкомолекулярного электролита не могут проникать через мембрану порознь, так как в противном случае возникли бы электрические поля, препятствующие диффузии. Число ударов, производимых ионамн С1~ и Na+ одновременно на единицу площади внутренней стороны перегородки, зависит от произведения концентраций ионов, т. е. [Na+^-tCl"],. Для наружной стороны перегородки число одновременных ударов ионов будет пропорционально произведению [Na+]e-[Cl"]e. Очевидно, в системе установится равновесие, когда число пар ионов, проходящих в единицу времени через перегородку справа налево, будет равно числу пар ионов, проходящих слева направо. Иначе говоря, условием равновесия является равенство произведений концентраций ионов, находящихся внутри н снаружи мембраны и свободно проникающих сквозь нее:
[№+]г • [СГ], = [Na+]e ■ [СГ]е (XIV, 37)
Подставляя в уравнение (XIV, 37) найденные значения для [Na+],-, [Cl"]t, [Na+]^ и ГС1~]е, получаем:
Х(гс! + х) => (с2 — *)» (XIV, 38>
Или
Гсхх = с — 2С2Х (XIV, 39)
Откуда
Х = ваДгс! + 20а) (XIV, 40>
При условии Сі 3> Сз, т. е. когда в системе индифферентного электролиту мало
X=clj(zci) (X/V.4I)’
Из этого уравнения легко получить пропорцию:
X/C2=*C2/(Zci) (XIV, 42)
Эта пропорция показывает, что низкомолекулярный электролит, когда его мало, будет преимущественно находиться во внешней жндкостн.
При условии Ct <£ с2, т. е когда в системе индифферентного электролита «ного
At = сЦ(2с2) = с2 [2 (XIV, 43)
Иными словами, электролит распределится равномерно по обеим сторонам мембраны.
Рассмотренная схема относится к случаю, когда в начале опыта ннзкомоле — кулярный электролит находился только во внешней жидкости. Однако картина ■существенно не меняется, если низкомолекулярный электролит присутствует в начале опыта и в осмотической ячейке. Не меняется положение и в том случае, если у высокомолекулярного и низкомолекулярного электролитов нет общего иона, например, когда во внутренней жндкостн осмометра находятся ионы Rl+ я С1", а во внешней — Na+ и Вг~.
Нетрудно определить, из каких слагаемых состоит осмотическое давление в рассмотренном выше случае.
Если не считаться с приведенными выше соображениями и принять, что — присутствие ннзкомолекулярного электролита не оказывает влияния, поскольку •он свободно проходит через мембрану, то наблюдаемое осмотическое давление можно было бы выразить следующим уравнением:
Я = /?Гс, (г + I) (XIV, 44)
На самом деле в результате установления равновесия Доннана осмотическое давление раствора будет равно:
Я = RTCl + RT (гС| + х) + RTx — 2RT (с2 + *) (XIV, 45)
В правой части этого уравнения член RTct отвечает осмотическому давлению, обусловленному высокомолекулярными нонами, член RT(Zct + х) — осмотическому давлению хлорнд-ионовг, член RTx — осмотическому давленню нонов натрня инутрн Ъаейки осмометра, а член 2RT (с2 + х) —осмотическому давлению низкомолекулярного электролита в наружной жидкости Подставляя в приведенное уравнение значения х нз уравнения (XIV, 40) и проведя некоторые преобразования, получим:
Яд RTcl{z + )zcl+2c2
2С| +2 с2 v ‘
Это уравнение при условии Ct С2, т. е. когда в системе почти нет низкомолекулярного электролита, превращается в следующее:
Я=.£7С,(2+ 1) (XIV, 47)
Иными словами, осмотическое давление рредставляет в этом случае давление высокомолекулярного электролита.
При условии с, <£. с2, т. е. когда в системе много низкомолекулярного электролита, приведенное выше уравнение принимает вид:
N=>RTct (XIV, 48)
Это значит, что найденное осмотическое давление является давлением, обусловленным одними высокомолекулярными ионами.
При всех промежуточных соотношениях содержаний высокомолекулярного и низкомолекулярного электролитов осмотическое давление будет мениться в пределах от RTCi(Z — f 1) до RTct.
Из изложенного совершенно ясно, что при исследовании осмотического давления растворов высокомолекулярных электролитов всегда необходимо учитывать эффект Доннаиа. Практически для получения правильных результатов экспериментатор либо определяет концентрацию электролитов, находящихся в системе, и затем вводит в расчеты соответствующую поправку, либо измеряет осмотическое давление в присутствии избытка иизкомолекулярного электролита. В последнем случае найденное осмотическое давление отвечает осмотическому давлению одних высокомолекулярных иоиов.
Поскольку осмотическре равновесие устанавливается при неравномерном распределении ионов по обе стороны мембраны, в системе должна возникать разность электрических потенциалов между жидкостью внутри и снаружи осмотической ячейки (так называемый «мембранный потенциал»). Эту разность потенциалов можно обнаружить, вводя, например, во внутреннюю и внешнюю жидкости осмометра одинаковые каломельные электроды. Зная распределение электролитов в системе, по уравнению Нернста можно вычислить разность потенциалов. Лёб показал, что значения разности потенциалов, вычисленные и найденные экспериментально, довольно хорошо совпадают.
Теория мембранного равновесия Доинана позволяет объяснить седлообразную форму кривой, характеризующей зависимость осмотического давления раствора белка от рН среды. В самом деле, в изоэлектрической точке амфолита число ионизированных ионогенных групп минимально. Это и обусловит минимальное давление. При добавлении кислоты, например НС1, содержание анионов (хлорид-ионов) в растворе сначала растет быстрее, чем содержание ионов водорода (последние связываются с гидроксилами гидратированных амино-групп белка, образуя воду). Так будет продолжаться до тех пор, пока все гидроксильные группы не свяжутся с ионами водорода и группы OHNH3— не перейдут в группы CINH3—• В • этот момент осмотическое давление будет максимально, во — первых, потому, что группы CINH3— ионизируют значительно сильнее, чем группы OHNH3—, и, во-вторых, потому, что в системе не содержится еще чужеродного низкомолекулярного электролита (НС1), способного проникать через мембрану и, как уже было показано, понижающего осмотическое давление самого высокомолекулярного электролита Прн дальнейшем добавлении кислоты числа хлорид-ионов вследствие подавления диссоциации молекул белка будет становиться все меньше по сравнению с числом хлоряд-ионов и водородных ионов,, образовавшихся в результате диссоциации молекул кислоты Благодаря избытку низкомолекулярного электролита, распределяющегося равномерно во внутренней и внешней жидкостях осмометра, осмотическое давление будет обусловлено одними высокомолекулярными ионами Кроме того, благодаря наличию в системе избытка хлорид-ионов диссоциация группы CINH3 — уменьшается. Все это приведет к тому, что осмотическое давление при добавлении избытка кислоты будет падать
|
Рис. XIV, 15. Вычисленные и найденные значения осмотического давления подкисленных растворов желатина: / —НС1, найдено; 2—НС1, вычислено; 3 — H2SO<, найдено; 4—НгЗО», вычислено. |
Следует заметить, что теория Доннана не только объясняет форму кривой, характеризующей изменение осмотического давления при изменении рН, но и позволяет предсказать, что при введении в систему кислоты с двухвалентным анионом кривая должна лежать ниже кривой для кислоты с одновалентным анионом. На рис XIV, 15 изображены подобные кривые, полученные Лёбом Жри добавлении к раствору желатина НС1 и H2SO4. Сплошными линиями показаны
экспериментально найденные кривые, пунктирными — теоретически вычисленные (по Доннану). Некоторое расхождение экспериментальных и теоретических кри — ВЫХ объясняется, "очевидно, изменением степени ионизации групп C1NH3— при добавлении кислоты.
Аналогичная картина наблюдается и при повышении рН: осмотическое дав — ление раствора белка при добавлении щелочи сначала возрастает, а затем, достигнув максимума, начинает уменьшаться.
Теория Доннана удовлетворительно объясняет форму кривых, характеризующих изменение осмотического давления не только от рН раствора, но и от введения нейтральных электролитов. Однако рассмотрение этого случая выходит за пределы настоящего курса.
Очень просто объясняется с позиций теории мембранного равновесия и известная зависимость объема набухшего белка (например, студня желатина) от рН среды. Минимальная степень набухания студня должна соответствовать изоэлектрической точке белка, так как при этом минимально и осмотическое давление, являющееся причиной набухания. По обе стороны от этого минимума кривая зависимости объема от рН поднимается и, достигнув максимума, спускается, поскольку таким же образом от рН зависит и осмотическое давление. При трактовке набухания с точки зрения Доннана совершенно все равно, являются ли макромолекулы белка кинетическими отдельностями или образуют трехмерную сетку. Иначе говоря, безразлично, какими причинами удерживаются вместе поливалентные ионы в системе — в результате ли наличия полупроницаемой перегородки или тем, что эти поливалентные ионы связаны друг с другом прочными связями и образуют трехмерную сетку.
Аналогичным образом можно объяснить влияние нейтральных электролитов и на набухание белков. В кислой и щелочной средах все нейтральные соли уменьшают набухание белка, что вполне согласуется с теорией. Однако вблизи изоэлектрической точки соли могут как понижать, так и увеличивать набухание. При этом решающую роль играют анионы, которые по влиянию на набухание можно расположить в следующие ряды:
Анионы, увеличивающие набухание:
NCS" > I" > Вг" > N03" > СЮ"
Анионы, уменьшающие набухание:
СГ < СН3СОО" < —ООС—СН2—С(ОН)(СОО~)—СН2—СОО" <
Цитрат-иои
< "ООС—СН(ОН)—СОО" < sof
Тартрат-иои
Различное влияние анионов на набухание объясняется тем, что они обладают различным растворяющим или, наоборот, высаливающим действием на белки. Особая роль аниона по сравнению с катионом объясняется тем, что обратимый характер имеет лишь действие катионов щелочных металлов. Все поливалентные катионы дают при взаимодействии с RCOO" (обычным анионом высокомолекулярных электролитов) нерастворимые соединения, т. е. вызывают образование необратимого осадка.
В заключение рассмотрим, как можно объяснить мембранным равновесием влияние рН и нейтральных электролитов на вязкость белков. Седлообразный характер кривой, характеризующей изменение вязкости раствора белка в зависимости от рН, объясняется способностью кинетических отдельностей макромолекул, находящихся в растворе, изменять свой объем в результате набухания или «отбухания». Изменение объема частиц в растворе должно сопровождаться и соответствующим изменением вязкости. Лёб, впервые предложивший такое объяснение, считал мицеллу кинетической отдельностью в растворе белка. Однако в настоящее время, когда доказано, что высокомолекулярное вещество в растворе раздроблено до молекул, следует говорить о набухании не мицелл, а отдельных молекулярных клубков. Такой взгляд полностью согласуется с изложенными выше представлениями об изменении объема молекулярных клубков.
Исходя из аналогичных представлений, можно объяснить влияние на вязкость раствора полиэлектролитов и нейтральных электролитов. Интересно, что изменение вязкости в сильной степени зависит от валентности противоиона и лишь незначительно зависит от его положения в лиотропном ряду. Такое расхождение в действии нейтральных электролитов на набухание студия и вязкость раствора до известной степени понятно: в растворах взаимодействие между отдельными макромолекулами ие играет существенной роли, и лиотропное действие, приводящее к упрочнению или ослаблению связи между отдельными макромолекулами, здесь не может сказаться в той степени, в какой оно сказывается при набухании.
Эффект Доннана обусловливает распределение электролитов в тканях организма и является причиной возникновения биопотенциалов. Для лиофобных систем, как мы указывали в гл. III, эффект Доннана также имеет большое значение. Здесь роль мембраны или геля играют сами коллоидные частицы, на которых адсорбированы недиффундирующие ионы, что приводит к неравномерному распределению электролита в растворе. Особенно такое неравномерное распределение сказывается при центрифугировании золей (золь-концентрационный эффект) илн при оседании суспензии (суспензионный эффект Пальмана — Вигнера). При ультрафильтрации доннановскин эффект может приводить к неравномерному распределению электролитов в ультрафильтрате и в межмицеллярной жидкости.
Электрические свойства растворов полиэлектролитов. Электрокинетический потенциал, как известно, с большей или меньшей точностью может быть подсчитан по уравнениям Гельмгольца — Смолуховского или Генри только для коллоидных частиц, размер которых значительно превосходит толщину двойного электрического слоя. Для частиц же, диаметр которых мал по сравнению с толщиной двойного электрического слоя, при расчете электрокинетического потенциала следует вводить ряд поправок и в первую очередь поправку на электрическую релаксацию. Кроме того, если макромолекулы находятся в растворе в виде рыхлого клубка, то должно быть принято во внимание движение среды через петли свернутой цепи. К сожалению, до сих пор теория электрофореза для, свернутых в клубок макромолекул отсутствует. Поэтому в настоящее время распространено определение электрофоретической подвижности не отдельных макромолекул, а макромолекул, адсорбированных на достаточно крупных частицах кварца или угля или на капельках масла. В этом случае электрокинетический потенциал легко определить с помощью микроэлектрофоретических методов. Как показали многочисленные исследования, при достаточной толщине слдя полимера, покрывающего частицу, подобный прием дает вполне воспроизводимые результаты.
Однако следует указать, что значения электрокинетического потенциала, найденные для молекул высокомолекулярного электролита в растворе, весьма условны. Надо помнить, что ионогенные группы макромолекул, а следовательно, и заряды расположены дискретно по всей длине макромолекулы, и о двойном электрическом слое в обычном смысле слова здесь говорить трудно. Скорее, уместно проводить аналогию с отдельными обычными ионами, окруженными дебаевской ионной атмосферой. Поэтому найденные значения электрокинетического потенциала для растворов высоко* молекулярных электролитов только качественно характеризуют электрические свойства макромолекул в растворе.
Полиэлектролиты широко применяются в народном хозяйстве. Здесь мы только рассмотрим их применение в качестве флокудян — тов суспензий с полярной (водной) средой и в качестве ионообменных смол.
Полиэлектролиты как флокулянты. Наиболее эффективным» флокулирующими агентами, как показал Ла Мер, являются полиэлектролиты с достаточно высоким молекулярным весом. При этом полиэлектролиты следует применять в очень малых количествах, гак как их избыток стабилизует суспензии.
Флокуляция может происходить за счет того, что длинные цепи молекулы полиэлектролита адсорбируются одним концом на одной іастице суспензии, а другим — на другой частице, образуя между іастицами достаточно прочнцй мостик. Конечно, практически об — эазуются флокулы, состоящие не из двух, а из большего числа іастиц.
Другой механизм флокуляции заключается в образовании связи лежду активными группами отдельных молекул полиэлектролита, соторые в свою очередь связаны с различными частицами суспен — іий. Такие флокулы, естественно, могут быть легко отделены от юдной среды благодаря большому размеру.
Отделенные флокулы образуют рыхлый осадок, обладающий іекоторой прочностью. Если раствор полиэлектролита, способный іьізьівать флокуляцию, вводить в суспензию порошка или волокна, о полиэлектролит связывает частицы порошка или отдельные во — юкна, в результате чего можно получать после высушивания связ — [ую систему, представляющую практический интерес. Наиболее ффективно действие полиэлектролита совместно с обычными лектролитами. При этом полиэлектролнт следует вводить в сус — ензию раньше низкомолекулярного электролита. В противном лучае. агрегация частиц суспензии протекает плохо и осадок легко ептизируется.
Весьма важное значение для флокуляции имеет строение мо — екулы полиэлектролита и природа активных групп, а также спо — обность молекул полиэлектролита пребывать в водной среде в бо — ее или менее распрямленном состоянии. Молекулы полиэлектро — ита, находящиеся в среде в виде свернутых клубков с малым ко — [})фициентом асимметрии, обладают плохими флокулирующими зойствами, так как часть звеньев цепи, экранируемая соседними ктивными группами, образует внутримолекулярные связи, и, таим образом, эта часть цепи не может быть адсорбирована части — ами суспензии.
В настоящее время в Советском Союзе л за рубежом в промышленном масштабе выпускаются различные типы флокулянтов. Одним из наиболее применяемых флокулянтов является частично гидролизованный полиакриламид, который содержит группы —NH2 и —СООН (гидролиз, ведущий к образованию групп —СООН, следует проводить так, чтобы гидролизовалось всего 7з —NH2 групп. При большей степени гидролиза молекула полиакриламида приобретает настолько большой отрицательный заряд, что перестает адсорбироваться на обычно отрицательно заряженных частицах суспензий).
Полиэлектролиты в качестве флокулянтов прйменяются при коагуляции оборотной воды в угольной промышленности, для извлечения золота из промывных и сточных вод в золотообрабаты — вающей промышленности, что снижает потери золота на 99,9%; в бумажной промышленности для удержания наполнителя в бумаге и снижения потерь волокна; для очистки сточных вод. Однако, пожалуй, наиболее важно применение флокулянтов в сельском хозяйстве для придания нужных свойств почве. Введение в почву даже очень малых количеств флокулянтов (0,02—0,05% от слоя почвы глубиной 15 см) уменьшает эрозию, структурирует почву, что улучшает ее обрабатываемость, увеличивает влагоудер — живающую способность и водопрочность почвы. Введенный в почву полиэлектролит обычно сохраняет свое действие в течение 3 лет. Особенно эффективно введение флокулянтов в мелкозернистые глинистые почвы наших среднеазиатских республик. Поэтому центром синтеза и изучения применения новых флокулянтов является Ташкентский государственный университет (школа академика УзССР К. С. Ахмедова).
Полиэлектролиты как иониты. Ионитами, или ионообменными материалами, называются нерастворимые вещества, способные обменивать содержащиеся в них ионы на другие ионы того же знака, присутствующие в среде, с которой соприкасается ионит. В гл. VI мы познакомились с типичным представителем ионитов — пермутитом, применяющимся для извлечения из воды нежелательных поливалентных катионов (Са2+, Mg2+ и т. д.).
В последнее время в качестве ионитов стали применять синтетические смолы, причем существуют смолы, способные обменивать как катионы (катиониты), так и анионы (аниониты). Преимущество ионообменных смол перед ионитами других типов заключается в их высокой механической прочности, химической стойкости и большой сорбционной (обменной) емкости. Обмен ионов с помощью синтетических смол может происходить во всем объеме смолы, так как растворенные ионы обычно свободно проникают сквозь структурную решетку смолы.
Ионообменные смолы получают либо конденсацией или полимеризацией мономеров, уже содержащих активные группы, либо вводят эти группы в уже готовые смолы. При увеличении числа активных групп в ионообменной смоле возрастает ее обменная
способность, но одновременно возрастает способность набухать н» растворяться в воде. С увеличением числа поперечных связей в структуре смолы ее способность набухать и растворяться падает.
Размер зерен ионитов обычно лежит в пределах от 0,25 до 2,0 мм. Естественно, что чем меньше зерна ионита, тем быстрее идет обмен, но, с другой стороны, тем больше возрастает гидродинамическое сопротивление слоя.
Обменная емкость ионитов обычно выражается числом грамм — эквивалентов, извлекаемых с помощью 1 г сухого ионита. Обменная емкость зависит от характера содержащихся в ионите активных групп, от структуры ионита, а также От природы обменивающихся ионов, концентрации раствора и его рН. С увеличением рН емкость катионитов увеличивается, а анионитов падает. С уменьшением рН происходит обратное явление. Обменная емкость современных ионитов составляет 3—10 мг-экв/г. После насыщения ионита обычно его регенерируют. Для этого катиониты обрабатывают кислотой, а аниониты — растворами щелочей. После промывки регенерированного ионита он снова становится пригодным для использования,
Катиониты могут содержать в качестве активных групп —SO3H, —СООН, —ОН (фенольные). Катеонитами в сущности могут являться уже обычные феноло-формальдегидные смолы. Однако активная группа, содержащаяся в таких смолах (гидроксил), является слабой, поэтому, как правило, применяются катиониты, содержащие группу —SO3H или комбинацию групп —SO3H и —ОН. На рис. XIV, 16 изображена в схематическом виде структура простейшего катионита — полисульфостирола.
Аниониты могут содержать в качестве активной группы —NH2, = NH и s=N. Анионактивные смолы получили широкое распространение лишь сравнительно недавно. Достижением в области, анионактивных смол явился синтез сильноосновных анионитов. С их помощью удается удалять из воды опасную для котлов сла — бодиссоциирующую кремневую кислоту. Раньше это было невозможно, так как известные в то время аниониты имели слабоосновные свойства.
В последнее время были синтезированы синтетические смолы селективного действия, избирательно сорбирующие отдельные ионы, а также амфотерные иониты, пригодные для разделения аминокислот и амфотерных элементов. Начинают также применяться иониты с оптически активйыми группировками, с помощью которых можно разделить оптические изомеры.
Благодаря большим достижениям в синтезе ионообменных смол их стали применять далеко за пределами первоначальной области их использования — в водоочистке. Иониты применяются всюду, где требуется удаление, выделение и концентрирование ионов в растворах. Иониты используются в энергетической, химической, пищевой, фармацевтической, металлургической и в ряде других отраслей промышленности. Ионообменные смолы применяются для разделения ионов, которые до настоящего времени не могли быть разделены с помощью других методов. В частности, их применяют для разделения редкоземельных элементов, продуктов распада радиоактивных веществ и т. д. Широкое применение иониты находят при изготовлении чистых реагентов.
 1 ноября, 2012
1 ноября, 2012  admin
admin 
 Опубликовано в рубрике
Опубликовано в рубрике 