К особым явлениям, наблюдающимся при коагуляции электролитами, относятся так называемое явление неправильных рядов, антагонизм и синергизм ионов при коагуляции, «привыкание» золей к действию электролитов, коллоидная защита.
Это явление наблюдается при введении в коллоидные системы электролитов, содержащих многовалентные ионы с зарядом, противоположным заряду частицы. Оно заключается в том, что при добавлении к отдельным порциям золя различных, все возрастающих количеств электролитов золь сначала остается устойчивым, затем в определенном интервале концентраций происходит коагуляция, далее золь снова становится устойчивым и, наконец, при высоком содержании электролита опять наступает коагуляция, уже окончательная. Подобное явление могут вызвать и большие органические ионы красителей или алкалоидов.
Явление неправильных рядов объясняется тем, что при весьма малых количествах введенного электролита многовалентных ионов недостаточно, чтобы скоагулировать золь. При этой концентрации электролита ^-потенциал частиц выше критического его значения. При несколько больших количествах электролита его ионы проявляют уже коагулирующее действие. Этот интервал концентраций отвечает значениям электрокинетического потенциала частиц от £крит одного знака до &кРИт противоположного знака. При еще несколько больших концентрациях многовалентные ионы перезаряжают коллоидные частицы и золь становится опять устойчивым. В этой зоне ^-потенциал снова выше критического значения, но обратен по знаку ^-потенциалу частиц исходного золя. Наконец, при высоком содержании введенного электролита многовалентные ионы снова и уже окончательно коагулируют золь по механизму концентрационной коагуляции.
Для золей с отрицательно заряженными частицами и многовалентных катионов вышеуказанную зависимость хорошо иллюстрирует схема, приведенная на рис. IX, 14.
Следует заметить, что в последнее время получило распространение мнение, что перезарядка отрицательно заряженных частиц обусловлена не самими электролитами с многовалентными катионами, а продуктами их гидролиза, содержащими положительно заряженные ионы окислов или их гидратов. Доказательством этому служит то, что в кислых растворах перезарядка частиц вообще не происходит. В слабо щелочной среде изменение знака заряда может быть вызвано очень малой концентрацией поливалентного иона, но при еще более высоких значениях рН перезарядка снова становится невозможной из-за того, что образующиеся в этих условиях ионы гидратов окисей самн несут отрицательный заряд.
Правильность подобной точки зрения на перезарядку и явление неправильных рядов подтверждается тем фактом, что перезарядка имеет место и при введении электролита с двухвалентными ионамн, если только растворимость соответствующих гидратов окисей достаточно мала. Так, отрицательные частицы золя Agl могут стать положительно заряженными, если к нему добавить нитраты кадмия, цинка или магния и достаточное количество NaOH. Такой перезарядки ие происходит, если к золю Agl добавить Ва (ОН)2, так как растворимость гидрата окиси бария сравнительно велика.
Явление неправильных рядов, понятно, может наблюдаться и при добавлении к золю потен — циалопределяющих ионов (например, при добавлении AgNOa к золю галогеиида серебра с отрицательно заряженными частицами).
Явление неправильных рядов известно давно и получило свое название в то время, когда перезарядка частиц золей была мало исследована. На самом деле чередование зон устойчивости и неустойчивости лизолей при добавлении многовалентных ионов вполне закономерно, и поэтому термин «неправильные ряды» должен рассматриваться как условный.
Антагонизм и синергизм электролитов
Явления синергизма и антагонизма электролитов можно наблюдать при коагуляции золей смесями некоторых электролитов. Эти явления имеют большое практическое значение, так как даже при добавлении к коллоидной системе одного коагулятора благодаря содержанию в системе стабилизующего электролита коагуляция проходит в действительности под влиянием по крайней мере двух электролитов. Кроме того, в технике для коагуляции часто применяют смеси нескольких (обычно двух) электролитов.
При коагуляции золя смесью двух электролитов можно наблюдать три предельных случая.
|
|
|
Рис. IX, 14. Чередование зон устойчивости н неустойчивости при введении в золь с отрицательно заряженными частицами электролита с многовалентными катионами. Зоны неустойчивости заштрихованы. |
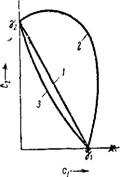
1. Аддитивное действие электролитов. На рис. IX, 15 этот случай характеризуется прямой /, соединяющей значения порогов
коагуляции уі и уг каждым электролитом (на оси абсцисс нанесены значения концентрации одного электролита, на оси ординат — значения концентрации другого). Электролиты действуют как бы независимо друг от друга.
2 Антагонизм электролитов (кривая 2), Электролиты как бы противодействуют друг другу и для коагуляции золя их нужно добавить больше, чем это требуется по правилу аддитивности.
3. Синергизм электролитов (кривая 3). Электролиты как бы способствуют друг другу и для коагуляции золя их требуется меньше, чем это нужно по правилу аддитивности.
Аддитивность обычно наблюдается при сходстве коагулирующей способности обоих электролитов (т. е. когда они содержат противоионы одинаковой валентности), антагонизм — при большом различии в коагулирующем действии электролитов. Условия, при которых наблюдается синергизм, трудно сформулировать.
Для объяснения антагонистического действия электролитов при коагуляции предложен ряд теорий.
Фрейндлих, создатель адсорбционной теории коагуляции, считал, что причиной антагонизма является способность одного иона понижать адсорбционную способность, а следовательно, и коагулирующую силу другого иона.
Согласно Свену Одену, Гошу и Дхару, а также Кройту, антагонизм ионов объясняется тем, что при введении смеси электролитов ионы какого-нибудь одного вида, адсорби — руясь на одноименно заряженных частицах, могут повысить их ^-потенциал, а следовательно, и устойчивсть системы.
Первая количественная теория коагуляции смесями электролитов была развита Ю. М. Глазманом на основе современной физической теории коагуляции лиофобных золей. Согласно этой теории антагонизм ионов (а также противоположный эффект — синергизм) для сильно заряженных золей есть следствие электростатических взаимодействий в диффузных атмосферах коллоидных частиц, а для слабо заряженных золей может обусловливаться конкуренцией ионов за места в адсорбционном слое.
|
Рис. IX, 15. Антагонизм и синергизм при коагулирующем действии электролитов: J — прямая, характеризующая аддитивное действие электролитоз; 2— кривая, характеризующая антагонизм, 3 —кривая, характеризующая синергизм. |
В 1961 г. была предложена более сложная теория коагулирующего действия смеси электролитов, которая учитывает адсорбционные явления и позволяет найти критические концентрации смеси по критическим потенциалам и определить способность к адсорбции отдельных компонентов. Основные положения этой теории заключаются в учете соотношения электростатической и ван-дер-
ваальсовой компонент энергии (или силы) взаимодействия частиц.
В ряде случаев на коагулирующее действие смеси электролитов может влиять химическое взаимодействие между их ионами, ведущее к образованию не обладающих коагулирующим действием комплексов или нерастворимых соединений. Примером может служить коагуляция золя Agl смесью электролитов K2SO4 и Th(N03)4, образующих комплекс Кг [Th(S04)3], в котором теряет свою коагулирующую силу.
Опыт показал, что при постепенном добавлении электролита коллоидные системы иногда теряют устойчивость при введении большего количества коагулятора, чем при одновременном его добавлении. Коллоидная система как бы «привыкает» к электролиту, отчего это явление и получило свое название. Наблюдаются также^ и явления отрицательного привыкания, когда прн медленном добавлении к золю электролита его требуется меньше для коагуляции, чем при быстром введении.
Существует несколько объяснений положительного и отрицательного привыкания коллоидных систем.
Согласно наиболее ранней теории положительное привыкание объясняется тем, что постепенно выпадающие в осадок агрегированные коллоидные частицы адсорбируют электролит, в результате чего уменьшается его эффективная концентрация в межмицелляриой жидкости н коагулятора для полной коагуляции системы требуется добавить больше, чем при одновременном его введеини.
Гош н Дхар считают, что положительное привыкание обусловлено медленно протекающей адсорбцией коллондиымн частицами одноименно заряженных с этими частицами нонов, что приводит к некоторому увеличению заряда, повышающему устойчивость золя. Однако было показано, что прн коагуляции адсорбция нонов, заряженных однонмеиио с коллондиымн частицами, происходит только в редких случаях н поэтому точка зрения Гоша н Дхара едва ли имеет достаточное основание.
Иначе подходит к явлениям привыкания В. Н. Крестннская. Она полагает, что положительное и отрицательное привыкание является результатом химических изменений, происходящих в коллоидной системе при добавлении электролитов. Например, явление положительного привыкания при добавлении НС1 в золь Fe(OH)3 она объясняется тем, что прн быстром введении коагулятора в золь гидрата окнсн железа он коагулирует, как под действием индифферентного электролита Прн медленном же добавлении коагулятора НС1 реагирует с дисперсной фазой золя.
Fe(OH)3 + 3HCI —>- FeCI3 + 3H20
Тем самым уменьшается количество дисперсной фазы н одновременно увеличивается количество растворимой соли железа, являющейся стабилизатором, вследствие чего н повышается устойчивость золя.
Отрицательное привыкание, согласно В. Н. Крестниской, сводится к обратным явленням — к уменьшению содержания стабилизатора (FeCI3) н увеличению количества дисперсной фазы [Ре(ОН)з]. Отрицательное привыкание у золя гидрата окнсн железа может быть вызвано, например, добавлением щелочей, уменьшающих в этом золе количество FeCb и увеличивающих количество Fe(OH)3.
Наиболее обоснована точка зрения на явления привыкания, основанная иа физической теории устойчивости. По мере постепенного возрастания концентрации прибавляемого к золю электролита высота энергетического барьера, имеющегося на путн сближения частиц золя, медленно уменьшается. Соответственно этому увеличивается доля эффективных сближений частиц, что и приводит к агрегацнн. В полном согласии с этнмн представленнями на опыте обычно наблюдается некоторая размытость порога коагуляции. Как следствие этого, в общем случае — при отсутствии побочных явлений — должно иметь место ие положительное, а отрицательное привыкание. Другими словами, причина отрицательного привыкания заключается в том, что при постепенном добавлении электролита первые его порции воздействуют на золь дольше, чем если бы электролит был добавлен единовременно. Каждая следующая порция электролита действует уже на изменившийся, несколько астабилизоваииый золь, и поэтому для достижения коагуляции требуется меньше электролита.
Было также показано, что описанные в литературе случаи положительного привыкания на самом деле являются результатом случайных ошибок или погрешностей опыта; при тщательно проведенном эксперименте всегда наблюдается отрицательное привыкание, что согласуется с теорией. Положительное привыкание может иметь место лишь в тех немногих случаях, когда электролит при очень малых концентрациях вызывает пептизацию коллоидной системы.
Защита коллоидных частиц и сенсибилизация
Как известно, типичные коллоидные системы весьма чувствительны к действию электролитов. Однако при введении в золь определенных высокомолекулярных веществ и образовании на поверхности частиц соответствующего адсорбционного слоя устойчивость системы может быть значительно повышена. Такое явление получило название коллоидной защиты.
Веществами, способными обусловливать коллоидную защиту, являются белки, углеводы, пектины, а для систем с неводиой дисперсионной средой — каучук. Часто эти вещества называют защитными коллоидами, хотя такое название является по существу неправильным и объясняется лишь исторической традицией.
Защитное вещество как бы придает золю свойства раствора этого вещества. В присутствии высокомолекулярных защитных веществ золи, вообще ие поддающиеся концентрированию до высокого содержания дисперсной фазы, можно выпарить досуха и затем полученный сухой остаток можно снова коллоидно растворить. Электрофоретическая подвижность частиц золей, адсорбировавших достаточное количество защитного вещества, обычно равна элек- трофоретической подвижности молекул полимера. Наконец, защищенные золи при добавлении электролитов ие подчиняются правилу Шульце — Гарди, а ведут себя как растворы защитного высокомолекулярного вещества, причем для выделения дисперсной фазы в осадок требуется то же количество электролита, что и для осаждения высокомолекулярного вещества. Существенно также, что реагент, способный осаждать защитное вещество, осаждает и защищенный золь даже в том случае, если исходный золь индифферентен к этому реагенту. Так, золи, защищенные желатином, теряют устойчивость при добавлении таннидов, образующих с желатином нерастворимое соединение, в то время как незащищенные золи нечувствительны к действию таннидов.
Для характеристики защитного действия различных высокомолекулярных веществ Зигмонди предложил так называемое «золотое число». Под золотым числом подразумевают число миллиграммов высокомолекулярного вещества, которое необходимо добавить к 10 мл красного золотого золя для того, чтобы предотвратить его посинение при введении в систему 1 мл 10%-ного раствора хлорида натрия. Понятно, что полученные таким образом золотые числа являются в достаточной мере условными, так как на защитное действие вещества влияет ряд факторов — дисперсность золя, молекулярный вес защитного вещества, значение рН системы, при котором проводится испытание, и т. д.
Иногда при определении защитного действия высокомолекулярного вещества вместо золя золота пользуются коллоидными растворами серебра, красителя конго-рубин, гидрата окиси железа и др. В этих случаях говорят соответственно о серебряном, рубиновом, железном и других числах. В табл. IX, 2 приведены значения этих чисел для некоторых защитных веществ.
|
Таблица IX, 2. Защитное действие высокомолекулярных веществ на различные золи
|
Механизм защитного действия сводится, как мы уже указывали, к образованию вокруг коллоидной частицы адсорбционной оболочки из высокомолекулярного вещества. Электрониомикроско — пические снимки непосредственно доказали наличие таких защитных оболочек. Например, адсорбционные слои из метилцеллюлозы на частицах полистирола имеют толщину 70—100 А. Защитный слой, если он образован из макромолекул, имеющих полярные или ионогенные группы, может обеспечивать индуцированную сольватацию частицы и достаточно высокий ^-потенциал, что обусловливает повышенную устойчивость системы. Кроме того, согласно новейшим представлениям, стабилизация коллоидных частиц может происходить вследствие теплового движения и взаимного отталкивания гибких макромолекул, только частично связанных с частицами золя в результате адсорбции отдельных их участков (энтропийный фактор устойчивости).
Защита коллоидных частиц применяется при изготовлении лекарственных препаратов. В организм часто необходимо вводить лекарственные вещества в мелкораздроблеином, коллоидном состоянии с тем, чтобы они равномерно распределились в нем иг постепенно растворяясь, оказывали нужное воздействие. Для этого как раз и пригодны защищенные золи или суспензии лекарственных веществ. В качестве примера такого препарата можно привести высокодисперсное серебро, стабилизованное белком, называемое в медицине колларголом.
Иногда введение в коллоидную систему очень малых количеств высокомолекулярного вещества приводит не к защите, а, наоборот, к сенсибилизации, т. е. к тому, что порог коагуляции золя, в который введено высокомолекулярное вещество, оказывается меньшим, чем для исходного золя.
Если введенные в систему макромолекулы несут заряд, разноименный с зарядом коллоидных частиц, сенсибилизация объясняется как одна из форм взаимной коагуляции, механизм которой будет рассмотрен ниже. Однако сенсибилизация наблюдается н тогда, когда частицы золя и молекулы полимера имеют одноименный заряд. Такая сенсибилизация объясняется тем, что различные участки одной и той же макромолекулы адсорбируются на поверхности разных коллоидных частиц и таким образом как бы «склеивают» частицы, образуя из них агломераты. При этом адсорбция происходит обычно уже после добавления коагулирующего электролита, способствующего адсорбции высокомолекулярного вещества.
 1 ноября, 2012
1 ноября, 2012  admin
admin 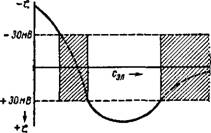
 Опубликовано в рубрике
Опубликовано в рубрике 