Прежде чем перейти к обсуждению причин устойчивости и коагуляции лиозолей, рассмотрим теорию кинетики коагуляции, которая, кстати говоря, была разработана гораздо раньше теории устойчивости коллоидных систем.
Различают быструю и медленную коагуляцию. Под быстрой коагуляцией подразумевают такую коагуляцию, при которой все сближения частиц, находящихся в броуновском движении, кончаются их слипанием. При медленной коагуляции вследствие того, что на поверхности коллоидных частиц частично сохранился двойной электрический слой^сольвауная оболочка и т. д., слипание ча — стйцПп^"йсхбдатг"лишь" в результате особо удачных сближений. Таким образом, оба термина являются вполне условными.
Теория кинетики быстрой коагуляции создана польским ученым Смолуховским. Основные положения, из которых исходил Смолуховский, сводятся к тому, что между частицами золя действуют силы притяжения и отталкивания; последние ослабевают при введении электролита и при концентрации электролита, вызывающей быструю коагуляцию, исчезают вовсе. Дальнейшее прибавление электролита не может ускорить коагуляцию. Частицы такого астабилизованного золя при сближении в процессе броуновского движения на достаточно близкое расстояние слипаются под давлением сил молекулярного притяжения, образуя агрегат, который совершает в дальнейшем броуновское движение как одно целое. Природу сил, действующих между частицами, Смолуховский не рассматривал.
Для экспериментального изучения кинетики коагуляции необходимо было определить изменение концентрации частиц в золе по мере коагуляции. Это можно было бы осуществить путем счета частиц с помощью ультрамикроскопа. Однако определение численной концентрации таким методом весьма длительно, а коагуляция протекает обычно очень быстро, так что к концу счета концентрация частиц в золе оказалась бы совсем иной, чем в его начале. Выход был найден в том, что в золь, в который был уже введен электролит и который таким образом находился в состоянии коагуляции, в определенный момент вводился стабилизатор, «обрывающий» коагуляцию. В таком стабилизованном золе численная
концентрация частиц уже не меняется и его можно исследовать с помощью ультрамикроскопа. В качестве стабилизатора для «обрыва» коагуляции обычно применялся желатин. В настоящее время метод, основанный на счете частиц в неподвижном объеме, не — применяется.
Кювременный метод изучения процесса коагуляции основан на счете частиц в потоке. Поточный ультрамикроскоп, разработанный впервые Б. В. Дерягиным и Г. Я. Власенко, описан в гл. II. Этим прибором можно определять численную концентрацию, не прерывая процесса коагуляции, во много раз быстрее, чем по старому способу. Одновременно новый способ устраняет многие источник»
Ошибок, присущие старому методу измерения численной концентрации золя. Недавно этот метод был усовершенствовав Мак Файденом и А. Смитом.
Смолуховский при создании своей теории принимал, что скорость быстро» коагуляции, т. е. изменение численной концентрации частиц в единицу времени, зависит от численной концентрации золя v, от интенсивности броуновского движения, характеризующейся коэффициентом броуновской диффузии частиц D, и от критического расстояния р, на которое должны приблизиться друг к другу центры двух частиц, чтобы произошло слипание частиц. Расстояние р может превышать диаметр коллоидных частиц, (рис. IX, 1). Таким образом, если представить се, бе сферу радиуса р, центр которой совпадает с центром одной из частиц, друга» частица прилипнет к ней только тогда, когда центр второй частицы коснется поверхности этой сферы, называемой сферой поглощения. При расстояниях, больших р, действием молекулярных сил притяжения на броуновское движение частиц и на процесс их. сближения Смолуховский полностью пренебрегал.
|
Рис. IX, 1. Схема, поясняющая сферу действия частиц при быстрой коагуляции. |
При быстрой коагуляции агрегация, согласно Смолуховскому, идет таким образом, что первоначальные одинарные частицы, сталкиваясь друг с другом, образуют двойные частицы, затем двойные частицы, сталкиваясь с одинарными, образуют тройные и т. Д — Возможны столкновения между собой и сложных частиц. Одновременное столкновение трех н более простых или сложных частиц возможно, но вследствие малой вероятности такого события Смолуховский для упрощения теории не принимал в расчет подобные столкновения.
Обозначая через vi, V2r V3 … численные концентрации частиц, состоящих из одной, двух, трех и т. д. первоначальных частиц, можно написать, что в начале, когда время т = О
V, = v0 и va = v3 = … v„ = О
По истечении времени т
V = vt = Vj + v2 + v3 + … где v — конечная численная концентрация.
При этом, очевидно, будет соблюдаться неравенство:
V < v0
Смолуховский считал, что формально процесс коагуляции можно приравнять к реакции второго порядка. Тогда скорость коагуляции должна быть прямо пропорциональна квадрату численной концентрации, определяющему вероятность (или частоту) сближения частиц до расстояния р:
-rfv/rfr = Kv2 (IX, I)
Где к — константа, характеризующая вероятность сближения.
Знак минус перед производной dv/dr стоит потому, что с течением времени т численная концентрация v падает.
По Смолуховскому, константу к, зависящую от скорости броуновской диффузии D и расстояния р, можно выразить так:
К = 4NDp (IX, 2)
Уравнение (IX, 2) можно вывести следующим образом. Совместим начало координат с центром какой-либо произвольно выбранной частицы. В этой системе координаты смещения остальных частиц Д’ будут в действительности равняться смещениям относительно выбранной, т. е.
Д’ = Д,- Д,
Где Л» — действительное смещение какой-либо i-частицы; Ді — смещение частицы, помещенной в начало координат.
Очевидно, что возведя обе части уравнения в квадрат и усредняя по времени тГполучим:
(Д7)2 = (Д7^)2 = Д? — 2Д^ + Д2 (IX, 3)
В этом уравнении черта над символом величины означает, что берется среднее значение этой величины.
При броуновском движении смещения обеих частиц совершенно независимы друг от друга. Поэтому, как можно строго доказать статистически, порядок операций усреднения и умножения можно обратить:
Д^> = А{ • Ді
Но Д, = 0 и Ді = 0, так как все направления смещений равновероятны. Поэтому Д, Ді = 0 и, следовательно
Щ_
(д’)2= Д?+Д? = 2Ді (IX, 4)
Таким образом, средние квадраты смещений всех частиц относительно первой удваиваются. Благодаря связи Д2 с коэффициентом диффузии можно сказать, что броуновское движение остальных частиц относительно первой характеризуется вдвое большим коэффициентом диффузии D‘. В результате этого время от времени частицы будут сближаться с первой до критического расстояния их Центров р. Подсчитаем число таких сближений, не учитывая тех осложнений, которые возникают при изменении броуновского движения вследствие слипания частиц. Для этого примем, что после сближения частиц до расстояния центров р соответствующая частица как бы поглощается центральной. Пусть частицы заключены в очень большой объем. Допустим также, что в рассматриваемый момент коагуляции численная концентрация v равна vT. Однако в непосредственной близости от поверхности поглощающей сферы концентрация частиц близка к нулю, так как ввиду беспорядочного характера броуновского блуждания вероятность попадания частицы, находившейся вблизи поглощающей сферы, в эту сферу очень велика, а вероятность избежать этого мала. При удалении от сферы р быстро достигаются значения vT. Совокупное перемещение частиц, совершающих независимо друг от друга беспорядочные блуждания, описывается уравнением диффузии. Допустим, что концентрация частиц v(R) зависит только От расстояния R от начала координат, к которому направлен поток диффузии, вызванный поглощением частиц сферой радиуса р. В этом случае из законо» диффузии следует:
Q = Д’.* — О’Ш* (IX, 5)
Где Q — число частиц, проходящих за единицу времени через поверхность сферы s радиуса R по направлению к центральной частице.
Число Q, очевидно, равно числу частиц, поглощенных за единицу времена центральной частицей при сближении с ней, т. е. Q равно искомой частоте актов агрегации с участием центральной частицы.
Учитывая граничное условие
V (р) = О (IX, 6)
Которое следует из того, что частицы, достигнув сферы р, поглощаются центральной частицей, и интегрируя уравнение (IX, 5), получим:
Учитывая другое граничное условие
V(co) = v0 (IX, 8)
Получим:
Q = 4п1У�р (IX, 9)
Общее число сближений всевозможных частиц в единице объема можно определить, умножая Q на численную концентрацию v и деля полученное произведение на 2, так как иначе каждая пара частиц будет подсчитана дважды. Заменяя D‘ на 2D, получим:
— rfv/rfr = 4nDpv2 (IX, І0>
Сравнивая это уравнение с уравнением (IX, 1), мы найдем значение константы к в уравнении Смолуховского (IX, 2):
К = 4я£>р
Следует заметить, что формула Смолуховского предполагает существование начального момента коагуляции, до которого слипания частиц не происходило. Поэтому в начальный момент центральная частица окружена частицами, концентрация которых всюду равняется Vo. Вследствие этого в начале процесса Коагуляции частота сближения и слипаний несравненно больше, чем величина Q В уравнении (IX, 9). Однако очень скоро именно благодаря высокой начальной частоте сближений концентрация частиц вблизи центральной уменьшается до нуля, и за доли секунды установится распределение частиц, подчиняющееся уравнению (IX, 6). После этого скорость коагуляции будет подчиняться уравнению Смолуховского.
Однако через некоторое время начнутся отклонения от закона Смолуховского, Основная причина заключается в том, что коэффициент к в формуле (IX, 2), выведенный при рассмотрении процесса сближения двух одинарных частиц, принимает иное значение при сближении с агрегатом слипшихся частиц другого агрегата или даже одиночной частицы.
Придав уравнению (IX, 1) вид:
— rfv/v2=fcdr (IX, И)
И проинтегрировав его в пределах от vo до v и от 0 до т, получим:
I/v — I/vo = кх
|
Vo |
|
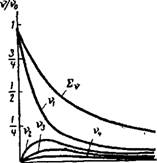
Рнс. IX, 2. Зависимость относительного числа частиц различного порядка от т/0 при быстрой коагуляции. |
|
Ф- |
Откуда численная концентрация золя в момент т будет равна:
(IX, 12)
1 + kv0t
Вводя время половинной коагуляции 9, можем написать
/cv о = 1/е (IX, 13)
Тогда основное уравнение (IX, 12) можно представить так:
V—пЙ/ё <1Х’,4>
По уравнению IX, 14, зная vo и v для различных значений т, можно вычислить 0 и к.
Графически зависимость относительных изменений общего числа частиц £ v и числа частиц vi, V2, V3 … в единице объема золя от т/0 показана на рис. IX, 2. Из уравнения (IX, 14) следует, что 1/v есть линейная функция времени т. Это следствие теории неоднократно было подтверждено на опыте.
Теория Смолуховского позволяет также вычислить расстояния р, на которые должны приблизиться центры двух частиц для того, чтобы произошло их слипание.
Так как
1 1
Q.________
Kv0 4itЈ>pv0 И, согласно Эйнштейну,
|
D = kT |
1
(IX, 15)
6ят)Г
Где K — константа Больцмаиа; т) — динамическая вязкость дисперсионной среды; Г — радиус частиц,
То, комбинируя два последних уравнения, получим:
6т)г
|
Или |
|
(IX, 16) |
4р �kT Зті
2v„A:Г9
Согласно эксперименту, р/г = 2,3, следовательно, расстояние р довольно близко к 2г, т. е. силы аттракции начинают действовать
Лишь тогда, когда частицы приблизятся на весьма малые расстояния, на которых энергия ‘молекулярного притяжения становится намного больше энергии теплового, а следовательно, и броуновского движения 3likT.
Представления Смолуховского объясняют коагуляцию монодисперсных золей. Мюллер разработал подобную же теорию для объяснения коагуляции полидисперсных систем. Он показал, что частицы различных размеров агрегируются всегда скорее, чем одинаковые частицы. При этом большие частицы играют роль как бы «зародышей» коагуляции; такую же роль могут играть и агрегаты, образующиеся в начальной стадии коагуляций приблизительно монодисперсного золя золота, как об этом свидетельствуют наблюдения Б. В. Дерягина и Н. М. Кудрявцевой. Впрочем, положения Мюллера полностью верны лишь тогда, когда в золе имеются частицы, существенно превосходящие по размеру малые частицы. Теория Мюллера объясняет автокаталитический характер коагуляции, скорость которой может постепенно возрастать со временем. Мюллер также показал, что коагуляция ускоряется, если частицы имеют удлиненную форму, так как на поступательное броуновское движение налагается еще вращательное движение, увеличивающее вероятность столкновения таких частиц.
Теория СМолуХовского, как мы неоднократно подчеркивали,, пригодна "Для быстрой коагуляции. Им было сделано предположение, что разработанная "теория может быть приложима и к медленной коагуляции, когда частицы не полностью астабилизованьи В этом случае в уравнение IX, 12, описывающее процесс коагуляции, следует ввести эффективность сближения є:
Vt—r-r^s———- (IX, 17)
Т 1 + e/cv0T ‘
Однако, как следует из теории коагуляции Н. А. Фукса, приложи — мой к частицам, силы взаимодействия между которыми изменяются с расстоянием по любому закону, параметру є надо придать другой смысл, так как понятие эффективности сближения по Смо — луховскому неприменимо к процессу сближения частиц, совершающих броуновское движение.
Теория Смолуховского предполагает, что до сближения частиц на определенное расстояние р никаких сил взаимодействия между ними нет. Для учета сил дальнодействия частиц, как функции от расстояния их центров R, Н. А. Фукс дополнил формулу (IX, 5) членом, выражающим дрейф частиц по направлению к центральной частице под влиянием сил притяжения F:
Q = 4n/?2U>’ dv/dR + 2$Fv) (IX, 18>
Где Р — подвижность частицы в вязкой среде, равная отношению ее скорости к действующей силе; цифра 2 перед р введена потому, что в действительности обе частицы движутся навстречу друг другу.
Согласно Эйнштейну р = D/kT, следовательно, 2|3 = D‘/kT. Далее, заменяя силу F на dU/dR (где U — потенциальная энергия молекулярного взаимодействия двух частиц) и интегрируя уравнение (IX, 18), вместо (IX,9) получим:
Q =[18] оо WV°—————- (IX, .9)
При £/(/?)= О снова получается формула (IX, 9). Уравнение (IX, 19) было выведено Н. А. Фуксом первоначально для аэрозолей с целью учета ускорения коагуляции под влиянием притяжения разноименно заряженных частиц. В этом случае потенциальная энергия взаимодействия отрицательна и скорость коагуляции возрастает.
В общем случае из (IX, 19) вместо (IX, 10) можно получить уравнение
4"°PV2———- (IX, 20)
J eu^’kTdRlR2
Р
И вместо константы Смолуховского к величину, меньшую в W раз, где
Оо
W №)/kT dR/R2
Р
Величину W называют коэффициентом замедления. Легко видеть, что уравнение медленной коагуляции получится путем замены е на 1 /W. Таким образом, теория Фукса дает теоретическое истолкование коэффициента Смолуховского е.
Для коллоидной химии особый интерес представляет случай, когда между частицами преобладают силы отталкивания. При этом U(R)> 0, и если для каких-то значений R величина U{R) Много больше, kT, то значение Q становится крайне малым. Это Значит, Что скорость коагуляции настолько снизится, что можно говорить о практической агрегативной устойчивости системы.
Для исследования кинетики коагуляции Б. В. Дерягиным и Н. М. Кудрявцевой был применен поточный ультрамикроскоп (по схеме, близкой к поточному ультрамикроскопу для аэрозолей Б. В. Дерягина и Г. Я. Власенко). С помощью поточного ультрамикроскопа можно определять за 2—3 мин численную концентрацию гидрозолей вплоть до 1010—10" частиц в 1 см3; другие способы счета частиц не позволяют измерять концентрацию больше 10*— 105 частиц в 1 см3. При применении достаточно концентрированных золей с помощью поточного микроскопа можно наблюдать не только быструю, но и медленную коагуляцию, отвечающую малым значениям коэффициента е, не затрачивая для этого чрезмерно много времени.
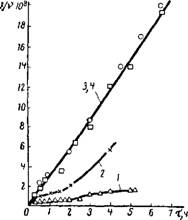
На рис. IX, 3 приведены графики зависимости І/v от времени т, прошедшего от начала коагуляционного процесса для сравнительно низкодисперсного голубого гидрозоля золота; отдельные кривые отвечают различным концентрациям коагулирующего электролита. Можно видеть, что при высокой концентрации электролита (кривые 3 и 4), при которой потенциальный барьер * исчезает, кинетика коагуляции характеризуется линейной зависимостью, вытекающей из теории
Смолуховского. Несколько меньший наклон прямой к оси абсцисс объясняется согласно В. М. Муллеру тем, что на близких расстояниях вязкое сопротивление жидкой прослойки сближению сферических частиц возрастает по сравневию с сопротивлением, рассчитанным по формуле Стокса При малых концентрациях электролита линейная зависимость ^кривые 1, 2) нарушается. Типичной является кривая 2. После начального подъема кривой следует участок, почти параллельный оси абсцисс, и в некоторый момент происходит новый подъем кривой, в дальнейшем не прекращающийся. Согласно Б. В. Дерягину и Н. М. Кудрявцевой первоначальный подъем кривой и, следовательно, уменьшение численной концентрации золя означает образование агрегатов из двойных частиц. При малых концентрациях электролита ближняя потенциальная яма сравнительно не глубока, энергетические взаимодействия не велики и потому распады образовавшихся двойных частиц происходят с достаточной частотой.
Прн достижении определенной концентрации двойных частиц их распады уравновешивает процесс слипания одиночных частиц, вследствие чего численная концентрация золя становится постоянной. В некоторый момент к одной из двойных частиц прилипает третья частица, образуя тройную частицу. Энергия связи каждой из трех частиц образовавшегося агрегата в два раза больше, чем у частицы, входящей в двойную частицу. Поэтому такая тройная частица имеет мало шансов распасться. Одновременно происходит дальнейший рост агрегатов за счет присоединения новых частиц. И действительно, визуальные наблюдения под микроскопом показали, что в некоторый момент среди сравнительно слабо видимых частиц (по «вспышкам» в поле зрения поточного ультрамикроскопа) появляются все более яркие и коагуляция все более ускоряется. Этнм объясняется форма кривых с перегибом. При более высоких концентрациях электролита вследствие снижения энергетического барьера и углубления потенциальной ямы горизонтальные участки графика укорачиваются и, наконец, исчезают, ио S-образная форма кривых сохраняетсяГТаким образов, при изучении коагуляции необходимо учитывать не только процессы агрегации, но и распада агрегатов.
Дальнейшее развитие этих положений принадлежит Г. А. Мартынову и В. М. Муллеру. В определенных условиях может устанавливаться агрегативное равновесие между одинарными и агрегированными частицами. Хотя вероятность распада крупных агрегатов меньше, чем парных, все же уменьшение числа одинарных частиц в конечной стадии коагуляции может настолько понизить скорость образования новых агрегатов, что коагуляция будет уравновешена скоростью распада агрегатов. Следовательно, возможно равновесие между коагулятом и оставшимся разбавленным золем. Это явление, однако, не носит общего характера, так как существуют золи, коагулирующие необратимо, и обнаруженное поведение золей золота в работе Н. М Кудрявцевой, по-видимому, связано с частичной гидрофилизацией поверхности его частиц за счет адсорбции органических компонентов, остающихся в золе после его приготовления.
|
Рис. IX, 3. Кинетика коагуляции голубого гидрозоля золота в присутствии хлорида кални. Концентрация коагулирующего электролита (в моль/л): 1—5-Ю-3; 2—1 • Ю-2; 3 —5 • Ю-2; 4 — 1 • Ю-1. |
Следует отметить, что учет образования и распада агрегатов и его ускорения в градиентном потоке, как было показано уже давно Гудивом, Жнллепси и др., позволяет объяснить реологическое поведение тиксотропных суспензий, о чем будет сказано в гл. X.
От распада агрегатов в процессе коагуляции следует отличать явление пептизации — распада агрегатов в результате изменения ионного состава дисперсионной среды, о чем уже говорилось в гл. VIII. В этом случае пептизация происходит благодаря усилению электрической слагающей расклинивающего давления и уменьшению глубины потенциальной ямы.
 1 ноября, 2012
1 ноября, 2012  admin
admin 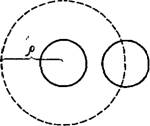
 Опубликовано в рубрике
Опубликовано в рубрике 