Гетерогенные системы, называемые эмульсиями, широко распространены в природе (молоко, млечный сок растений и т. д), их легко изготовить также искусственным путем (пропиточные составы для придания тканям водонепроницаемости, смазки, маргарин, косметические кремы и т. д.).
Условия, необходимые для образования эмульсий, сходны с теми условиями, которые нужны для получения коллоидных систем с твердой дисперсной фазой и жидкой дисперсионной средой. Обе жидкости, образующие эмульсию, должны быть нерастворимы или мало растворимы друг в друге, и в системе должен присутствовать стабилизатор, который в этбм случае называют эмульгатором. Эмульсии тем седиментационно устойчивее, чем ближе плотности обеих фаз.
Отличительной особенностью не слишком концентрированных эмульсий является сферическая форма частиц (капелек). Как правило, дисперсность лиофобных эмульсий значительно ниже дисперсности золей с твердой дисперсной фазой.
От типичных лиофобных эмульсий следует отличать так называемые критические — лиофильные эмульсии. Критические эмульсии— это системы, образующиеся обычно из двух ограниченно смешивающихся жидкостей (например, анилина и воды, изоами — лового спирта и воды) при температурах, весьма близких к критической температуре смешения, когда поверхностное натяжение на границе фаз становится весьма малым (порядка 0,01 эрг/см2) и теплового движения молекул уже достаточно для диспергирования одной жидкости в другой. В результате такого самопроизвольного диспергирования образуется тончайшая эмульсия, в которой коа — лесценция отдельных капелек уравновешивается стремлением обеих жидкостей равномерно распределиться в объеме (см. гл VIII, разд. 1).
Всякая критическая эмульсия является термодинамически устойчивой равновесной системой, для существования которой не требуется эмульгатор. Другими отличительными свойствами критической эмульсии являются возможность существования ее лишь в очень узком интервале температур и непостоянство частиц дисперсной фазы: капельки критической эмульсии все время образуются в системе и тотчас же исчезают, напоминая в этом отношении ассоциаты, образующиеся в жидкости в результате флуктуации ее плотности.
Обычные лиофобные эмульсии классифицируют либо по полярности дисперсной фазы и дисперсионной среды, либо по концентрации дисперсной фазы в системе.
Согласно первой классификации различают эмульсии неполярной или слабополярной жидкости в полярной (например, эмульсия масла в воде)—эмульсии первого рода, или прямые, и эмульсии полярной жидкости в неполярной (например, вода в масле)—эмульсии второго рода, или обратные.
Эмульсии первого рода очень часто обозначают через м/в, где под буквой «м» подразумевается масло или иная неполярная жидкость, а под буквой «в» — вода или другая полярная жидкость.
Эмульсии второго рода обозначают соответственно через в/м. В особый класс выделяют эмульсии жидких металлов (ртути, галлия) в воде, поскольку в этом случае и дисперсная фаза, и дисперсионная среда ведут себя как полярные жидкости.
Тип эмульсий устанавливается очень легко путем определения свойств ее дисперсионной среды. Для этого либо определяют способность эмульсии смачивать гидрофобную поверхность, либо проверяют возможность эмульсии разбавляться водой, либо испытывают способность эмульсии окрашиваться при введении в нее красителя, растворяющегося в дисперсионной среде, либо, наконец, определяют электропроводность эмульсии. Если эмульсия не сма-г чивает гидрофобную поверхность, разбавляется водой, окрашивается при введении водорастворимого красителя (например, метиленового голубого) и обнаруживает сравнительно высокую электропроводность, то это эмульсия типа м/в. Наоборот, если эмульсия смачивает гидрофобную поверхность, не окрашивается водорастворимым красителем (или окрашивается при введении маслорастворимого красителя, например судана III) и не обнаруживает заметной электропроводности, то это эмульсия типа в/м.
Согласно второй классификации, эмульсии делят на разбавленные, концентрированные и высококонцентрированные, или желатинированные.
К разбавленным эмульсиям относятся системы жидкость— жидкость, содержащие до 0,1 объемн.% дисперсной фазы. Типичным примером таких систем может служить эмульсия машинного масла в конденсате, образующемся при работе паровых машин. Следует, впрочем, отметить, что термин «разбавленные эмульсии» весьма условен, так как к разбавленным эмульсиям относят не просто эмульсии с малой концентрацией дисперсной фазы, полученные, например, разбавлением концентрированных эмульсий, но системы, обладающие характерными свойствами.
Прежде всего, разбавленные эмульсии по размеру частиц резко отличаются от концентрированных и высококонцентрированных эмульсий, являясь наиболее высокодисперсными. Диаметр капелек в разбавленных эмульсиях составляет, как правило, порядка Ю-5 см, т. е. близок к размеру коллоидных частиц. Далее, разбавленные эмульсии обычно образуются без введения в систему специальных эмульгаторов. Тем не менее, как показал опыт, частицы этих эмульсий обнаруживают электрофоретическую подвижность и, следовательно, несут электрический заряд. Заряд возникает на частицах дисперсной фазы таких эмульсий в результате адсорбции ионов неорганических электролитов, которые могут присутствовать в среде в ничтожных количествах. Некоторые исследователи полагают, что в отсутствие чужеродных электролитов на поверхности капелек таких эмульсий могут адсорбироваться гидр — оксильные или водородные ионы, всегда присутствующие в воде в результате диссоциации ее молекул. Наконец, разбавленные эмульсии по свойствам более, чем все остальные эмульсии, сходны
С лиофобными золями. Именно с разбавленными эмульсиями проводил свои работы Повис, который установил подчинение эмульсий правилу Шульце — Гарди и существование у их частиц критического электрокинетического потенциала. Помимо заряда агре — гативной устойчивости разбавленных эмульсий способствует еще чрезвычайно малая численная концетрация этих систем, обусловливающая очень редкие столк — новёния капелек.
К концентрированным эмульсиям относятся системы жидкость — жидкость со сравнительно значительным содержанием дисперсной фазы, вплоть до 74 объемн.% (рис. XII, 1а). Эту концентрацию часто указывают как максимальную для эмульсий этого класса потому, что она в случае монодисперсной эмульсии соответствует максимально возможному объемному содержанию недеформированных сферических капель независимо от их размера. Для полидисперсных эмульсий указанный предел, конечно, является условным, так как в таких эмульсиях маленькие капельки могут размещаться между большими, как это показано на рис. XII, 16.
Так как концентрированные эмульсии получаются обычно методом диспергирования, то размер их капелек относительно велик и составляет 0,1—1 мкм и больше. Такие капельки хорошо видны под обычным микроскопом, и концентрированные эмульсии должны быть отнесены к микрогетерогенным системам. Капельки концентрированных эмульсий также совершают броуновское движение тем более интенсивное, чем меньше их размер. Концентрированные эмульсии легко седиментируют, причем седиментация происходит тем быстрее, чем больше разница между плотностями дисперсной фазы и дисперсионной среды. Если дисперсная фаза обладает меньшей плотностью, чем среда, то наблюдается всплывание капель дисперсной фазы.
Агрегативная устойчивость концентрированных эмульсий может быть обусловлена различными причинами в зависимости от природы эмульгатора. Поэтому этот вопрос целесообразно обсудить при рассмотрении типов эмульгаторов, применяемых для получения эмульсий.
|
|
|
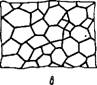
Рис. XII, 1. Упаковка капелек в эмульсиях с большим содержаьием дисперсной фазы: А—монодисперсная эмульсия, содержащая <74об^емн. % дисперсной фазы, б —полидисперсная эмульсия; В —желатинированная эмульсия. |
К высок/) концентрированным, или желатинированным, эмульсиям обычно относят системы жидкость — жидкость с содержанием дисперсной фазы выше чем 74 объемн.%. Отличительной особенностью таких эмульсий является взаимное
деформирование капелек дисперсной фазы, в результате чего они приобретают форму многогранников (полиэдров), разделенных тонкими пленками — прослойками дисперсионной среды. Такая эмульсия при рассматривании в микроскоп, как это видно из рис. XII, 1в, напоминает соты. Вследствие плотной упаковки капе лек высококонцентрированные эмульсии не способны к седиментации и обладают механическими свойствами, сходными со свойствами гелей. Последняя особенность и привела к тому, что высококонцентрированные эмульсии иногда называют желатинированными.
Высококонцентрированные эмульсии в некоторых условиях можно приготовить с очень большим содержанием дисперсной фазы и соответственно с ничтожным содержанием дисперсионной среды. Например, эмульгируя бензол в 1%-ном растворе олеата натрия, удается получить эмульсию, содержащую выше 99 объемн. % диспёрсной фазы. В таких предельно концентрированных эмульсиях раствор эмульгатора находится между частицами дисперсной фазы в виде тончайших пленок. По данным Л. Я. Кремнева, толщина таких пленок может достигать 100 А и даже меньше в зависимости от природы эмульгатора.
Естественно, что особые механические свойства высококонцентрированных эмульсий проявляются в тем большей степени, чем выше их концентрация. Так, подвижность эмульсий м/в с содержанием дисперсной фазы, немного превышающим 74 объемн. %, еще достаточно высока. Эмульсии же, содержащие 95% углеводорода, обладают уже свойствами, подобными свойствам геля, например их можно резать ножом.
Агрегативная устойчивость эмульсий и природа эмульгатора
Эмульсии, как и все коллоидные и микрогетерогенные системы, агрегатнвно неустойчивы из-за избытка свободной энергии на межфазной поверхности. Агрегативная неустойчивость эмульсий проявляется в самопроизвольном образовании агрегатов капелек с последующим слиянием (коалесценцией) отдельных капелек друг с другом. В пределе это может приводить к полному разрушению эмульсии и разделению ее на два слоя, из которых один соответствует жидкости, образующей в эмульсии дисперсную фазу, а другой — жидкости, являющейся дисперсионной средой.
Агрегативную устойчивость эмульсий характеризуют либо скоростью расслаивания эмульсии, либо продолжительностью существования (временем живни) отдельных капелек в контакте друг с другом или с межфазной поверхностью.
По первому методу находят объем дисперсной фазы (или дисперсионной среды), отслоившейся за определенное время с момента приготовлешп эмульсии. Откладывая значения объема, выраженного в процентах от объема всей эмульсии, по оси ординат, а соответствующее время по оси абсцисс, можно получить
кинетическую кривую, характеризующую устойчивость эмульсии — Так как при разрушении эмульсии в цилиндрическом сосуде объем выделившейся фазы пропорционален высоте соответствующего’ слоя жидкости, то вместо объемов можно пользоваться высотой образовавшегося слоя той или иной фазы.
Если количество выделившейся фазы пропорционально времени, то устойчивость эмульсии—можно также характеризовать — временем ее существования т. Это время можно найти по уравнению:
Т = Я/u (XII, 1>
Где Н — высота столба эмульсии; и — скорость выделения фазы.
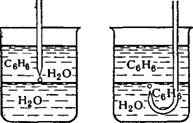
Время жизни капельки эмульсии определяют по времени существования капли у межфазной поверхности обеих жидкостей. Например, если хотят определить время жизни капли бензола в воде
В присутствии эмульгатора, то — П слой бензола наслаивают на слой воды и с помощью пипетки осторожно наносят каплю воды на межфазную поверхность со стороны бензола, как это показано на рис. XII, 2а. Подобным же образом наносят каплю бензола на межфазную поверхность со стороны водного слоя с помощью пипетки с загнутым концом снизу (рис. XII, 26). В обоих случаях регистрируют время, которое проходит с момента нанесения капли до момента ее коалесценции с соответствующей фазой. Это время обычно связано с устойчивостью эмульсии. Если при получении эмульсии применяли водорастворимый стабилизатор, устойчивость капли бензола у межфазной границы в водном растворе стабилизатора всегда выше устойчивости капли раствора стабилизатора в бензоле. Это показывает, что при применении водорастворимого эмульгатора образуется эмульсия типа м/в. Если применяли эмульгатор, растворимый в бензоле, результаты обратные, т. е. при таком стабилизаторе образуется эмульсия типа в/м. О причинах образования в первом случае эмульсии типа м/в, а во втором — типа в/м будет сказано ниже.
|
А 6 Рис. XII, 2. Определение времени жизни капель эмульсии. |
На агрегативную устойчивость эмульсий сильнее всего влияют природа и содержание в системе эмульгатора. С термодинамической точки зрения эмульгатор, адсорбируясь на межфазной границе, понижает межфазное поверхностное натяжение и в отдельных случаях может приводить даже к образованию равновесных коллоидных систем (эмульсии, получаемые из эмульсолов). Другое объяснение заключается в том, что при наличии стабилизатора на
Границе раздела фаз между капельками возникают силы отталкивания (энергетический барьер). Повышение в известных пределах концентрации эмульгатора в системе способствует устойчивости, эмульсии.
Природа эмульгатора определяет не только устойчивость, но и тип эмульсии. Опыт показывает, что гидрофильные эмульгаторы, лучше растворимые в воде, чем в углеводородах, способствуют образованию эмульсии типа м/в, а гидрофобные (или олеофильные) эмульгаторы, лучше растворимые в углеводородах, — эмульсий типа в/м (правило Банкрофта). Это вполне понятно, так как эмульгатор препятствует слипанию, или коалесценции, капелек только тогда, когда он находится у поверхности с наружной стороны капельки, т. е. лучше растворяется в дисперсионной среде.
В качестве эмульгаторов могут применяться самые различные по природе вещества: поверхностно-активные вещества, молекулы’ которых содержат ионогенные полярные группы (мыла в широком смысле слова), неионогенные поверхностно-активные вещества, высокомолекулярные соединения. Эмульгирующей способностью’ обладают даже порошки. Стабилизация более или менее концентрированных эмульсий с помощью обычных неорганических электролитов невозможна вследствие недостаточной адсорбции их ионов на межфазной границе неполярный углеводород — вода.
Эффективность эмульгатора характеризуют специальным числом— гидрофильно-.липофильным балансом (ГЛБ). Если число ГЛБ лежит в пределах 3—6, образуется эмульсия в/м. Эмульгаторы с числом ГЛБ 8—13 дают эмульсию м/в. Изменяя природу эмульгатора и его концентрацию, можно добиться обращения фаз эмульсии. Более подробно о ГЛБ сказано в гл. XIII.
Стабилизующее действие мыл и мылоподобных веществ на’ эмульсии типа м/в в настоящее время объясняется несколькими! ‘ факторами устойчивости. г’
Первый фактор — электрический заряд, возникший на поверхности капелек эмульсий, стабилизованных ионогенными мылами при адсорбции органических ионов мыла. В результате образуется двойной электрический слой, аналогичный тому, который существует на поверхности частиц типичных гидрофобных золей. Этот — двойной слой и обуславливает устойчивость эмульсий. Поэтому прямые эмульсии, стабилизованные ионогенными мылами, характеризуются всеми свойствами, присущими типичным гидрозолям,, т. е. для них соблюдается правило Шульце — Гарди, возможность, перезарядки частиц эмульсий с помощью поливалентных ионов — И т. д.
Для того чтобы происходила адсорбция органического иона, он должен хорошо адсорбироваться дисперсной фазой, т. е. иметь, достаточно длинную углеводородную цепь. Поэтому эмульсии типа м/в могут быть стабилизованы только сравнительно высокомолекулярными мылами (щелочными солями лауриновой и более высокомолекулярных жирных кислот). Отсутствие эмульгирующей
-способности у щелочных солей жирных кислот, являющихся низшими членами гомологического ряда, объясняется, вероятно, также и тем, что при высоких концентрациях, необходимых для адсорбции таких мыл, начинает уже преобладать коагулирующее дей — % ствие иона щелочного металла.
, Второй фактор устойчивости концентрированных эмульсий типа j’M/B заключается в образовании на поверхности их капелек структурированных гелеобразных слоев эмульгатора, обладающих высокой структурной вязкостью и прочностью при одновременной гид- ратированности. Этот фактор, особенно подробно рассмотренный в работах П. А. Ребиндера и А. Б. Таубмана, приобретает еще большее значение для высококонцентрированных эмульсий.
А. Б. Таубманом с сотр. показано, что устойчивые эмульсии могут образовываться также в результате возникновения на по- поверхности капелек основной эмульсии нескольких слоев микрокапелек, служащих структурно-механическим барьером. Такие микрокапельки возникают вследствие явлений турбулентности у поверхности капелек основной эмульсии, обладающей малым межфазным натяжением.
Устойчивость эмульсий типа в/м, стабилизованных мылами с поливалентным катионом, ранее объяснялась главным образом наличием на поверхности капелек эмульсии структурно-механического барьера. Объяснение же устойчивости эмульсий типа в/м существованием на межфазной поверхности двойного электрического слоя на первый взгляд кажется невозможным вследствие малой диэлектрической проницаемости дисперсионной среды. Однако, как уже указывалось (гл. IX, разд. II), в последние годы было показано, что даже в неполярных средах может происходить некоторая диссоциация молекул эмульгатора. Соли поливалентных металлов и органических кислот в углеводородных средах обычно имеют константы диссоциации порядка 10~8. Следовательно, если, например, концентрация такой соли в бензоле равна 10 ммоль/л, то концентрация ионов в растворе будет иметь значение порядка 10~10 н. При таких условиях двойной электрический слой будет, конечно, очень диффузным: расчеты показывают, что его толщина должна составлять несколько микрометров. Отсюда емкость двойного слоя в неполярной жидкости должна быть весьма невелика и нужен очень небольшой заряд для того, чтобы обусловить значительный поверхностный потенциал. Таким образом, электростатические силы отталкивания могут играть существенную роль и в устойчивости обратных эмульсий, особенно не очень концентрированных.
Третий фактор, который может обусловливать лишь устойчивость эмульсий второго рода, стабилизованных мылами с поливалентным катионом, сводится к адсорбции на поверхности капелек воды полярных концов достаточно длинных и гибких углеводородных участков молекул мыла, растворенных во внешней неполярной фазе эмульсии и способных совершать микроброуновское движе-
ниє. В этом случае устойчивость, очевидно, определяется тепловым движением и взаимным отталкиванием углеводородных радикалов, т. е. фактором, носящим энтропийный характер.
Наконец, иногда причина устойчивости обратных эмульсий может заключаться в стабилизации капелек полярной дисперсной фазы «броней» из крупинок, образовавшихся из нерастворимых солей щелочноземельных металлов или продуктов гидролиза. В этом случае механизм стабилизации полностью аналогичен механизму стабилизации эмульсий с помощью порошкообразных эмульгаторов, который рассмотрен ниже.
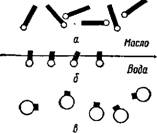
В последнее время для стабилизации прямых эмульсий широко применяют не — ионогенные эмульгаторы, дифильные молекулы которых состоят из углеводородного радикала и углеводородной цепи с расположенными по всей ее длине полярными, но не способными к ионизации группами, чаще всего гидроксильными (более подробные сведения о неионо- Рис. XII, 3. Поведение раз — генных эмульгаторах даны в гл. XIII). лично сбалансированных ди — ^стойчивость эмульсий типа м/в, стаби — Фильных 9МУЛЪ’
ЛИЗОВЗННЫХ неионогенными эмульгатора — а^молекул"сТ п^обладающе» МИ, естественнее всего объяснить следую — непочяоной частью; б —хорошо ЩИМ образом. Дифильные молекулы в-мо^ек^ГГ^реобладаюїї^й эмульгатора ориентированы на межфаз — полярной частью,
Ной границе так, что углево дородные
Участки направлены в дисперсную фазу, а полярные сильно гидра — тированные группы в воду, при этом Ohjj либо образуют достаточно толстый гидратный слой, обусловливающий расклинивающее давление, либо совершают микроброуновское движение (энтропийный фактор устойчивости).
Эмульгирующее действие как ионогенных, так и неионогенных поверхностно-активных веществ тем эффективнее, чем лучше сбалансированы полярные и неполярные части молекулы эмульгатора между обеими фазами эмульсии. Это значит, что дифильная молекула хорошего эмульгатора должна обладать сродством как к полярным, так и к неполярным средам. Только при этом условии молекулы эмульгатора не будут растворяться преимущественно в какой-нибудь одной из фаз и будут находиться на межфазной поверхности. Сбалансированность молекул эмульгатора в простейшем случае определяется, с одной стороны, длиной углеводородной цепи и с другой — сродством ионогенной или полярной группы к воде.
Поведение различно сбалансированных дифильных молекул можно пояснить_схемой, изображенной на рис. XII, 3.
|
|
Именно хорошей сбалансированностью объясняется наилучшее стабилизующее действие мыл, содержащих в углеводородной
Цепочке от 12 до 18 атомов углерода. Сбалансированностью молекул эмульгатора объясняется и род эмульсий, которые получаются с применением этого эмульгатора. Так, эмульгаторы, в молекуле которых действие полярной части превалирует над действием неполярной и которые лучше растворяются в воде, образуют эмульсии первого рода. Наоборот, эмульгаторы, у которых действие неполярной группы молекулы преобладает над действием полярной группы и которые лучше растворяются в углеводородах, способствуют образованию эмульсии второго рода.
Эмульгирующее действие высокомолекулярных веществ, таких, как желатин, казеин, поли- метакриловая кислота, Метилцел — люлоза, поливиниловый спирт, а также их действие как защитных коллоидов, вероятно, можно объяснить энтропийным фактором. Впрочем, можно также допустить, что прямые эмульсии, стабилизованные защитными коллоидами, молекулы которых содержат ионогенные группы, устойчивы благодаря образованию на поверхности капелек двойного электрического слоя в результате ионизации этих групп.
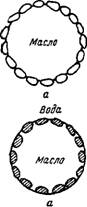
В заключение рассмотрим так называемые твердые эмульгаторы и причины их эмульгирующего действия. Твердыми эмульгаторами могут служить достаточно высокодисперсные порошки, способные смачиваться как полярной, так и неполярной жидкостями, •образующими эмульсию. К таким порошкам относятся глины, гипс, гидрат окиси железа, сажа.
|
Вода
|
|
Масло
|
|
Рис. XII, 4. Расположение частичек твердого эмульгатора у межфазной поверхности при образовании капелек эмульсии: У—гидрофильный эмульгатор (каолин), II — гидрофобный эмульгатор (сажа). |
При встряхивании полярной жидкости с неполярной в присутствии твердого. эмульгатора его крупинки прилипают к межфазной поверхности, причем большая часть поверхности частиц эмульгатора находится в той жидкости, которая их лучше смачивает. Таким образом, на капельках образуется как бы «броня»,’ предотвращающая их коалесценцию. Понятно, что если твердый эмульгатор лучше смачивается водой (например, каолин), такая броня возникает со стороны водной фазы; при этом образуется эмульсия типа м/в. Если же твердый эмульгатор лучше смачивается неполярным углеводородом (например, сажа), то образуется эмульсия типа в/м. Сказанное иллюстрируется схемой, изображенной на рис. XII, 4. В случаях 1а и II б крупинки твердого эмульгатора находятся с наружной стороны капелек, и поэтому соответ
ствующие эмульсии оказываются устойчивыми. В случаях I б и II а Крупинки твердого эмульгатора находились бы у межфазной поверхности с внутренней стороны капелек, в результате чего образование таких эмульсий невозможно.
Понятно, что наличие на поверхности капелек одного только слоя твердого эмульгатора еще недостаточно для агрегативной устойчивости системы. Капельки такой эмульсии при столкновении должны были бы слипаться, поскольку всегда существует межфазное натяжение на границе твердый эмульгатор — дисперсионная среда. Очевидно, устойчивость эмульсии в этом случае определяется возникновением на частицах твердого эмульгатора либо двойного электрического слоя, либо достаточно толстой сольват — ной оболочки.
Рассмотренные выше классические представления о роли «бронирования» в устойчивости эмульсий, стабилизованных твердыми эмульгаторами, значительно расширены А. Б. Таубманом. В его работах показано, что в реальных условиях высокая устойчивость эмульсий, стабилизованных твердыми эмульгаторами, определяется обычно совместным действием твердого высокодисперсного эмульгатора и поверхностно-активного компонента и это стабилизующее действие обусловлено образованием весьма прочной стабилизирующей оболочки. В этих случаях структурно-механический барьер непосредственно измерен и сопоставлен с устойчивостью.
Стабилизация эмульсии твердым эмульгатором возможна только при условии, что размер частиц порошка меньше размера капелек эмульсии. В то же время слишком мелкие частицы порошка, способные совершать интенсивное броуновское движение, не прилипают к поверхности капелек и не образуют защитного слоя. В доказательство этого можно привести известный факт, что эмульсии типа м/в получают только с помощью золя AS2S3 с достаточно крупными частицами. Высокодисперсные золи AS2S3, равно как и грубый осадок AS2S3, не способны стабилизовать эмульсии.
Методы получения и разрушения эмульсий
Эмульсии получают механическим диспергированием дисперсной фазы в дисперсионной среде в присутствии соответствующего эмульгатора. Для диспергирования эмульгируемые жидкости сильно перемешивают, встряхивают или подвергают вибрационному воздействию. Для этого используют специальные эмульса — торы, мешалки, коллоидные мельницы. В последнее время для эмульгирования начинают применять ультразвук. Иногда полученные грубые эмульсии подвергают дополнительной гомогенизации в специальных гомогенизаторах разнообразных конструкций. Наиболее часто в качестве гомогенизаторов применяют устройства, в которых дополнительное диспергирование капелек грубой эмульсии достигается продавливанием ее через малые отверстия под высоким давлением. При обработке в таких гомогенизаторах, например молока, диаметр жировых капелек понижается с 3 до 0,2 мкм. В результате значительно увеличевшейся седиментацион — лой устойчивости такое молоко расслаивается значительно медленнее.
Процесс эмульгирования состоит из собственно диспергирования, т. е. образования капелек дисперсной фазы в дисперсионной ■среде и их стабилизации в результате адсорбции на поверхности эмульгатора. Процесс гомогенизации всегда заключается в образовании из дисперсной фазы тонких цилиндриков, которые весьма неустойчивы и легко распадаются на ряд капелек. Как известно из молекулярной физики, цилиндрик жидкости начинает распадаться на капельки, когда его длина становится больше окружности его сечения.
Следует учесть, что при эмульгировании наряду с диспергированием всегда в той или иной степени происходит коалесценции возникших капелек, так как эмульгатор не успевает полностью адсорбироваться на поверхности капелек и они еще не обладают той устойчивостью, которая соответствует устойчивости капелек в готовой эмульсии. П. А. Ребиндер показал, что при эмульгировании всегда образуется два типа эмульсии — м/в и в/м и только вследствие большей устойчивости «выживает» та эмульсия, которая соответствует природе примененного эмульгатора.
Влияние эмульгатора на образование эмульсии того или иного рода становится более сложным, когда эмульгатор способен давать как эмульсию м/в, так и в/м. В этом случае на род образующейся эмульсии может влиять природа стенок сосуда и мешалки, равно как и другие предметы, с которыми соприкасается эмульсия. Например, если стенки сосуда смачиваются только какой-нибудь одной жидкостью, то соприкосновение эмульсии с этой стенной может приводить к обращению типа эмульсии, причем жидкость, смачивающая стенки сосуда, становится дисперсионной средой.
На результат эмульгирования влияет не только природа примененного эмульгатора и вид механического воздействия, но и ряд других условий — температура, количественное соотношение фаз и т. д. При всех прочих равных условиях более низкоконцентрированная эмульсия получается более устойчивой, так как вероятность столкновения двух ее частиц меньше.
Таким образом, эмульгирование представляет собой весьма сложный процесс и для приготовления стойких высокодисперсных эмульсий от технолога требуется много знаний и опыта.
Помимо механического диспергирования эмульсии могут быть получены путем самопроизвольного диспергирования, механизм которого был рассмотрен в гл. VIII. Однако при самодиспергировании полученные весьма высокодисперсные равновесные системы резко отличаются по термодинамической устойчивости от обычных эмульсий, агрегативная устойчивость которых является временной. Поверхностно-активные вещества, применяемые при самопроизвольном диспергировайии, также не могут рассматриваться как типичные эмульгаторы, поскольку их берут в таких количествах, что происходит изменение объемных свойств фазы.
Самопроизвольное эмульгирование играет существенную роль в процессах, связанных с перевариванием и усвоением пищи организмом. При попадании, например, в кишечник жира сначала происходит самодиспергирование жира под влиянием поверхностно — активных веществ (холевых кислот), содержащихся в желчи, а затем полученная таким образом высокодисперсная эмульсия всасывается через стенку кишечника в организм.
Часто перед технологом стоит задача не получить эмульсию, а наоборот, предупредить ее возникновение или разрушить (д е — эмульгировать) уже образовавшуюся систему. Эмульсии типа м/в, полученные с применением ионогенных эмульгаторов, обычно разрушают с помощью коагуляции электролитами с поливалентными ионами. Так как такие электролиты, взаимодействуя с ионо — генной группой эмульгатора, обычно дают соединения, нерастворимые й воде, то введение их в систему равнозначно переводу эмульгатрра в неактивную форму. Иногда для деэмульгирования эмульсий, полученных с применением ионогенных эмульгаторов,, вводят в систему эмуйьгатор, способствующий образованию эмульсии обратного типа и таким образом как бы нейтрализующий действие первоначального эмульгатора. Следует заметить, что такой эмульгатор практически всегда образуется при введении электролитов с поливалентным катионом в эмульсии типа м/в, стабилизованные щелочными мылами, так как образующиеся при этом мыла с поливалентными катионами способствуют образованию эмульсий типа в/м.
Эмульсии, стабилизованные неионогенными стабилизаторами, разрушаются гораздо труднее. Электролиты разрушают такие эмульсии только при больших концентрациях, когда происходит уже не коагуляция, а высаливание. Более эффективным способом разрушения таких эмульсий является нагревание, вызывающее десорбцию молекул неионогенных стабилизаторов с капелек эмульсии или дегидратацию полярной части молекулы неионогенного стабилизатора.
Разрушение всех эмульсий можно достичь введением в систему поверхностно-активного вещества, вытесняющего из адсорбционного слоя эмульгатор, но неспособного стабилизовать эмульсию. Именно на этом основана возможность разрушения некоторых эмульсий первого рода введением в них амилового спирта. Эмульсии можно также разрушить путем центрифугирования, фильтрования, электрофореза. При центрифугировании и фильтровании происходит собственно концентрирование эмульсии. Однако в эмульсиях с очень высокой концентрацией дисперсной фазы и недостаточным содержанием эмульгатора, как правило, происходит коалесценция капелек, и таким образом система разрушается. С. С. Воюцкйм с сотр. разработан метод непрерывного разрушения
Эмульсий воды в углеводородах путем пропускания эмульсий через специальный фильтр. Капельки дисперсной фазы (воды) адсорбируются на фильтрующем материале, коалесцируют на его поверхности и стекают с фильтра (самоочищение фильтра). Разрушение эмульсий при повышении температуры обусловливается уходом эмульгатора с поверхности капелек в результате его десорбции или растворения в дисперсной фазе.
Обращение фаз эмульсий
Рассмотрим так "называемое явление обращения фаз, весьма характерное для эмульсий. При введении в эмульсию в условиях интенсивного перемешивания большого количества поверхностно — активного вещества, являющегося стабилизатором эмульсий противоположного типа, первоначальная эмульсия может обращаться, т. е. дисперсная фаза становится в ней дисперсионной
|
Рис. XII, 5. Схема обращения эмульсии типа м/в в эмульсию Типа в/м. |
Средой, а дисперсионная среда — дисперсной фазой. Так, эмульсия типа м/в, стабилизованная олеатом натрия, может быть превращена в эмульсию типа в/м путем введения в систему при сильном перемешивании олеата кальция. Такое же явление наблюдается и при введении в эмульсию веществ, способных изменять природу эмульгатора, например, при введении хлорида кальция в эмульсию первого рода, стабилизованную олеатом натрия.
Интересно, что обращение эмульсий в определенных условиях может быть вызвано и длительным механическим воздействием. Так, сбивание сливок ведет к получению масла. При этом эмульсия типа м/в (сливки) переходит в эмульсию типа в/м (масло) со сравнительно весьма малым содержанием воды в виде дисперсной фазы.
Наблюдения под микроскопом показали, что при обращении фаз капельки дисперсной фазы сначала растягиваются, превра-^ щаются в пленки и затем образовавшиеся пленки охватывают дис-
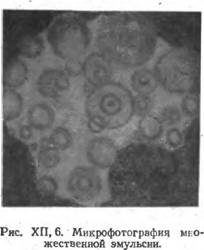
■персионную среду первоначальной эмульсии, которая в результате этого становится дисперсной фазой. На рис. XII, 5 наглядно можно видеть эти этапы при переходе слева направо. Интересно, что в результате неравномерного распределения эмульгатора в различных микроучастках системы, при обращении фаз могут возникать так называемые «множественные» эмульсии, в которых, например, капельки масла эмульсии первого рода содержат в себе мельчайшие капельки воды. Ми- тсрофотография такой множественной эмульсии представлена на рис. XII, 6.
Практическое значение
Эмульсий и эмульгирования
К природным эмульсиям относится ряд ценнейших растительных и животных продуктов. Так, эмульсией является молоко — стабилизованная животными белками эмульсия жиров в воде. Молоко является сырьем молочной промышленности и служит для получения множества молочных продуктов — сливок, простокваши, кефира, масла, сыра и т. д. Природной эмульсией является также яичный желток.
В пищевой промышленности к эмульсиям помимо молочных продуктов принадлежат такие продукты, как маргарин, майонез, различные соусы. В фармацевтической промышленности многие лекарства применяются в виде эмульсий, причем, как правило, для приема лекарств внутрь применяются эмульсии первого рода, а эмульсии второго рода используются для наружного применения.
3. ЛАТЕКСЫ
По свонм свойствам к эмульсиям с водной дисперсионной средой приближаются натуральные н синтетические латексы, очень широко применяемые в народном хозяйстве для получения эластичных пленок, шаров-пилотов, для изготовления эластичных пористых материалов, заменителей кожи, для придания водонепроницаемости тканям, для пропитки корда в шинной промышленности и т. д. Натуральные латексы представляют собой млечный сок бразильской гевеи, синтетические латексы получают путем полимеризации в водной среде непредельных углеводородов — бутадиена, хлоропрене и других мономеров. Часто латексы изготовляют путем сополнмеризации двух или даже нескольких мономеров (бутадиен-стнрольные латексы, бутадиен-акрилонитрильные латексы и т. д.).
|
|
Латексы, как н эмульсин, содержат микроскопические или ультрамикроскопические частицы (глобулы), приближающиеся по форме к сферическим, на поверхности которых адсорбирован стабилизатор — соединения типа белков для
натурального латекса и мыла или другие поверхностно-активные вещества у синтетических латексов. Вещество дисперсной фазы латексов состоит из каучука, макромолекулы которого представляют собой гибкие углеводородные цепи, не содержащие или содержащие полярные группы В этих цепях имеется всегда некоторое количество непредельных связей, обусловливающих возможность вулканизации каучуков, т. е. сшивания макромолекул по месту ненасыщенных связей с помощью серы или других вулканизующих агентов.
Здесь уместно указать, что стабилизованные мылами или мылоподобными веществами синтетические латексы являются хорошими моделями ионностабили — зованных коллоидных систем. Это объясняется следующими свойствами латексов.
Химический состав водной фазы (дисперсионной среды) синтетических латексов сравнительно прост, а дисперсная фаза обычно состоит из достаточно инертного в химическом отношении и в большинстве случаев гидрофобного вещества. Поэтому едва ли можно ожидать, что при астабилизации этих-систем на поверхности частиц-могут происходить какие-нибудь реакции, за исключением тех хорошо изученных ‘реакций, в которых участвует стабилизатор. У латексов с гидрофобным полимером сольватация дисперсной фазы, которая может влиять на устойчивость коллоидной системы, безусловно, отсутствует. Сферическая или близкая к сферической форма частиц устраняет влияние на их взаимодействие неровностей поверхности и позволяет считать, что при столкновении двух глобул они ведут себя как два идеальных шарика. Дисперсная фаза латексов, как правило, является диэлектриком, и при электрофорезе можно не учитывать поправку на проводимость частиц. Большая вязкость полимеров позволяет рассматривать латексные глобулы как твердые частицы. Это значительно упрощает трактовку экспериментальных результатов, так как такие частицы ие могут деформироваться под влиянием движения окружающей жидкости. Наконец, весьма существенно, что синтетические латексы можно получать с применением почти любого эмульгатора. Это представляет огромное удобство для экспериментатора, изучающего влияние на свойства латекса природы стабилизующих веществ.
Всеми этими свойствами и объясняется широкое применение латексов в последнее время в исследовательских лабораториях.
Ниже мы остановимся только на работах, проведенных с использованием латексов, стабилизованных мылами и неионогеиными поверхностно-активными веществами, представляющих лишь общий интерес для коллоидной химии.
Несмотря на то, что вопрос о связи между ^-потенциалом и агрегативной устойчивостью лиофобных коллоидных систем чрезвычайно сложен, нельзя отрицать мнение ряда ведущих ученых о том, что электрокинетический потенциал до сих пор остается одной из важнейших характеристик устойчивости лиофобных коллоидов. На значение ^-потенциала для устойчивости коллоидных систем, и в частности латексов, указывали Кройт, Овербек, Гаузер и др.
С. С. Воюцкий и Р. М. Панич еще в начале пятидесятых годов исследовали влияние на устойчивость и одновременно на ^-потенциал латексов таких факторов, как концентрация латексов, рН среды и валентность коагулирующего иона. Исследования проводили как с иедиализованными, так и диализованными син — тетическми латексами, стабилизованными олеатом и нафтенатом аммония. Электрофоретическую подвижность определяли с помощью макроэлектрофореза, поскольку в задачу работы входило определение зависимости ^-потенциала от концентрации дисперсной фазы. Электрокинетический потенциал вычисляли по формуле Генри, причем численный коэффициент подбирали в соответствии с известным критерием уш, пользуясь графиками Овербека.
Опыты показали, что при разбавлении латексов вероналовым буфером с рН =7,7, одинаковым с рН исходных латексов, абсолютные значения Е-потенциа — ла сначала возрастали, достигали 75 -=- 85 мВ, а затем при содержании сухого остатка в латексах менее 0,02—0,1 % падали. Однако даже при весьма больших разбавлениях, когда уже трудно вести наблюдения за электрофорезом, значения электрокииетического потенциала не были меньше —50 мВ.
Начальное возрастание отрицательного электрокинетического, потенциала при разбавлении буферной смесью є постоянной ионной силой С. С. Воюцкий объясняет только уменьшением ионной силы системы вследствие снижения содержа-
ння в единице ее объема числа глобул, которые следует рассматривать в этом случае как поливалентные ионы. Падение абсолютной величины ^-потенциала при сильном разбавленнн латексов, отмечавшееся и другими авторами (Боулер, Мунро, Сексмис), следует объяснить десорбцией стабилизатора с поверхности глобул. Правильность подобного объяснения была подтверждена установлением перехода молекул мыла с поверхности дисперсной фазы в межглобулярную жидкость. Однако было найдено, что заметная десорбция мыла с поверхности глобул происходит только лншь при содержании в латексе сухого остатка менее 0,02%. В достаточно концентрированных латексах как недиализованных, так и диалнзованных почти все мыло (свыше 99%) находится в адсорбированном состоянии, причем слой мыла на глобулах ненасыщен.
Латексы не флокулировали и не коагулировали при любых, сколь угодно больших разбавлениях. Флокуляцня н коагуляция не наблюдались и при стоянии разбавленных латексов в течение двух суток. Однако прн введении даже в сильно разбавленные латексы хлорида кальция тотчас наступала коагуляция. Это говорит о том, что устойчивость сильно разбавленных латексов определяется не частотой столкновения частнц друг с другом, а достаточной нх защищенностью стабилизатором.
При постепенном добавлении 0,1 н. НС1 в стабилизованные мылами концентрированные латексы происходила их полная коагуляция. Быстрое же введение достаточно большого количества кислоты в латексы, разбавленные до 3—4%-ного содержания в ннх сухого остатка, не вызывало коагуляции нлн вызывало ее лишь частично. Это явление оказалось совершенно неожиданным, так как шло вразрез с обычными представленнями о том, что латексы, стабилизованные мылами (не амфотерными веществами), не могут быть устойчивыми прн ннзкнх рН. Определение знака заряда частиц в подкнслеиных латексах показало, что глобулы в этом случае претерпевают перезарядку и становятся положительно заряженными.
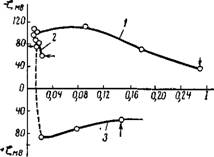
На рнс. XII, 7 представлено изменение электрокннетического потенциала глобул диализованного синтетического латекса, содержащего 2% сухого остатка, в зависимости от рН среды при нонной снле, равной 0,01. Электрокннетнческнй потенциал прн повышении активной кислотности системы в некотором диапазоне рН не изменяется, затем начинает уменьшаться, очевидно, в результате перехода мыла с поверхности глобул в слабо ионизированную кислоту, достигает нуля при рН = 3,9 и, наконец, принимает положительное значение в сильно кислых средах, вероятно, за счет адсорбции ионов водорода. Существенно, что положительный потенциал глобул в кислой среде по абсолютному значению намного меньше, чем в щелочной, что, безусловно, связано с различной природой и концентрацией ионов, стабилизующих частицы в кислой и щелочной средах.
Как показал эксперимент, с ростом абсолютного значения ^-потенциала растет и агрегативная устойчивость латексов Повышение устойчивости латексов с увеличением отрицательного ^-потенциала общеизвестно. Но подобная же зависимость наблюдается и для перезаряженных латексов с положительно заряженными частицами При рН = 3,9 в нзоэлектрическом состоянии стабилизованные латексы тотчас коагулируют. При рН = 3,1 идет процесс скрытой коагуляции, переходящий за сутки в явную. При рН = 2,7 явной коагуляции ие происходит в течение 25 дней.
|
<нв г-Ю’Ом’сп’ ! Т "Г ^р—^ 3- Р Л ч I /-о-о- |
|
I ‘I — T Ъ"7:-0-0———————— о—— о 01 г г/"ч в 8 щн |
|
Чоу |
|
Рис. XII, 7. Зависимость ^-потенциала ла — тексных глобул (кривая 1) и удельной электропроводности у латекса АПД-2 (кривая 2) От рН среды (по С. С. Воюцкому). |
В заключение отметим, что перезаряженные глобулы латексов обладают повышенной способностью адсорбироваться отрицательно заряженными поверхио-
стями, например хлопчатобумажным волокном, и, следовательно, могут быть с успехом использованы для проклеивання бумаги и картона н пропитывания тканей. Эти выводы полностью совпадают с литературными указаниями [28].
При изучении влияния катионов различной валентности на электрокинети — ческнй потенциал латексных глобул было установлено, что для латексов с отрицательно заряженными частицами соблюдается правило Шульце — Гарди, которому подчиняются лнофобные коллоидные системы. На рнс. XII. 8 приведены результаты электрофоретнческнх исследований диализованного синтетического латекса, содержащего 1 % сухого остатка. Последние точки на кривой, отмеченные стрелками, соответствуют предельной концентрации электролита, при которой еще можно провести электрофорез.
Некоторое повышение потенциала при введении небольших количеств хлорида натрня наблюдали и другие исследователи (Гаузер и Бендер, Марон с сотр). Причина подобного явления заключается, возможно, в адсорбции глобулами анионов, присутствующих в системе. Падение потенциала при повышении концентрации хлорида натрия объясняется, конечно, сжатием двойного электрического слоя. Этим же объясняется и резкое снижение потенциала прн введении хлоридов кальция и алюминия. Прибавление больших количеств хлорида алюминия, как можно видеть на рисунке, ведет к перезарядке глобул.
В последние годы довольно широкое распространение получило мнение, что основную роль в агрегатнв — ной устойчивости обычных латексов играет структурно-механический фактор. Однако эту точку зрения применительно к латексам, стабилизованным мылами, нельзя считать правильной. Было показано, что поверхность глобул стабилизованных латексов обычно покрыта слоем эмульгатора лишь на 30—40%. При значительной ненасыщенности адсорбционного слоя на поверхности глобул говорить о наличии вокруг частиц двухмерных студней и о их структурно-механических свойствах едва лн возможно. Устойчивость латексов, стабилизованных мылами, определяется, в основном, действием отталкивающих снл между двойными электрическими слоями, возникающих при перекрытии нонных атмосфер. При этом собственно стабилизующей частью молекулы стабилизатора является ее гндрати — рованные ионизированные группы, а роль углеводородного радикала сводится к фиксации молекулы стабилизатора иа межфазной поверхности полимер — вода. і
|
|
|
Рис. XII, 8. Влияние ионной силы / на ^-потенциал глобул латекса ВІДІ при введении в него различных электролитов: / —NaCl; 2—CaCU; З —А1С13. |
Другим доказательством двойного электрического слоя как основной причины устойчивости водных дисперсий полимеров, стабилизованных мылами, является тот факт, что стабильные латексы можно получить с помощью эмульгаторов, не способных давать механически прочные адсорбционные пленки (например, с помощью некалей).
Все сказанное выше ни в коем случае не снижает значения структурно-механических свойств адсорбционного слоя как причины агрегативной устойчивости вообще и латексов в частности. В определенных условиях прн образовании на
поверхности частиц достаточно прочного и мощного слоя гидратированного стабилизатора структурно-механические свойства этого слоя могут иметь решающее значение для стабильности системы.
Согласно Р. Э. Нейману, с увеличением плотности адсорбционных слоев происходит все большая замена двойного электрического слоя сильно развитыми гидратными оболочками на поверхности частиц. Таким образом, имеет место переход от систем, стабилизованных двойным электрическим слоем, к системам, стабильность которых обусловлена структурно-механическим барьером. Иначе говоря, при увеличении адсорбции поверхностью латексных глобул происходит не только количественное, но и качественное изменение механизма стабилизации. Возникает новый по своей природе энергетический барьер, препятствующий коагуляции, близкий к представлениям П. А. Ребиндера об образовании структурированных гелеобразных слоев эмульгатора. Электрический заряд двойного электрического слоя при этом уменьшается или исчезает совсем благодаря тесному контакту ионогенных групп и возрастанию ионной силы. На неэлектростатическую природу стабилизующего барьера в этом случае, согласно Р. Э Нейману, указывает и то, что коагуляция адсорбционно насыщенных латексов не подчиняется закономерностям, характерным для латексов, частицы которых несут двойной электрический слой. Очевидно, существует иной, неэлектростатический механизм стабилизации, связанный со структурой и гидратацией плотно упакованных насыщенных слоев эмульгатора.
Как ‘было указано, сравнительно недавно широкое распространение у нас и за рубежом получили неионогенные поверхностно-активные вещества, молекулы которых имеют несколько неионогенных полярных групп, например —ОН. Гидрофобными частями молекул этих веществ являются углеводородные радикалы алифатических спиртов или алкилфенолов.
В СССР первые работы по исследованию свойств латексов, стабилизованных неионогенными поверхностно-активными веществами, выполнены Р. М. Панич и С. С. Воюцким с сотрудниками еще в 1961 г. В этих исследованиях ими было установлено, что латексы, полученные с применением неионогенных поверхностно-активных веществ, представляющих собой продукты сополимеризаций моно — и диалкилфенолов с достаточными количествами окиси этилена, вполне устойчивы к действию электролитов, что имеет немаловажное практическое значение. Латексы с более гидрофильными стабилизаторами, имеющими длинную оксиэтиленовую цепь, оказались устойчивыми к интенсивному перемешиванию, тогда как в латексе с более гидрофобным стабилизатором при перемешивании образуется коагулят. Разбавленные латексы с неионогенными эмульгаторами обладают небольшим отрицательным электрокинетическим потенциалом. Причина этого явления, по мнению авторов, заключается в адсорбции латексными глобулами посторонних ионов, присутствующих в системе. Абсолютное значение отрицательного электрокинетического потенциала латексных глобул с неионогенными стабилизаторами возрастает с увеличением рН среды Это указывает на то, что адсорбирующимися ионами, обусловливающими заряд, могут являться гидроксильные ионы.
Введением АІСІз были получены латексы в изоэлектрическом состоянии, причем в них не происходило явной коагуляции. Это указывает на то, что их устойчивость обусловлена не электростатическими силами, а в основном гидратацией полярных участков цепей стабилизатора. Однако агрегативная устойчив вость латексов, содержащих неионогенный стабилизатор, в изоэлектрическом состоянии ниже, чем агрегативная устойчивость исходных латексов. Таким образом, заряд латексных глобул, обусловленный адсорбцией ионов, все же способствует повышению устойчивости латексов.
Стабилизирующая роль гидратации, вероятно, заключается в том, чтобы обеспечить эффективное отталкивание при взаимодействии таких гидратирован — ных слоев (расклинивающее давление).
Процесс скрытой коагуляции и образования геля под действием электролитов у латексов, стабилизованных неионогенными поверхностно-активными веществами, наступает только при повышенной температуре. Скорость коагуляции тем выше, чем интенсивнее дегидратирующие факторы: температура, концентрация электролита, тип коагулирующего иона.
 1 ноября, 2012
1 ноября, 2012  admin
admin 

 Опубликовано в рубрике
Опубликовано в рубрике 