Особая осторожность должна быть проявлена при защите анодными ингибиторами конструкций, содержащих зазоры и щели. Такие конструкции и в отсутствие ингибиторов подвергаются часто сильной коррозии из-за возникновения макроэлементов [55]. При неправильной дозировке анодных ингибиторов щелевая коррозия может возрасти. Объясняется это тем, что концентрация ингибитора в щелях, куда их доступ затруднен, может снизиться до значениіі, при которых полная пассивация поверхности станет невозможной. Поскольку на открытой поверхности, куда имеется свободный доступ ингибитора, металл остается в пассивном состоянии и его потенциал более положителен, чем в щели, где часть поверхности находится в активном состоянии, возникает своеобразный активно-пассивный элемент, анодом которого является металл, находящийся в щели. Благодаря анодной поляризации потенциал металла в щели сдвигается в положительную сторону (по сравнению с потенциалом, который металл имел в отсутствие ингибиторов) и в соответствии с законами электрохимической кинетики скорость растворения увеличивается. В результате этого при неправильном дозировании ингибиторов наблюдаются сильные разрушения металлов под уплотнительными прокладками, в резьбовых соединениях, в кольцевых зазорах трубной доски конденсаторов, в застойных местах охладительных систем и т. п.
Проиллюстрируем наблюдающиеся при защите подобных систем закономерности на примере стали и чугуна [56]. В качестве коррозионной среды возьмем электролит, содержащий 30 мг/л NaCl и 70 мг/л Na2S04. Этот электролит имитирует речную и озерную воды, часто применяющиеся в охладительных системах. В качестве ингибиторов рассмотрим нитрит натрия, бихромат калия и двузамещенный ортофосфат натрия.
Нитрит натрия. Если в электролит указанного выше состава ввести 0,25 г/л нитрита натрия, то он в обычных условиях подавляет полностью коррозию железа. Однако иная картина наблюдается на образцах со щелевыми зазорами (рис. 3,5). Видно, что в широких зазорах (0,70—1,00 мм) металл защищен. В более узких зазорах (0,05—0,50 мм) суммарные коррозионные потери возрастают, оставаясь, однако, еще на приемлемом уровне (кривая 1). Но если отнести эти потери не к общей площади металла в щели, а лишь к той, на которой развивается коррозионный процесс, т. е. определить истинную скорость растворения, то картина
сильно меняется. Истинная скорость растворения (интенсивность), начиная с ширины зазора 0,7 мм, резко возрастает, достигая максимального значения ори зазоре 0,45 мм (кривая 2). Следует обратить внимание на то, что истинная скорость коррозии в зазорах намного выше, чем кажущаяся (скорость общей коррозии), причем максимальная интенсивность наблюдается не в узких зазорах, куда доступ ингибитора наиболее затруднен, а при некоторых средних значениях. Из этого же рисунка видно, что площадь коррозионных поражений в щелях (кривая 3) увеличивается с уменьшением ширины зазора и при ширине, равной 0,05 мм, почти ;вся поверхность металла в щели активируется.
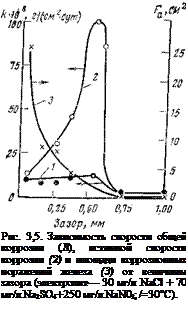 Объясняется это тем, что в узких зазорах концентрация ингибитора со временем снижается практически до нуля. По мере увеличения ширины зазора облегчается диффузия ингибитора в щель, что ведет вначале к сокращению площади коррозионных поражений, а затем к полному подавлению коррозии. Эти результаты получены были, когда металл, образующий щель, не находился в контакте с металлом, к которому имеется свободный доступ электролита, а значит, ингибитора. Когда же имеется внешний контакт, положение еще более осложняется; при наличии внешнего контакта в зазоре сильно увеличивается как скорость общей коррозии (кажущаяся скорость), так и ее интенсивность (истинная скорость).
Объясняется это тем, что в узких зазорах концентрация ингибитора со временем снижается практически до нуля. По мере увеличения ширины зазора облегчается диффузия ингибитора в щель, что ведет вначале к сокращению площади коррозионных поражений, а затем к полному подавлению коррозии. Эти результаты получены были, когда металл, образующий щель, не находился в контакте с металлом, к которому имеется свободный доступ электролита, а значит, ингибитора. Когда же имеется внешний контакт, положение еще более осложняется; при наличии внешнего контакта в зазоре сильно увеличивается как скорость общей коррозии (кажущаяся скорость), так и ее интенсивность (истинная скорость).
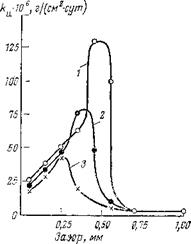
С увеличением концентрации нитрита натрия возрастает степень защиты металла в зазорах. Коррозия при этом появляется лишь в весьма узких зазорах, куда доступ ингибитора наиболее затруднен (рис. 3,6). Если же увеличить концентрацию нитрита натрия в 8 раз (с 0,25 до 2 г/л), то пассивное состояние сохраняется в зазорах любой ширины. Отсюда следует, что в принципе можно с помощью ингибиторов защитить и системы, содержащие щели и зазоры, но для этого необходимо обеспечить более высокую концентрацию ингибитора.
Изучение влияния температурного фактора на коррозионное ■поведение железа в зазорах показало, что с увеличением температуры интенсивность коррозии значительно возрастает (рис. 3,7). Увеличение температуры ведет к возникновению коррозии в более щироких зазорах, а также к увеличению интенсивности коррозии.
 |
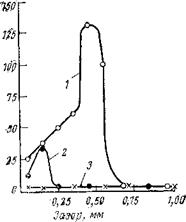 |
Рис. 3,6. Зависимость истинной скорости коррозии железа в электролите 30 мг/л
NaCl + 70 мг/л Na2S04 от концентрации нитрита натрия (отношение открытой
поверхности к поверхности в щели равно 1 : 1):
/ — 0,25; 2 — 0,5; 3 — 1,0 г/л.
Рис. 3,7. Влияние температуры на истинную скорость коррозии железа в щелях
в присутствии нитрита натрия!(электролит: 30 мг/л iNaCl + 70 мг/л Na2SO. t):
/ — 30; 2 — 20; 3— 15 °С.
Максимальные разрушения при этом с повышением температуры наблюдаются в более широких зазорах.
Наблюдаемые закономерности в изменении щелевой коррозии железа с ростом температуры зависят от следующих обстоятельств: с одной стороны, при повышенных температурах требуется более высокая концентрация ингибиторов для подавления коррозии, с другой — с увеличением температуры возрастает скорость диффузии ингибитора в зазор. Очевидно, при коррозии железа в зазорах первый фактор преобладает над вторым, поэтому интенсивность коррозии с повышением температуры сильно возрастает.
Коррозионное поведение металлов в щелях в присутствии ингибиторов становится понятным, если проследить за изменением потенциала металла в щели (рис. 3,8). В начальный период потенциалы железа в узкой щели (0,05 мм) и на свободно омываемой электролитом поверхности одинаковы. Однако уже через 1—2 сут потенциал железа в узкой щели (0,05 мм) начинает постепенно сдвигаться в сторону отрицательных значений, достигая по истечении 20—30 сут —0,30 В. Потенциал железа, к которому имеется свободный доступ электролита, устанавливается на уровне +0,25 В. Разность потенциалов между двумя такими участками
металла, как это видно, достигает 0,55 В. В широких зазорах (1,00 мм), куда доступ ингибитора облегчен, потенциал металла такой же, как на открытой поверхности. Наличие большой разности потенциалов между металлом, находящимся в щели, и металлом открытой поверхности создает условия для возникновения эффективного активно-пассивного
|
Рис. 3,8. Изменение во временя потении — коррозионного элемента, ано — ала железа в щелях н на открытой по — дом которого является металл, Ш Л W/VTrmnAlfftMA ОЛ 1 ГГ> І IV М Л ■ 1 — I — . * „ . |
|
14C12UV/4, пши 0,25 г/л NaNO*: |
![]()
![]()

 верхности в электролите 30 мг/л NaCl+ + 70 мг/л Na2S04, ингибированном
верхности в электролите 30 мг/л NaCl+ + 70 мг/л Na2S04, ингибированном
/ — щель шириной 0,05 мм; 2 — открытая по-
верхность,
поляризационное сопротивление составляет при ширине зазора 0,15 мм всего 40% от начальной разности потенциалов. Следовательно, анодный процесс в данном случае в щели протекает не с высоким перенапряжением, что вызвано подкислением среды.
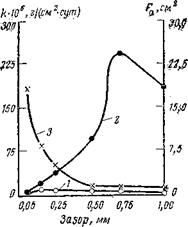
Бихромат калия. Аналогичным образом ведет себя бихромат калия. Являясь анодным ингибитором, он также способен при концентрациях, недостаточных для полной защиты, вызывать местную коррозию. На рис. 3,9 показано, как изменяется скорость общей коррозии и истинная скорость коррозии чугуна в зазорах при введении 1 г/л КгСггОт. Как видно, при незначительных общих коррозионных потерях чугун подвергается сильной местной коррозии. Максимальная интенсивность коррозии наблюдается при ширине зазора 0,70 мм. В отличие от железа, которое сохраняет пассивное состояние в зазоре шириной в 1 мм и более, чугун довольно легко активируется и в широких зазорах. Становится понятным, почему в охладительных системах двигателей внутреннего сгорания, защищаемых бихроматом калия, часто наблюдается сильная коррозия чугуна.
Наличие контакта с металлом, к которому имеется свободный доступ электролита, приводит к увеличению как скорости общей коррозии в щели, так и ее интенсивности. С увеличением концентрации ингибитора положение улучшается (рис. 3,10). При концентрации бихромата калия, равной 3 г/л, надежно защищается уже металл в зазорах шириной 0,7 мм, а при концентрации 5 г/л активирование металла начинается лишь в зазорах шириной 0,25 мм. Для того чтобы полностью подавить коррозию чугуна в самых узких зазорах (0,05 мм), концентрацию бихромата калия необходимо увеличдть до 10 г/л.
 |
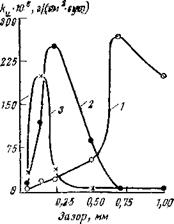 |
Рис. 3,9. Зависимость скорости общей коррозии (/), истинной скорости коррозии
(2) и площади коррозионных поражений (3) чугуїна от ширины зазора (электро-
лит ЗО мг/л INbCl + 70 мг/л Na2S04; ингибитор: 1 г/л КгСг207).
Рис. 3,10. Зависимость истинной скорости коррозии чугуна в щелях при контакте
с открытой поверхностью (соотношение площадей 1:1) от ширины зазора при
различных концентрациях бихромата калия (электролит: 30 мг/л ;NaCl-t-70 мг/л
Na2S04):
1 — 1 г/л; 2 — 3 г/л; 3 — 5 г/л.
Изучение электродных потенциалов чугуна в щелях показало, что при концентрациях бихромата калия, достаточных для полной защиты открытой поверхности металла, пассивное состояние чугуна в узких зазорах со временем нарушается и тем быстрее, чем меньше зазор и концентрация ингибитора.
В связи с этим и на чугуне могут возникнуть в электролитах, содержащих недостаточные для полной защиты концентрации хро — матов, активно-пассивные элементы, подобные тем, которые были описаны для стали в присутствии нитрита натрия. Для того чтобы избежать этого нежелательного явления, необходимо в конструкциях со щелевыми зазорами концентрацию хроматов увеличить в несколько раз по сравнению с обычно применяемыми. Другой вывод, который вытекает, — необходимость хорошего уплотнения
зазоров.
Двузамещенный ортофосфат натрия. Фосфаты относятся к смешанным ингибиторам, поэтому уменьшение их концентрации в щелях и зазорах может также привести к увеличению интенсивности коррозии, что и подтверждается экспериментами (рис. 3,11). В присутствии ортофосфата натрия железо в щели активируется, причем, чем уже зазор, тем на большей части поверхности. При концентрации, равной 2 г/л, в указанном выше электролите скорость общей коррозии составляет ~40-10-в г/(см2-сут) и мало меняется с шириной зазора (от 1 до 0,15 мм). Интенсивность же коррозии,
начиная с ширины зазора, равной 0,05 мм, непрерывно возрастает, что объясняется уменьшением активной части электрода. При ширине зазора 0,05 мм ївся поверхность металла їв щели находится в активном состоянии, в то івремя как при ширине зазора, равной 1 мм, в активном состоянии находится лишь ~15% общей поверхности. В таких условиях интенсивность коррозии должна, естественно, расти.
![ЗАЩИТА КОНСТРУКЦИЙ СО ЩЕЛЕВЫМИ ЗАЗОРАМИ Подпись: Рис. 3,11. Зависимость скорости общей коррозии (7), истинной скорости коррозии (2, 4) и площади коррозионных поражений (3) железа от ширины зазора при контакте с открытой поверхностью (соотношение площадей 1:1) в присутствии ортофосфата натрия (электролит: 30 мг/л NaCl + 70 мг/л Na2S04): /, 2, 3 - [Na2HP04] =2 г/л; 4 — [Na2HP04] = =6 г/л.](/img/1208/image105.gif)
![]() Таким образом, видно, что и фосфаты представляют определенную опасность при защите сложных конструкций со щелевыми зазорами. Однако, увеличив концентрацию ортофосфата натрия їв электролите до 6 г/л, можно уменьшить интенсивность коррозии железа и в зазорах, что наглядно иллюстрируется кривой 4 на рис. 3,11. ‘ ‘
Таким образом, видно, что и фосфаты представляют определенную опасность при защите сложных конструкций со щелевыми зазорами. Однако, увеличив концентрацию ортофосфата натрия їв электролите до 6 г/л, можно уменьшить интенсивность коррозии железа и в зазорах, что наглядно иллюстрируется кривой 4 на рис. 3,11. ‘ ‘
тенциалы железа в узких зазорах с течением времени становятся более отрицательными и приобретают значения, равные —0,5 В. Потенциал же металла, к которому имеется свободный доступ электролита, равен +0,05 В при 2 г/л Na2HP04 и +0,15 В при 4 г/л Na2HP04.
 |
Сульфат цинка. Сульфат цинка, как было выше показано, является катодным ингибитором, поэтому его опасность при недостаточной концентрации должна быть минимальной. При введении в исходный электролит 2 г/л ZnS04 скорость общей коррозии железа на открытой поверхности уменьшается с 129-10-6 до 64-10-4 г/(см2-сут). В щелях же она еще меньше и изменяется от 25-10-4 до 5-Ю-4 г/(см2-сут) при уменьшении зазора с 1,00 до 0,05 мм.
ние сернокислого цинка объясняется тем, что он не пассивирует сталь, а, действуя как катодный ингибитор, смещает потенциал металла на открытой поверхности в отрицательную сторону. В таких условиях, естественно, нет возможностей для функционирования активно-пассивных элементов и анодной поляризации металла в щели. Более того, смещение потенциала металла на открытой поверхности в отрицательную сторону электрохимически защищает металл в щели; в них коррозия меньше, чем на открытой поверхности.
 Таким образом, ингибиторы по их влиянию на щелевую коррозию можно разделить на две группы: одна из них при концентрациях, достаточных для защиты открытой поверхности от коррозии, приводит к интенсивной коррозии металла в щели; другая — уменьшает коррозию металла в щелях при любых концентрациях, так же как и на открытой поверхности. К первой группе относятся нитрит натрия, бихромат калия, двузамещенный фосфат и любые другие ингибиторы, которые защищают металл благодаря частичной пассивации электрода. Ко второй группе относятся сульфат цинка, нитрат кальция и другие ингибиторы, защищающие металлы от коррозии благодаря замедлению скорости катодной реакции. К этой группе ингибиторов можно, очевидно, отнести и такие анодные ингибиторы, механизм действия которых не связан с частичной пассивацией электрода, а обусловлен лишь уменьшением скорости анодной реакции, например, метаванадат натрия.
Таким образом, ингибиторы по их влиянию на щелевую коррозию можно разделить на две группы: одна из них при концентрациях, достаточных для защиты открытой поверхности от коррозии, приводит к интенсивной коррозии металла в щели; другая — уменьшает коррозию металла в щелях при любых концентрациях, так же как и на открытой поверхности. К первой группе относятся нитрит натрия, бихромат калия, двузамещенный фосфат и любые другие ингибиторы, которые защищают металл благодаря частичной пассивации электрода. Ко второй группе относятся сульфат цинка, нитрат кальция и другие ингибиторы, защищающие металлы от коррозии благодаря замедлению скорости катодной реакции. К этой группе ингибиторов можно, очевидно, отнести и такие анодные ингибиторы, механизм действия которых не связан с частичной пассивацией электрода, а обусловлен лишь уменьшением скорости анодной реакции, например, метаванадат натрия.
|
Таблица 3,1. Концентрации ингибиторов (г/л), необходимые для подавления коррозии железа и чугуна в электролите состава 30 мг/л NaCl+70 мг/л H2S04 (зазор 0,05 мм)
|
Из изложенного вовсе не следует, что защита конструкций со щелевыми зазорами ингибиторами невозможна. Практика показывает, что с помощью ингибиторов можно защищать самые сложные конструкции. Для этого требуется лишь вводить более высокие концентрации ингибиторов (табл. 3,1) или пользоваться катодными ингибиторами.
Эффективным средством подавления коррозии металлов в зазорах и щелях является также применение смесей ингибиторов, один из которых обладает окислительными свойствами. Добавка небольших количеств бихромата калия в коррозионную среду, содержащую ортофосфат натрия, как показали наши исследования, сильно увеличивает ингибирующие свойства ортофосфата: если
для защиты стали в исследованном нами электролите требовалось 4 г/л Na2HPC>4, то при дополнительном введении 10 мг/л К2СГ2О7 защита достигалась при 0,75—1,0 г/л Na2HP04. При меньших концентрациях фосфата добавки бихромата уменьшали коррозию более чем в 10 раз [56].
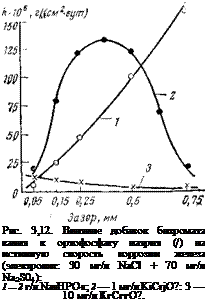
Высокие защитные свойства смесей хромата и фосфата проявляются и в щелевых зазорах. На рис. 3.12 показано, как изменяется коррозия железа в зависимости от ширины зазора при использовании чистого фосфата и фосфата, содержащего бихромат калия. В чистом фосфате интенсивность коррозии (1) непрерывно возрастает с увеличением ширины зазора (до 0,7 мм, при дальнейшем увеличении ширины зазора коррозия, вероятно, начала бы падать). При добавлении 1 мг/л К2СГ2О7 истинная скорость коррозии меняется с шириной зазора по кривой с максимумом (0,3 мм), и, наконец, при [К2СГ2О7] =10 мг/л интенсивность коррозии непрерывно уменьшается с шириной зазора и практически полностью подавляется при концентрации ортофосфата, равной 2 г/л. Благотворное влияние хромата, как полагает Эванс, связано с тем, что хромат способствует осаждению на поверхности металла мелкозернистого фосфата, обладающего более высокими защитными свойствами. Другое возможное объяснение связано с облегчением окислителем электрохимической реакции образования фосфата.
 26 августа, 2015
26 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 