Защита металлов от коррозии ингибиторами, как было показано, часто связана с химической адсорбцией, включающей изменение заряда адсорбирующегося вещества и перенос заряда с одной фазы на другую. Поэтому особое значение приобретает молекулярная структура ингибиторов. Электронная плотность на атомах функциональных групп, являющихся реакционным центром, влияет на прочность абсорбционной связи. Кроме того, прочность связи зависит и от свойств металла, а также поляризуемости функциональной группы.
В состав большей части органических ингибиторов входит по крайней мере одна полярная группа с атомом азота, серы, кислорода, а в некоторых случаях селена и фосфора.
В связи с этим большой интерес. представляют работы, в которых пытаются связать ингибирующие свойства органических соединений с их структурными особенностями. В этой области обширные исследования были проведены Хаккерманом [82], который сформулировал основные положения адсорбционной теории органических ингибиторов. По этой теории ингибирующие свойства многих соединений определяются электронной плотностью на атоме, являющемся основным реакционным центром. С увеличением электронной плотности у реакционного центра хемосорбци — ониые связи между ингибитором и металлом усиливаются. Исследуя ингибирующие свойства пиридина и его производных, Хак- керман установил, что защитные свойства этих соединений, т. е. способность уменьшать коррозию, действительно увеличиваются по мере увеличения электронной плотности на атоме азота в ряду: пиридин < 3-пикол. ин < 2-пиколин < 4-пиколин.
То же наблюдается у алифатических и циклических аминов: чем больше электронная плотность на атоме азота, тем более эффективен ингибитор. Циклические амины — лучшие ингибиторы по сравнению с алифатическими аминами, у которых электронная плотность на азоте существенно меньше.
Аналогичное исследование ингибирующих свойств ароматических аминов и тиолов и их производных было выполнено Риггосом
[838], который в согласии с теорией получил хорошее совпадение экспериментальных результатов с теоретическими предпосылками, связывающими защитные свойства ингибиторов с электронной структурой.
Трабанелли, Фисупа и Караеситти [62] распространили эти воззрения на механизм действия летучих ингибиторов коррозии. Изучая алициклические амины (циклогексиламин и дициклогексиламин) и их производные, авторы установили, что эффективность нгибиторов заметно растет с увеличением электронной плотности на атоме азота, которая определяется электронно-отталкивающим эффектом заместителей.
В связи с этим особый интерес представляет определение электронной плотности на атоме, являющимся центром реакции, а также установление основных закономерностей ее изменения. Особое значение последнее имеет для ароматических и гетероциклических соединений, поскольку у них электронная плотность на реакционном центре может сильно меняться при введении различных заместителей.
Эффективность функционального атома в адсорбционных процессах при равной стабильности соединений изменяется в следующем ряду: селен>сера>азот>кислород, что, по мнению Трабанелли и Караеситти [62], может быть объяснено меньшей электроотрицательностью элементов слева, вследствие чего их соединения легче поляризуются.
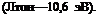 Если допустить, что у органических соединений при первой •ионизации происходит отрыв одного из электронов неподеленной пары, то мерой электронной плотности на атоме азота может служить ионизационный потенциал. Хаккерман и Макрайдис предлагают в связи с этим считать: чем меньше ионизационный потенциал, тем лучше должно адсорбироваться соединение; этиламлн (Люн = 3,32 эВ) лучше адсорбируется, чем этиловый спирт
Если допустить, что у органических соединений при первой •ионизации происходит отрыв одного из электронов неподеленной пары, то мерой электронной плотности на атоме азота может служить ионизационный потенциал. Хаккерман и Макрайдис предлагают в связи с этим считать: чем меньше ионизационный потенциал, тем лучше должно адсорбироваться соединение; этиламлн (Люн = 3,32 эВ) лучше адсорбируется, чем этиловый спирт
Донею с сотр. [84], излагая свои взгляды на механизм действия органических ингибиторов коррозии, показал, что защитные свойства органических соединений при коррозии железа в серной кислоте являются функцией констант Гаммета и Тафта, определяющих, как будет ниже показано, электронную плотность на реакционном центре. Они предложили уравнение, связывающее ингибирующие свойства метилзамещенных пиридинов с уравнением Гаммета:
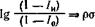 (4,66)
(4,66)
где /и и /0 — коррозионный ток в ингибированном и неингибированном электролитах; р и а — корреляционные константы.
Обширные исследования в этом направлении выполнил также Григорьев с сотр. [85, 86], который тоже связал ингибирующий эффект органических соединений с природой заместителей, исполь
зуя при этом уравнение Гаммета, применяющееся в органической химии для оценки скоростей реакций. По Гаммету [87], соотношение констант скоростей реакции органического соединения с заместителем R(A*) к константе скорости реакции органического соединения той же серии без заместителя (ко) определяется следующим равенством
lg(*R/*o) = po (4,67)
Константа а отражает влияние заместителя R на электронную плотность реакционного центра молекулы и не зависит от природы реакционного центра. Константа р постоянна для данной реакционной серии с определенным активным центром.
Полагая, что соотношение Гаммета, которое было выведена для реакции в гомогенных органических системах (диссоциация замещенных бензойных кислот), справедливо и для электрохимических реакций, Григорьев использовал его для оценки ингибирующих свойств ряда органических соединений. При этом было сделано допущение, что ингибирующий эффект обусловлен преимущественно эффектом блокировки поверхности адсорбированным веществом, который пропорционален доле закрытой ингибитором поверхности 0
*ивг = *о 0 0) (4,68)
где /цнг и і’о — плотности коррозионного тока ь ингибированном и неингибированном электролитах соответственно.
Допуская, что адсорбция подчиняется уравнению Ленгмюра
в = БС/(1+ВС) (4,69)
и решая совместно уравнения (4,67) и (4,68), Григорьев получил
lg(*-i) = igp+lgC (4,70)
ГДЄ & —ІоЛинг.
Органическое соединение с заместителем надо сравнивать со стандартным веществом данной серии (гомологического ряда) без заместителя при одинаковых концентрациях. Тогда получаем
lg[(ft — !)/(*„ — i)] = lg(B/B0) (4,71)
учитывая (4,67), имеем
|
lg (В/Во) = ро |
(4.72)
(4.73)
Для производных бензальдегида зависимость lg(&—1) от константы Гаммета сг, как это видно на рис. 4,12, подчиняется линейному закону, причем для железа и никеля увеличение электродонорных свойств заместителей в молекуле бензальдегида увеличи-
|
Рис. 4,12. Зависимость lg (k—l) от (полярности заместителей (константы Гамме — та а) в производных бензальдегида для железа він. НС1 ((Л) и 1 и. H2S04 (Б): |
/ — Н; 2-СН(СНзЬ; 3 — ОН (4); 4 — ОСН3 (2); 5 — N(CH)3)2 (4) (с=3 ммоль/л; цифра в.
скобках — положение заместителя).
Рис. 4,13. Зависимость lg.(&—4) от константы о для железа в 1 н. НС1, содер-
жащей основания Шиффа (0,1 ммоль/л) с различными заместителями:
1 — Н(1); 2 — ОСН3(4); 3- СН3(4); 4 — F(4);5 — Вг(4); 3—1(4); 7 —СООН(4). (Цифра в.
скобках — положение заместителя.)
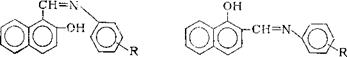
вает ингибирующий эффект. Для ароматических аминов (оснований Шиффа)
|
А в |
(рис. 4,13) эта же зависимость определяется двумя прямыми, пересекающимися в точке, соответствующей незамещенному соединению (а = 0). Эту зависимость авторы объясняют различным влиянием заместителей, смещающих электронную плотность на адсорбционном центре, на физическую и специфическую адсорбцию. Предполагают, что железо и никель в условиях этих экспериментов заряжены отрицательно, поэтому уменьшение электронной плотности на адсорбционном центре молекулы ингибитора при постепенном переходе от заместителей с отрицательными значениями о к положительным должно приводить к увеличению физической адсорбции, определяющейся электростатическим притяжени
ем. Ниже приведены значения констант Гаммета а для различных производных анилина:
Заместитель R……………………. n-ОН п-ОСН3 я-СН3 лг-СН, (Н) n-F
а……………………………………….. 0,357 0,268 0,170 0,069 0,00 0,062
Заместитель R……………………. п-С я-Br п-СООСН3 д-СОСХ’2Н5 л-СООН
а……………………………………….. 0,227 0,232 0,636 0,678 0,728
Однако эта закономерность не всегда соблюдается и необходимо учитывать и свойства металла, например электронное строение. Железо и никель имеют незавершенные электронные оболочки и могут выступать в качестве акцепторов электронов.
Тогда уменьшение электронной плотности на адсорбционном центре ингибитора должно снижать специфическую адсорбцию. От взаимодействия этих двух факторов и зависит ингибирующий эффект. Падение защитного эффекта аминов при снижении нук — леофильности заместителей (от а<0 до а = 0) объясняется, вероятно, одновременным изменением физической адсорбции и поверхностной концентрации специфически адсорбированных частиц. Насколько это объяснение правомерно, сказать трудно, так как в основу рассуждений авторов положено, что потенциал нулевого заряда железа равен нулю, а это, как было выше указано, оспаривается многими исследователями и не без оснований.
Для цинка ингибирующий эффект ароматических аминов в зависимости от констант Гаммета прямо противоположен тому, который наблюдался для железа и никеля. Объясняется это тем, что при наличии отрицательного заряда (фст—Фн. з=—0,18 В) уменьшение электронной плотности на адсорбционном центре молекулы, которое происходит при введении нуклеофильных заместителей, должно способствовать электростатической адсорбции и увеличивать ингибирующий эффект. Что же касается специфической адсорбции, то для цинка она не характерна.
Следуя этому принципу, электрофильные заместители, которые увеличивают положительный заряд на адсорбционном центре, должны облегчать адсорбцию молекул на отрицательно заряженной поверхности и снижать коррозию, однако они ее увеличивают. Эту аномалию авторы объясняют особенностями выделения водорода на цинке. Поскольку перенапряжение водорода на цинке в отличие от железа велико и скорость его выделения определяется стадией замедленного разряда ионов гидроксония, то при наличии в растворе поверхностно-активных веществ, содержащих атомы с неподелеиными парами электронов, возникают протонизированные комплексы, которые разряжаются легче, чем ионы гидроксония. Предполагают, что по мере перехода от заместителей с а<0 к заместителям с ст>>0 константа скорости разряда таких комплексов возрастает.
Из изложенного следует, что электронная структура органических соединений несомненно играет определенную роль в явлениях адсорбции и ингибирования коррозии. Однако развиваемые представления нуждаются еще в дополнительном исследовании. Они содержат много не всегда обоснованных допущений; главное из них то, что ингибирование обусловлено лишь экранирующим эффектом. Между тем, как было показано выше, во многих случаях ингибирование обусловлено энергетическими эффектами, в частности изменением ингибитором адсорбционного скачка потенциала в двойном слое, точки нулевого заряда и т. д. Другим не вполне обоснованным допущением является то, что адсорбционное взаимодействие между металлом и ингибитором происходит посредством одного атома реакционного центра. Между тем органические вещества не всегда адсорбируются одним активным центром, например непредельные углеводороды, полифункциональные органические соединения, аминокислоты могут адсорбироваться несколькими атомами на поверхности металла. Кроме того, органические соединения, в частности ароматические, часто плоско адсорбируются на поверхности металла в результате я-электрон — ного взаимодействия молекул с поверхностью. Это также не учитывается теорией [66].
Хотя электронный заряд на адсорбируемом центре и является важным фактором, им нельзя объяснить совокупность всех явлений, которые наблюдаются на практике. Так, Трабанелли отмечает, что увеличение ингибирующего эффекта при переходе от диэтил — к ди-н-бутил — и ди-н-гексилсульфиду можно объяснить электронно-отталкивающими свойствами алкильных групп, увеличивающими заряд серы за счет индуктивного эффекта (считают, что адсорбция серы происходит за счет неподеленной пары электронов серы), но уменьшение ингибирующего эффекта при переходе от ди-н-гексил — к ди-я-октил — и ди-я-децилсульфиду объяснить с этих позиций уже нельзя. (Индуктивный эффект алкильных групп должен расти с увеличением числа углеродных атомов.) Наиболее вероятно, что уменьшение ингибирующего эффекта при переходе от соединений с шестью атомами углерода к соединениям с десятью атомами углерода может быть объяснено экранирующим действием углеродных атомов.
Результаты, полученные при исследовании бутилсульфидов (ди-н-бутил, ди-втор-бутил и ди-грег-бутилсульфиды), еще в большей степени подчеркивают роль молекулярной структуры по сравнению с электронной; третичное соединение не проявляет ингибирующих свойств несмотря на то, что атом серы имеет наибольший электронный заряд, поскольку он экранирован метальными группами. Ингибирующее действие вопреки электронной плотности увеличивается от третичных к вторичным и первичным структурам.’
Кроме того, давно замечено, что органические соединения асимметричного строения оказываются более эффективными ингибиторами, чем соединения симметричного строения, что также не может быть понято при учете лишь электронной плотности реакционного атома. Отклонения от рассмотренной выше закономерности роста ингибирующей способности соединения с увеличением электронной плотности наблюдал также Курбанов с сотр. [124] при исследовании ингибирующих свойств пропаргиловых эфиров алкилфенолов. В отличие от замещенных анилина и пиридина, в которых введение заместителей всегда приводило к повышению защитного эффекта у. Для пропаргиловых эфиров сопоставление у со значением констант Гаммета а не дало однозначных результатов. Линейность зависимости lgy от о наблюдалась только для монозамещенных эфиров фенола. Для остальных же соединений увеличение lgy с ростом о наблюдалось лишь для электроноакцепторных заместителей. Для электронодонорных заместителей lgy с ростом а падал. Это, по мнению авторов, связано с эффектом сопряжения тройной связи с атомом кислорода эфира. Заместители с отрицательным индуктивным эффектом (—/), в частности галогены, понижают электронную плотность кольца, увеличивая поляризацию тройной связи. Ди — и тригалогензамещенные эфиры отклоняются от общей закономерности, вероятно, из-за наложения на отрицательный индуктивный эффект положительного мезомерного эффекта (+М), характерного для атомов галогенов, сопряженных с фенильными радикалами. Влиянием мезомерного эффекта можно, по мнению авторов, объяснить и кажущуюся аномалию снижения lgy при введении галогенов в кольцо.
При рассмотрении зависимости ингибирующих свойств органических соединений от молекулярной структуры следует также упомянуть работы Хаккермана [88] по адсорбции органических веществ с длинной углеводородной цепью из органических растворителей. Эти работы показали, что между адсорбируемостью соединений и их способностью ингибировать коррозионный процесс в кислотах имеется аналогия: чем лучше адсорбируется вещество, тем сильнее его защитные свойства. Из работ других исследователей вытекает, что по степени адсорбируемое™ алифатические соединения различных классов располагаются в следующий ряд: кислоты>амины>спирты>эфиры. Молекулы органических веществ, содержащие активные группы — доноры электронов (—CN, —CNS, —CNO, = СО, —СНО, —NH2) адсорбируются химически на поверхности металлов, имеющих незаполненные электронные орбитали. Высокой адсорбционной способностью отличаются этиленовые и особенно ацетиленовые производные, вследствие взаимодействия я-электронов с поверхностными атомами металла. Адсорбция поверхностно-активных органических веществ возрастает с увеличением их молекулярного веса и дипольного момента.
 28 августа, 2015
28 августа, 2015  admin
admin 
 Опубликовано в рубрике
Опубликовано в рубрике 