Окисные пленки, возникающие на углеродистых и низколегированных сталях, содержат несколько слоев, отличающихся по своему составу (рис. 7,1). По Эвансу [1, с. 128], нижний слой «высокотемпературной» окалины имеет состав, приближающийся к закиси железа FeO; следующий состоит из магнетита Fe304 и наружный— из гематита Fe203. «Низкотемпературная» окалина состоит из Fe304 и Fe203. При температурах ниже 575 °С закись железа неустойчива, поэтому она в «низкотемпературной» окалине отсутствует. По Богоявленской [139], «низкотемпературная» окалина имеет более сложный состав: кроме гематита и магнетита она содержит третий слой, прилегающий непосредственно к металлу и
состоящий из вюстита (твердый раствор Fe304 и FeO), включений высокодисперсного металлического железа и FeO. «Высокотемпературная» окалина состоит лишь из двух слоев — гематита и магнетита.
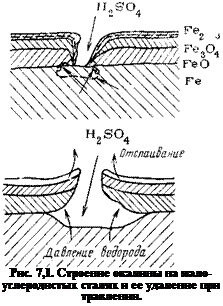 Закись железа хорошо растворяется в кислотах, поэтому она стравливается в первую очередь, способствуя отслаиванию верхних слоев. Окислы Fe304 и Fe203, как было выше показано, растворяются в кислотах гораздо хуже. Их удаление с поверхности в значительной степени обусловлено действием локальных коррозионных элементов, возникающих при самопроизвольном разрыве пленки
Закись железа хорошо растворяется в кислотах, поэтому она стравливается в первую очередь, способствуя отслаиванию верхних слоев. Окислы Fe304 и Fe203, как было выше показано, растворяются в кислотах гораздо хуже. Их удаление с поверхности в значительной степени обусловлено действием локальных коррозионных элементов, возникающих при самопроизвольном разрыве пленки
Железо (анод) | кислота |
окисел Fe3+ (катод)
На катоде окись Fe3+ восстанавливается до окиси Fe2+, которая переходит в раствор. Это явление известно под названием восстановительного растворения. Этот механизм, связывающий удаление окислов высшей валентности с поверхности металла не с непосредственным растворением гематита и магнетита кислотой, а с восстановительным растворением, был убедительно доказан Прайэром и Эвансом [140, с. 14]. Изучая растворимость окисла РегОз, авторы нашли, что непосредственное действие кислоты было медленным, а в растворе было обнаружено много ионов Fe2+, хотя окисел формально состоял из Fe203. Изучение модели короткозамкнутого элемента, составленного из окисла железа РеаОз и Fe, подтвердило, что железо является анодом, а окисел — катодом. При этом наблюдалось очень сильное растворение окисла с накоплением в катодном пространстве Fe2+. Таким образом, катодная реакция — может рассматриваться как процесс образования дефектов структуры в решетке окисла Fe3+ (увеличение концентрации Fe2+). Поскольку растворение окиси происходит предпочтительнее в дефектах структуры, то появление Fe2+ в растворе понятно.
Для травления углеродистых и низколегированых сталей применяют в основном H2SO4 и НС1. Взаимодействие H2SO4 с окислами железа описывается следующими уравнениями:
FeO + H2S04 = FeS04 + Н20 (7,1)
Fe203 + 3H2S04 = Fe2(S04)3 + 3H20 (7,2)
Fe304 + 4H2S04 FeS04 + Fe2(S04)3 + 4H20 (7,3)
Fe + H2S04 = FeS04 + H2 (7,4)
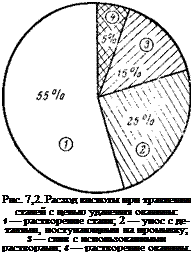
В 10%-ной H2S04 (40 °С), обычно применяемой в ЧССР для травления стали, растворяется в 6 раз больше железа, чем закиси железа, образующей наибольшую часть пленки окалины [141, с. 237]. Из общего количества расходуемой 10%-ной серной кислоты на химическое растворение окалины падает лишь 5% (рис. 7,2).
При травлении сплавов в соляной кислоте протекают следующие реакции:
|
FeO + 2НС1 = FeCl2 + Н20 |
(7,5) |
|
Fe203 + 6НС1 = 2FeCl3 + 3H20 |
(7,6) |
|
Fe304 + 8НС1 = FeCl2 + 2FeCl3 + 4H20 |
(7,7) |
|
Fe + 2HC1 = FeCI2 + H2 |
(7,8) |
В соляной кислоте за счет непосредственного химического растворения удаляется около 40% окалины [142, с. И, 72, 100], поэтому потери металла ниже. Кроме того, їв НС1 окалина удаляется быстрее. В этом отношении НС1 имеет преимущества перед H2S04. Однако в металлургической промышленности она применяется ограниченно, поскольку из-за малой ее концентрации (20—25%) необходимо иметь большие коррозионно-стойкие емкости для ее хранения и перевозки.
Оптимальной концентрацией серной кислоты для травления сталей в металлургической промышленности считают 20—22%, а соляной—18—20%. Обе эти кислоты должны применяться с
ингибиторами коррозии.
При травлении изделий в машиностроительной промышленности также применяют серную и соляную кислоты. Оптимальные концентрации выбираются в зависимости от природы и толщины
|
Таблица 7,1. Типовые составы растворов для травления стальных деталей
|
окалины (табл. 7,1). В качестве ингибиторов применяют ЧМ, КС, ПБ-5, ПБ-8, МН-10 [143, с. 57].
 Удаление окалины с низколегированных сталей происходит труднее, поскольку окалина имеет более сложный состав и содержит элементы, которые трудно растворяются в кислотах. Однако этот процесс можно ускорить добавлением к серной кислоте хлористого натрия.
Удаление окалины с низколегированных сталей происходит труднее, поскольку окалина имеет более сложный состав и содержит элементы, которые трудно растворяются в кислотах. Однако этот процесс можно ускорить добавлением к серной кислоте хлористого натрия.
По данным ‘[142], травление легированных сталей марок ШХ6, ШХ9, ШХ15, Н12ХГ лучше вести в 15—18%-ной H2S04, содержащей
3% NaCl и 0,1% ЧМ.- Температуру поддерживают вначале на уровне 60—70 °С, а при снижении концентрации кислоты до 5% поднимают до 80—90 °С.
Как видно из рис. 7,2 и экспериментальных результатов, изложенных выше, больше половины кислоты при травлении сталей расходуется на растворении металла. Считают, что при травлении теряется 2—4% (масс.) протравливаемой стали [141, с. 237]. Если учесть объем производства стали в нашей стране (~150 млн. т/год) и долю металла, іподвергаю — щегося травлению, можно представить, какое количество металла теряется при травлении. Правда, на металлургических заводах при регенерации травильных растворов часть железа извлекается в виде железных пигментов, однако потери все же огромны.
Применение ингибиторов кислотной коррозии позволяет резко сократить потери металла и, кроме того, предотвратить наводоро — живание стали, (возникающее при растворении металла по реакциям (7,4) и (7,8). При травлении сталей в H2S04 на наших заводах в качестве ингибиторов применяют в основном присадки ЧМ(Р)—0,1% и пенообразователь ЧМ(П) из расчета 0,1 кг на 1 м2 зеркала ванны. Находят применение и ингибиторы КС и ка — тапин. При травлении в соляной кислоте применяют ингибиторы ПБ-5, БА-6, ПБ-8 и катании. При травлении проволоки использование ингибитора ЧМ(Р) нежелательно, так как он образует на проволоке пленку, ухудшающую адгезию смазки, что увеличивает износ (волочильного инструмента. В этом случае рекомендуется применять присадку КС (0,15%) или отруби.
В работе [139, с. 83] сообщается об успешном применении на Ярославском моторном заводе при травлении черных металлов в серной кислоте ингибитора И-1-В (3 г/л) совместно с пенообразователем ЧМ(П). Рекомендуют [139, с. 88] использовать в качестве ингибито-ров коррозии и отходы коксохимического производства.
|
Таблица 7,2. Защитный эффект Z ингибиторов при травлении малоуглеродистой стали в 20%-ной H2S04 (/=40 мин)
|
Отмечается относительно высокий защитный эффект (у = 3-М0) ■ингибиторов КХ-2 (смесь веществ, содержащихся в сточной бесфенольной аммиачной воде) и КХК (концентрат) при добавлении к 20%-ной H2SO4 для травления катанки. При повышенных температурах защитные свойства ингибитора КХК выше, чем у ЧМ. Скорость снятия окалины в присутствии этих ингибиторов несколько ниже, чем в чистой H2S04, но такого же порядка, как в присутствии ЧМ(Р).
По данным [139, с. 94], при травлении образцов трубных сталей (ЭП756; 12ХМФ; 20П; 14X15; ЗОХГСА) в 20% H2S04 значительные преимущества перед присадкой ЧМ(Р) имеет ингибитор катапин К. Он позволяет сократить продолжительность удаления окалины в 1,5—2,5 раза.
Эффективность действия ингибиторов сильно зависит от температуры, что можно видеть из данных, приведенных в табл. 7,2 [139, с. 80]. Ингибитор ЧМ, в основном применяющийся в настоящее время на наших заводах, теряет свои защитные свойства уже при 70 °С и поэтому не может обеспечить быстрое удаление окалины. В порядке возрастания эффективности при высоких температурах ингибиторы располагаются в следующий ряд: ЧМ<уро- тропин<БА-6<И-1-А<тиокарбамид<катапин К<катапин А. Наилучшим ингибитором при высоких температурах является катапин А.
В заключение отметим, что Днепропетровская испытательная станция в результате многолетнего изучения большого числа ингибиторов рекомендует в настоящее время к промышленному применению при травлении в НС1 и H2S04 малоуглеродистых сталей следующие ингибиторы: И-1-В, И-2-В, ПКУ, ХОСП-Ю. (При травлении в H2S04 рекомендуется также еще и ингибитор С-5.)
 2 сентября, 2015
2 сентября, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 