Силикаты, представляющие собой соединения переменного состава nNa20-mSi02, образуют в водных растворах сложные коллоидные системы, обладающие специфическими физико-химическими свойствами. Знание этих свойств во многом определяет успешность защиты металлов от коррозии силикатами. Растворы высокомодульных натриевых силикатов содержат следующие частицы: _
1) ионы Na+, ОН~, Si03~, Н5Ю3, ftSiOs";
2) молекулы Na2Si03, Na2Si20s, H2Si03, Si02-ftNaOH;
3) комплексные образования (Si03)x, (H2Si03)cc, (Si02).v,
[ (mSi03-/iSi02’xH20) ]2~, (Si02)x-ttH20-r/Si03 и т. д.
Ввиду сложного состава таких коллоидных систем защитные свойства силикатов сильно зависят от pH среды, температуры и содержания солей в электролите, способствующих осаждению коллоидных частиц. Устойчивость золей Si02 в сильной степени зависит от концентрации водородных ионов. Определенные значения pH раствора способствуют чрезмерному укрупнению частиц
кремнезема и выпадению геля. Последнее часто приводит к неравномерному покрытию защищаемой поверхности и развитию местной коррозии. Поэтому чрезвычайно важно установить пределы pH, при которых коагуляция не наблюдается. Кислые и щелочные растворы, как правило, способствуют стабильному состоянию золя Si02.
 Из-за нестабильности коллоидных систем силикаты являются малоэффективными ингибиторами в средах, где концентрация солей велика. Последние вызывают быструю коагуляцию силикатов и осаждение их в виде хлопьевидного осадка.
Из-за нестабильности коллоидных систем силикаты являются малоэффективными ингибиторами в средах, где концентрация солей велика. Последние вызывают быструю коагуляцию силикатов и осаждение их в виде хлопьевидного осадка.
Силикаты весьма эффективно замедляют коррозию лишь в средах, содержащих небольшие концентрации солей (100—500 мг/л).
При защите от коррозии большое значение имеет и модуль силиката, представляющий отношение числа молекул кремнезема к числу молекул щелочного окисла (m/n). Для стали, как показали наши опыты, наиболее эффективными являются силикаты с модулем 2,4. Для алюминиевых сплавов — силикаты с более высоким модулем.
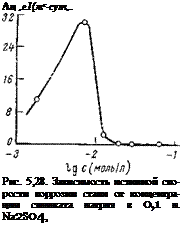
Зависимость истинной скорости коррозии стали от концентрации силиката натрия в 0,1 и. Na2S04 показана на рис. 5,28. При малых концентрациях ингибитора скорость коррозии возрастает. Более высокие концентрации защищают сталь полностью. Аналогичная зависимость наблюдается и в более разбавленных электролитах (30 мг/л NaCl +70 мг/л Na2S04). Оказалось, что концентрации силиката (от 10 до 100 мг/л), являющиеся эффективными для защиты от коррозии в проточных системах, не уменьшают в заметной степени коррозию в замкнутых системах с покоящимся объемом электролита. Для эффективной защиты таких систем требуются значительно более высокие концентрации силиката. Малые концентрации силиката обычно приводят к увеличению скорости коррозии. Однако эта коррозия отличается от наблюдаемой в присутствии малых концентраций хроматов и нитритов: она носит менее выраженный локальный характер, вместо питтингов и язв появляются местные очаги коррозии, занимающие относительно большую площадь. Такой вид местной коррозии, по сравнению с язвенной, является менее опасным, и в этом отношении силикаты обладают преимуществами перед хроматами и нитритом натрия.
Защитные свойства силикатов, как уже отмечались, зависят от температуры: с ростом температуры защитные концентрации ингибитора увеличиваются. Однако в отличие от нитрита натрия, в присутствии которого наблюдается непрерывный рост коррозии с увеличением температуры, в присутствии силикатов коррозия меняется с ростом температуры по такому же закону, как и в исходном электролите, т. е. она растет до 50 °С, после чего начинает падать. Объясняется это тем, что силикат не может выступать в роли катодного деполяризатора. Тем не менее в соответствии с механизмом, рассмотренным в гл. 2, он может при частичной пассивации электрода усиливать коррозию из-за увеличения скорости обычного катодного процесса восстановления кислорода.
Электродный потенциал стали в разбавленных электролитах при добавлении силикатов смещается в отрицательную сторону, становясь со временем все более отрицательным. Это свидетельствует о том, что катодный процесс тормозится. При высоких концентрациях силиката, близких к защитным, потенциал стали сдвигается в положительную сторону. Способность силикатов сдвигать потенциал железа в зависимости от концентрации как в отрицательную, так и в положительную сторону свидетельствует о том, что этот ингибитор вмешивается как в анодную, так и в катодную реакцию. Исследования кинетики электродных реакций подтвердили этот вывод. Катодная поляризуемость железа в присутствии силикатов сильно возрастает, а участки кривых, характерные для реакции восстановления кислорода, исчезают. Электрод сразу же начинает работать в диффузионном режиме. "
При малых концентрациях силикатов в неразмешиваемых электролитах анодная поляризуемость железа меняется слабо; при высоких концентрациях перенапряжение анодного процесса увеличивается и анодное растворение затрудняется.
Относительно молекулярного механизма действия силикатов существуют следующие предположения. Как уже отмечалось, в растворах силикатов имеются отрицательно заряженные ионы или сложные коллоидные частицы, несущие отрицательный заряд. Положительно заряженные ионы железа, которые накапливаются в местах, где начинается коррозионный процесс, вступают во взаимодействие с ионами силиката, образуя ферросиликаты. Последние тут же осаждаются, замедляя анодный процесс. Последующая адсорбция коллоидных мицелл происходит уже на новых участках, где начинается коррозия, пока на металле не образуется сплошная защитная пленка.
По другому механизму предполагается, что защита достигается благодаря образованию пленки, состоящей из отлагающихся на поверхности металла аморфного кремнегеля и гидрата окиси железа. Можно предположить, что преимущественная концентрация отрицательно заряженных частиц у наиболее слабых в отношении коррозии мест приводит к превращению неустойчивого зо
ля кремнезема в кремнегель, выделяющийся совместно с гидратом окиси железа в виде защитной пленки на металле.
Силикаты хорошо защищают от коррозии также свинец, олово и алюминий. Их вводят в специальные составы, применяющиеся для защиты свинцовых и алюминиевых оболочек кабелей. Защита алюминия в процессе производства и расфасовки косметических товаров, обладающих, как правило, щелочными свойствами, обеспечивается введением небольших количеств ‘высокомодульных силикатов. Высокомодульные силикаты снижают коррозию алюминия и в растворах соды. Достаточно к 1 н. Na2C03 добавить 0,025% Si02, чтобы коррозия алюминия практически прекратилась. Силикаты широко используются при травлении алюминиевых сплавов в щелочи перед анодированием. Пропитка анодных пленок растворами высокомодульных силикатов (т/п = 3,2) увеличивает в несколько раз защитные свойства пленок на анодированных алюминиевых сплавах.
Силикаты уменьшают коррозионное воздействие воды на железобетонные конструкции. Силикатирование почвы, осуществляющееся нагнетанием раствора силиката в слой почвы, прилегающий к железобетону, предохраняет от коррозии железную арматуру.
 29 августа, 2015
29 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 