Природа потенциала пассивации фп очень важна для понимания механизма возникновения пассивного состояния. По мнению Фет — тера [13, с. 831], наиболее правдоподобно, что потенциал пассивации соответствует потенциалу окисного электрода, определяющемуся суммарной электродной реакцией
Мле~ + лН20 <—* МО„ + 2яН+ + 2пе~ (1,20)
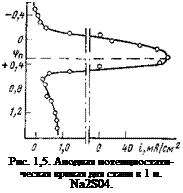
Если обратиться к данным, полученным нами для стали в 1 н. Na2S04, то потенциал пассивации окажется равным примерно +0,25 В[1] (рис. 1,5). Такие же значения получили Бонгоффер, Картледж и Франк. Этот потенциал намного по — ложительнее теоретических значений потенциалов образования трех известных окислов FeO, Fe203 и Fe304. Их потенциалы образования при pH =7 равны соответственно —0,42; —0,43 и —0,47 В (для Fe/Fe304 в кислой среде
 о
о
Фрн=о =—0,08 В). На эти отклонения впервые обратил внимание Бонгоффер; затем они стали предметом многочисленных исследований. По мнению Феттера [13], их можно объяснить, предположив, что пассивирующий слой со стороны металла состоит из Fe304, а со стороны электролита — из y-Fe203. Поскольку AF° реакций
Fe + 4Fe,03 —— ► 3Fe304 AF° = —96 140 Дж (1,21)
4FeO —— >• Fe304 + Fe AF° = -17 138 Дж (1,22)
имеет отрицательное значение, из известных окислов только Fe304 может находиться в равновесии с металлическим железом. Оба окисла железа Fe304 и Fe203 могут находиться в равновесии друг с другом лишь при определенном парциальном давлении кислорода, определяемом реакцией
3Fe203 ———- >■ 2Fe304 + V202 (1,23)
Когда достигается потенциал, при котором парциальное давление кислорода отвечает равновесию Fe203^Fe304, термодинамически становится возможным образование на слое окисла Fe304 со стороны электролита слоя Fe203. Таким образом, предполагается, что экспериментальный потенциал пассивации является потенциалом, соответствующим равновесию Fe203^Fe304. Его значение определяется суммарной электродной реакцией
2Fe304 + н20 3y-Fe203 + 2Н+ + 2е~ (1,24)
Доказательства в пользу такой сложной структуры пассивирующего окисла, состоящего из внутреннего, прилегающего к металлу, СЛОЯ Fe304 и внешнего, прилегающего к электроду, слоя Fe203, были получены в работах Нагаяма и Коэна [14]. При изучении этими авторами процесса катодного восстановления окисных слоев, полученных при пассивации, на кривых заряжения были обнаружены две задержки потенциала: первая (—0,26ч—0,36 В) связывается с восстановлением Fe203, а вторая (—0,68 В) — с восстановлением Fe3C>4. Чем более положителен потенциал, при котором формируется пассивирующая пленка, тем больше была разница между количеством электричества, которое получалось из расчета концентрации Fe2+ в растворе и количеством электричества, пошедшим на восстановление наружного слоя окисла. Это навело на мысль, что наружный слой окисла благодаря дополнительному окислению содержит ионы более высокой валентности и представляет собой пленку с повышенным содержанием кислорода по сравнению со стехиометрическим составом Fe203 (окисел с избытком катионных вакансий). Повышенным содержанием кислорода в наружном слое и обусловливаются, по мнению авторов, пассивирующие свойства подобных окислов.
Что касается состава, структуры и толщины окисных слоев, образующихся на пассивном железе, то электронографические исследования, выполненные Данковым и Шишаковым [15], а также Майном и Прайором [16], показали: на поверхности запассивиро — ванного железа имеется Fe203 или Fe3C>4. Оба эти окисла имеют одну и ту же кристаллическую решетку, но в отличие от Fe304 в Fe203 отсутствует каждый девятый ион железа.
Химический анализ пленки, снятой с запассивированного железа, показал, что она содержит лишь трехвалентное железо. По утверждению Эванса [1], пленка, снятая с пассивного железа, не растворяется в соляной кислоте, в то время как осажденный гидрат железа Fe(OH)3 или продукты коррозии (FeO-OH) легко в ней растворяются. Отсюда был сделан вывод, что за пассивацию ответственны окисные фазы, а не гидроокисные, которые не обладают защитными свойствами.
Несколько иную точку зрения на механизм возникновения пассивного состояния высказал Сато с сотр. [17]. По его мнению, двухслойная структура пассивирующего окисла не обязательна. Пассивное состояние может наступать и при наличии на поверхности одного гидратированного слоя Fe203 • 0,39Н2О. Обнаруженные же при кулонометрических исследованиях две остановки потенциала можно объяснить восстановлением гидратированного окисла до окисла более низкой валентности, а далее — до металла.
Имеются высказывания и о том, что пассивное состояние обусловлено возникновением FeO-OH. Сухотин [18] предполагает, что пассивное состояние железа обусловлено фазовой пленкой Fe3C>4, образование которой происходит через ряд промежуточных стадий. Основанием для такого вывода послужило то, что наблю-
даемый потенциал депассивации наиболее близко совпадает с рассчитанным потенциалом реакции восстановления Fe304 до FeO Fe3o4 + 6Н+ + 2<Г *=>
![]()
 FeO + 2Fe2+ + ЗН20 (ф° = 0,593)
FeO + 2Fe2+ + ЗН20 (ф° = 0,593)
Если принять эту схему, то можно объяснить, почему потенциал пассивации более положителен потенциала образования всех известных окислов железа.
 В последнее время стало очевидным, что способность окисных фаз пассивировать металлы находится в прямой зависимости от полупроводниковых свойств окислов. Еще в наших ранних работах с Оше [19, с. 103], а также в работах Бялоб — жеского с сотр. [20] по изучению влияния облучения на сплавы было обращено внимание на то, что электрохимическое и коррозионное поведение металлов меняется в соответствии с тем, как меняются под влиянием излучения свойства окисных пленок, которые рассматривались как полупроводники. При этом исходили из того, что природа полупроводниковой пленки и отклонения от стехиометрии играют существенную роль в процессах переноса зарядов и вещества через эти пленки.
В последнее время стало очевидным, что способность окисных фаз пассивировать металлы находится в прямой зависимости от полупроводниковых свойств окислов. Еще в наших ранних работах с Оше [19, с. 103], а также в работах Бялоб — жеского с сотр. [20] по изучению влияния облучения на сплавы было обращено внимание на то, что электрохимическое и коррозионное поведение металлов меняется в соответствии с тем, как меняются под влиянием излучения свойства окисных пленок, которые рассматривались как полупроводники. При этом исходили из того, что природа полупроводниковой пленки и отклонения от стехиометрии играют существенную роль в процессах переноса зарядов и вещества через эти пленки.
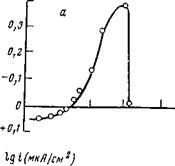
В связи с этим нами были предприняты попытки изыскать методы, которые позволили бы наблюдать за изменением полупроводниковых свойств окисных фаз, возникающих на поверхности металлов в процессе анодного окисления и пассивации. Весьма плодотворным в этом отношении оказался разработанный метод фотоэлектрической поляризации (ф. э. л.), который позволяет непрерывно, не вынимая электрод из электролита, наблюдать за поверхностной полупроводниковой фазой, изменением ее дефектной структуры и состава в процессе анодного окисления. Теория и сущность метода описаны в работах [21]. Из теории метода ф. э. п. следует, что характер и степень отклонения от стехиометрии окисла связаны со знакам и амплитудой фотоответа соотношением
где [Vjf+]°, [V" ]°—концентрации соответственно катионных и анионных вакансий в окисле.
Знак фотоответа указывает, какая из двух избыточных против стехиометрии компонент — металлическая или кислородная — преобладает, а амплитуда фотоответа позволяет определить, насколько одна избыточная компонента превышает другую. Таким образом, измеряя скорость анодного окисления металла и одновременно контролируя изменение полупроводниковых свойств окисных фаз, возникающих на поверхности металла, можно получить ценную информацию о механизме растворения и пассивации.
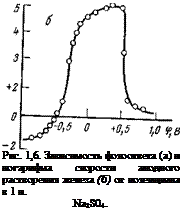
На рис. 1,6 приведены кривые зависимости ф. э. п. и плотности тока анодного окисления железа от потенциала электрода. Обе кривые получены одновременно на одном и том же образце. Можно видеть, что при потенциалах, отрицательнее — 0,5 В, регистрируются положительные значения ф. э. п., что связано с наличием на поверхности низшего окисла FeO, обладающего дырочным типом проводимости и содержащего избыточный кислород.
Области активного растворения железа и области пассивации отвечают отрицательные значения ф. э. п. Это, согласно (1,25), указывает на то, что поверхностные окислы, существующие на железе в области активного растворения и в области пассивации, обладают проводимостью преимущественно электронного типа и содержат избыточные против стехиометрии атомы железа. Поскольку для окислов железа характерна разупорядоченность за счет анионных вакансий, поверхностный окисел в области пассивации железа отвечает общей формуле разупорядоченности
РЄ2І2,(Р4+ e-l[vl~}^O^x (1,26)
где х — число недостающих атомов кислорода; [ ]® —‘концентрация анионных
вакансий; е~ — локализованный вблизи вакансии электрон.
Общая формула разупорядоченности поверхностного окисла в области активного растворения может быть представлена в сле^ дующем виде:
F4±2Х + КЇ+2* N+ е2х/[If~]°) 024Zx (1,27)
Эти результаты находятся в соответствии с данными об электронной проводимости массивных образцов FeO, Fe304 и у-РегОз за счет избыточного железа в решетке, полученными в обычных условиях по знаку эффекта Холла или термо-э. д. с. Из рис. 1,6 можно видеть, что при потенциалах активного растворения значение отрицательной ф. э. п. растет до потенциала пассивации (+0,45 В). Это указывает, согласно (1,25), на преимущественно катионный характер переноса в окисной фазе при этих потенциалах и на то, что активное растворение железа связано с увеличением отклонения от стехиометрического состава поверхностного окисла и ростом концентрации дефектов структуры — анионных вакансий (ионов Fe^ и свободных электронов).
При накоплении на стадии активного растворения анионных вакансий в оквсной фазе РезС>4 последняя при достижении критической концентрации вакансий выходит за пределы области гомогенности, теряет устойчивость и переходит в новую фазу с более высокой валентностью катиона. Согласно данным ф. э. п., это происходит при потенциале +0,45 В, отвечающем потенциалу пассивации. Эта новая фаза, как было отмечено выше, по данным электронной дифракции, отвечает формуле у-РегОз. Таким образом, потенциал пассивации соответствует потенциалу равновесия Рез04^уРе20з или равновесию между валентными состояниями Fe2+ и Ре3+.
![]() Падение отрицательной ф. э. п. после достижения максимума при потенциале пассивации указывает на то, что при формировании у-Ре203 катионный характер окисления сменяется анионным. Иными словами, при потенциалах выше потенциала пассивации происходит преимущественная сорбция кислорода поверхностной фазой. При этом возникает эквивалентное количество пустых узлов и ионов Fe3+ в металлической подрешетке окисла. Появление катионных вакансий приближает состав окисла к стехиометрическому.
Падение отрицательной ф. э. п. после достижения максимума при потенциале пассивации указывает на то, что при формировании у-Ре203 катионный характер окисления сменяется анионным. Иными словами, при потенциалах выше потенциала пассивации происходит преимущественная сорбция кислорода поверхностной фазой. При этом возникает эквивалентное количество пустых узлов и ионов Fe3+ в металлической подрешетке окисла. Появление катионных вакансий приближает состав окисла к стехиометрическому.
Поскольку анионные и катионные вакансии обладают соответственно свойствами доноров и акцепторов электронов, переход к стехиометрическому составу приводит к акцепторно-донорной компенсации у окисла, благодаря чему концентрация Fe2+ (или концентрация ЗйТэлектронов) в окисле уменьшается.
На рис. 1,7 приведена кривая отклонения поверхностных окислов на железе от стехиометрического состава в зависимости от потенциала электрода. Кривая построена по данным ф. э. п. с использованием уравнения (1,25). Из кривой могут быть определены области потенциалов, в пределах которых окислы сохраняют гомогенность, а также отклонения от стехиометрии. В частности, из рис. 1,7 можно увидеть, что области пассивации отвечает окисная фаза переменного состава у-РегОп, где и изменяется с анодным потенциалом от 2,994 при потенциале пассивации до 2,999 при потенциале полной пассивации.
Таким образом, исходя из результатов, полученных с помощью метода ф. э.п., пассивация железа в 1 н. растворе Na2S04 обусловлена изменением состава поверхностного окисла в сторону стехиометрического состава, резким уменьшением концентрации нестехиометрических дефектов и акцепторно-донорной компенсацией
у окисла. К аналогичным выводам о механизме анодной пассивации пришли при изучении методом фотоэлектрической поляризации анодного окисления меди и серебра в растворе щелочи и никеля в кислом растворе.
Вопрос о том, какое количество кислорода должно быть на поверхности металла для того, чтобы он перешел в пассивное состояние, до сих пор остается дискуссионным. Проблема пассивного состояния рассматривалась нами до сих пор, исходя из пленочной теории пассивности, связывающей переход металлов из активного состояния в пассивное с возникновением на поверхности металла окисных пленок, образующих отдельную фазу (толщина пленки на пассивных металлах достигает часто 50—100 А). Между тем имеется ряд наблюдений, указывающих на то, что можно сильно снизить скорость растворения металлов при адсорбции на поверхности металла такого количества кислорода или другого агента, которого явно недостаточно даже для образования одного атомного слоя. Впервые это было продемонстрировано Эршлером [22] при исследовании анодного растворения платины; он показал, что скорость процесса убывает с увеличением количества кислорода на поверхности платины по экспоненциальному закону; при заполнении 6% поверхности кислородом скорость растворения уменьшилась в 4 раза. В дальнейшем Кабанов и Лейкис [23] показали, что железо при анодной поляризации может быть переведено в пассивное состояние в 0,5 М NaOH, если через него пропустить 1-г1,5 мКл/см2 электричества. Этого количества электричества явно недостаточно для того, чтобы возник одноатомный слой кислорода или одномолекулярный слой y-Fe203, который, как было выше указано, ответствен за пассивное состояние.
Интересные результаты в этом отношении были получены также Снейвли и Хаккерманом [24]. По их данным для пассивации железа в подкисленном растворе сульфата требуется ~3 мКл/см2 электричества в расчете на видимую поверхность. Далее авторы катодной поляризацией восстанавливали пассивный слой и наблюдали за анодным поведением электрода; оказалось, что можно восстановить ~70% окисного слоя, а электрод останется в пассивном состоянии. Такой частично восстановленный электрод анодно не растворяется. Отсюда было сделано заключение, что для пассивирования железа в сульфатном растворе достаточно ~ 1 мКл/см2 электричества, что соответствует моноатомному слою кислорода. Такая пассивность в отличие от фазовой называется адсорбционной.
Чтобы объяснить эти экспериментальные результаты, приходится прибегать к разного рода допущениям, которые не всегда могут быть доказаны. В частности, одни авторы допускают, что под влиянием адсорбированного кислорода изменяется распределение электронов в поверхностном слое металла. Другие считают, что на поверхности электрода имеется ограниченное число активных центров, связывание которых достаточно для прекращения коррозии. На этих активных центрах в первую очередь и адсорбируется пассиватор, и поэтому нет необходимости в мономолекулярном заполнении. И наконец, допускают возможность проявления хемосорбционных сил на расстоянии (эффект дальнодействия), а также возможность изменения строения двойного слоя.
В частности, Эванс, который является сторонником фазовой теории пассивности, считает (если предположить, что переход железа в раствор возможен только на участках с дефектной структурой), что для пассивации достаточно менее одного монослоя кислорода. Однако природа пассивирующего слоя не изменится. Для полной пассивации, по Эвансу, необходимо, чтобы на поверхности металла возникла трехмерная пленка [25]. Аналогичную точку зрения высказал недавно Хор [26]. По его мнению, одного монослоя кислорода может и достаточно для временного уменьшения реакционной способности металла, но для того чтобы металл остался в пассивном состоянии при изменении внешних условий (например, при переносе железа из концентрированного раствора азотной кислоты в разбавленный, которое наблюдали Фарадей и Шенбейн), необходима более толстая окисная пленка.
Франкенталь [27] на сплавах системы Fe—Сг недавно показал, что пленка из адсорбированного кислорода приостанавливает коррозионный процесс при потенциалах более положительных, чем потенциал пассивации, однако металл вновь активируется, когда потенциал становится более отрицательным. Трехмерная пленка окисла защищает от коррозии и в том случае, когда потенциал сместится в область, характерную для активного растворения. В этом смысле адсорбционная пленка не нарушает обратимость системы, в то время как трехмерная пленка создает дополнительный тормозящий эффект. Из этих экспериментов делается вывод, что наблюдаемые изменения свойств системы несомненно связаны с наличием пленок значительной толщины. В ряде случаев (действие I’ и F" в кислотах) пассивное состояние действительно обусловлено адсорбционными слоями, но удовлетворительной теории, которая объясняла бы эти явления, пока еще не существует.
Длительное время фазовая и адсорбционная теории пассивации противопоставлялись. На самом же деле оснований к этому мало, поскольку один вид пассивности может переходить в другой, а иногда, вероятно, они могут проявляться одновременно. В частности, известно, что фазовой пассивности предшествует адсорбционная, а адсорбционная, как было предположено Акимовым и Батраковым [28, с. 11], облегчается при наличии на поверхности фазовой пленки.
Швабе [29], изучавший анодную пассивацию на обновленной методом зачистки поверхности металлов, пришел к выводу, что за пассивное состояние ответствен образующийся хемосорбированный слой кислорода. Поскольку металлы анодно пассивировались и в условиях, когда съем металла при зачистке поверхности был велик, связывать пассивацию с образованием фазового окисла трудно.
Наметившееся сближение между адсорбционной и фазовой теориями пассивности можно усмотреть и в трактовке природы пассивирующего слоя, которая дается в работах других авторов. В частности, Мансфельд и Улиг [30] хотя и утверждают, что пассивная пленка, возникающая на сплавах элементов с незаполненными ^-подуровнями, состоит главным образом из хемосорбированного кислорода, но отмечают, что она может содержать определенную фракцию металлических ионов, но не в обычных стехиометрических соотношениях. Здесь уже трудно провести грань между понятиями хемосорбционный слой кислорода и фазовая пленка.
Скорчеллетти [31, с. 253] полагает, что необходимо пересмотреть сами понятия фазового окисла и хемосорбированного слоя. Не исключено, что окисные пленки толщиной в один или несколько элементов кристаллической решетки имеют иные термодинамические свойства, чем компактные окислы. С другой стороны, свойства хемосорбированного кислорода сходны с химическими свойствами окислов. Поэтому стирается грань между понятиями хемосорбированный кислород и фазовый окисел.
Такой подход, по мнению Скорчеллетти, устранил бы противоречия в толковании природы пассивности. Однако на данном уров-
|
Таблица 1,1. Изменение потенциала Д<р (мВ) в отрицательную сторону под влиянием непрерывной зачистки поверхности металла, погруженного в 0,1 н. раствор электролита
|
не наших знаний это сделать непросто, ибо имеется ряд экспериментальных фактов, свидетельствующих как в пользу адсорбционной, так и фазовой пассивности.
В пользу концепции пассивности, обусловленной фазовыми пленками, убедительно говорят экспериментальные результаты по изменению потенциалов металлов при зачистке их поверхности под растворами электролитов, которую впервые применил Акимов [32]. Удаление пленки с поверхности металла, как правило, приводит к смещению потенциала в отрицательную сторону (табл. 1,1); это, несомненно, указывает на превалирующую роль окисных фазовых слоев в установлении стационарного потенциала, а следовательно, кинетики коррозионных электродных реакций и пассивности.
Заслуживают также внимания работы Сухотина [33] и Нова — ковского [34], в которых убедительно показано, что имеется глубокая аналогия между электрохимическими свойствами магнетита и пассивирующей пленки на железном электроде. Сходство проявляется в том, что как магнетит, так и пассивное железо растворяются по электрохимическому механизму, а выход катионов в раствор регулируется свойствами нестехиометрического слоя окисла, возникающего на магнетите [34]. В этих работах получено много доказательств в пользу того, что пассивное состояние ряда металлов обусловлено возникновением фазовых пленок.
 19 августа, 2015
19 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 