Ингибиторы, адсорбирующиеся химически или способствующие окислению поверхности металла кислородом воды, сильно замедляют анодную реакцию ионизации металла и поэтому оказываются более эффективными, чем физически адсорбированные ингибиторы или ингибиторы, которые тормозят лишь одну катодную реакцию.
Однако анодные ингибиторы при неблагоприятных условиях, когда концентрация их в электролите понижается настолько, что ее уже недостаточно для того, чтобы запассивировать всю поверхность, могут, как было показано выше, усилить скорость коррозии в тех местах, где коррозионный процесс не приостановлен. Объясняется это эффектом внутренней анодной поляризации, возникающей за счет неполной пассивации электрода. Когда электрод не полностью запассивирован, происходит дифференциация электрохимических реакций, обусловливающих коррозионный процесс, по поверхности и небольшая активная часть поверхности подполя — ризовывается анодно за счет увеличения эффективности катодного процесса на запассивированной части электрода. В этом отношении анодные ингибиторы, если их неразумно применять, из-за частичной пассивации электрода и локализации анодного процесса представляют определенную опасность.
В таких условиях рассматривать электрод как единую систему, на поверхности которой в каждой точке со статистической вероятностью по времени и пространству одновременно протекают анодные и катодные реакции, нельзя. Расчет скорости реакции на всю поверхность без учета этого фактора приводит к ошибочным результатам. Локализация анодного процесса часто заходит так далеко, что приходится электрохимические реакции, лежащие в основе коррозионного процесса, «привязывать» к определенным участкам поверхности.
Частичная пассивация электрода приводит также к существенному изменению скорости электрохимических реакций при соблюдении равенства анодных и катодных токов.
При частичной пассивации скорость растворения металла на активной части электрода должна возрасти и зависеть от кинетических особенностей тех реакций, которые определяют суммарный коррозионный ток: чем сильнее поляризуется катод в фоновом электролите, тем выше скорость растворения на активной части электрода и, наоборот, чем сильнее поляризуется анод, тем ниже скорость растворения той части электрода, которая осталась в активном состоянии.
Расчет и экспериментальные результаты показывают, что при неполной пассивации электрода степень заполнения поверхности пассивирующим слоем, как правило, намного выше степени уменьшения коррозии. Иными словами, коррозионный ток I изменяется в гораздо меньшей степени, нежели пассивная часть поверхности. Следствием такого положения должно быть увеличение плотности тока на активной части электрода.
Локализация коррозионного процесса способствует также изменению характера коррозионной среды. Когда электродные реакции не локализованы по поверхности, а статистически распределены по ней, продукты катодной (ОН-) и анодной (Н+) реакций взаимно нейтрализуют друг друга. При локализации же создаются благоприятные условия для подкисления среды на тех участках, где преимущественно протекают анодные процессы: pH при этом может измениться на несколько единиц, что сильно увеличивает, как было нами показано на примере органических хроматов, скорость анодного растворения.
Если к тому же ингибитор обладает окислительными свойствами и способен при потенциале коррозии восстанавливаться на электроде с заметной скоростью, не переводя металл в пассивное состояние, то это может привести к увеличению скорости и сопряженной анодной реакции, а следовательно, и коррозии. Частичная пассивация поверхности приводит к появлению в системе активнопассивных элементов со значительной разностью потенциалов (0,4-г-0,6 В), которые усиливают коррозию на активной части электрода.
Работа таких коррозионных элементов должна учитываться при защите ингибиторами. Поведение двухэлектродных систем легче всего анализировать по диаграммам Эванса, а поведение многоэлектродных систем — на основе теории, разработанной Акимовым и Томашовым [32, с. 88; 54, с. 209].
Зная зависимость скорости электродных процессов от потенциала, а также площадь анодных и катодных составляющих системы, можно по поляризационным кривым построить диаграмму коррозионного процесса, позволяющую рассчитать силу тока, а следовательно, и коррозию. Коррозионная диаграмма изображается двумя кривыми (катодной ВБ и анодной АБ поляризации), характеризующими зависимость потенциалов катода и анода от силы тока (рис. 3.1). Точка пересечения кривых соответствует максимальному току /макс, который может дать данная пара. По
следнее обычно реализуется в том случае, когда коррозионная среда обладает высокой электропроводностью. В таких электролитах потенциалы катода и анода благодаря поляризации практически. выравниваются, т. е. система полностью заполяризовывается.
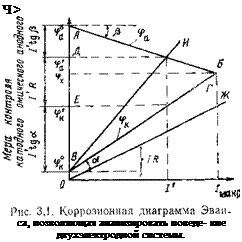 Наклон кривых определяет меру контроля ‘скорости коррозионного процесса данной электродной реакцией. Мерой контроля анодной и катодной реакций служат тангенсы углов аир.
Наклон кривых определяет меру контроля ‘скорости коррозионного процесса данной электродной реакцией. Мерой контроля анодной и катодной реакций служат тангенсы углов аир.
Из диаграммы следует, что при линейной зависимости потенциала от тока потенциалы катода и анода определяются уравнениями
|
Фк = Фк — I tga = ф°к — рк1 |
(3,1) |
|
Фа = Фа + / tg Р = Ф°а + PJ |
(3,2) |
|
где Рк и Яа — катодное и анодное поляризационные сопротивления. |
В точке пересечения кривых, соответствующей максимальному току, потенциалы катода и анода равны
|
Фк — ^к^макс — Фа “Ь Раймаке |
(3,3) |
|
^макс = (фк — Фа)/к + ^а) |
(3,4) |
Из уравнения (3,4) следует, что в полностью заполяризован — ных системах начальная разность потенциалов расходуется на преодоление катодного и анодного поляризационных сопротивлений.
Системы, обладающие значительным омическим сопротивлением, не могут считаться полностью заполяризованными, и при определении тока коррозии приходится учитывать и омическое падение потенциала в электролите (I’R). Естественно, что ток в системе не будет уже соответствовать максимальному, а выразится меньшей величиной I’.
Уравнение, описывающее коррозионный процесс, в данном случае выводится следующим образом. Из рис. 3,1 следует, что ток /’, отвечающий омическому сопротивлению R, равен
![]() »-К-фО/*
»-К-фО/*
Значения потенциалов фа и ср* определяются, как было показано выше, уравнениями
ФІ = Ф°а + раг (3,6)
Фк = Ф°к — ркГ (3,7)
Следовательно
С = (фк-Ф°а)/(Я+ Л< + — Ра) (3,8)
Уравнение (3,8) является основным уравнением коррозионного процесса, учитывающим как поляризационное, так и омическое сопротивление. Из этого уравнения следует, что при наличии поляризации и сопротивления ток определяется начальной разностью потенциалов и суммой поляризации и омического сопротивления. Следовательно, начальная разность потенциалов пары расходуется в данном случае на преодоление омического сопротивления I’R, анодного поляризационного сопротивления I’R& и катодного поляризационного сопротивления I’RK.
Из этого же уравнения, а также на основании работ [32, 46, 54], выполненных Акимовым, Томашовым, Розенфельдом, следует, что поляризация и сопротивление эквивалентны и, следовательно, могут складываться.
Если омическое сопротивление гальванического элемента известно, значение коррозионного тока определяется методом суммирования прямой омического падения потенциала в электролите с кривой катодной поляризации. Для двух электродов (F— 1 см2), находящихся друг от друга на некотором расстоянии, омическое падение потенциала в электролите для разных значений плотностей тока выразится произведением удельного сопротивления электролита на расстояние и плотность тока (см. прямую ОЖ на рис. 3,1). Просуммировав на ординате прямую омического падения потенциала в электролите (ОЖ) с кривой катодной поляризации (ВБ), получим суммарную кривую катодной поляризации ВИ. Пересечение этой новой кривой, включающей как омическое падение потенциала, так и катодную поляризацию, с кривой анодной поляризации дает значение коррозионного тока Г.
Используя выведенные выше отношения, можно проанализировать, как должен вести себя частично запасеивированный электрод.
 23 августа, 2015
23 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 