§ 1. ПАССИВАЦИЯ МЕТАЛЛОВ В ПРИСУТСТВИИ
ИНГИБИТОРОВ, ОБЛАДАЮЩИХ
ОКИСЛИТЕЛЬНЫМИ СВОЙСТВАМИ
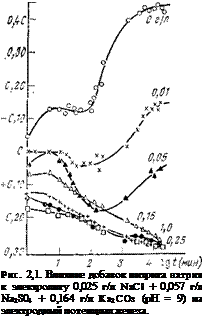
Первый путь ингибирования, заключающийся в уменьшении скорости анодной реакции ионизации металла, можно проиллюстрировать на примере действия нитрита натрия. Этот ингибитор сильно сдвигает потенциал стали в положительную сторону, переводя ее в пассивное состояние. При наличии в электролите уже небольших концентраций ингибитора начальный потенциал стали смещается приблизительно на 0,2 В в положительную сторону, а конечный, через 10 суток, более чем на 0,7 В (рис. 2,1). Сильный сдвиг потенциала в положительную сторону во времени свидетельствует о химической природе связи металла с ингибитором и ее усилении во времени. При физической адсорбции этот процесс протекал бы довольно быстро.
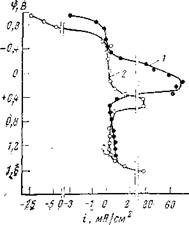
В присутствии нитрита натрия анодная поляризуемость электрода сильно возрастает, о чем можно судить по потенциостатиче — ской кривой, представленной на рис. 2,2. При потенциале пассивации стальной электрод находится в электролите с ингибитором (кривая 2) по существу в пассивном состоянии; скорость растворения очень мала. В принципе, перевод стали в пассивное состояние ингибитором окислительного типа может явиться результатом увеличения эффективности катодного процесса или уменьшения скорости анодного процесса. То что в данном случае имеется классический пример пассивации металла за счет уменьшения скорости анодной реакции, а не за счет увеличения эффективности катодного процесса, подтверждается результатами кинетических исследований катодного процесса. Если бы нитрит-ион восстанавливался с малым перенапряжением, то при потенциалах коррозии должно было бы наблюдаться заметное увеличение скорости катодной реакции. На самом деле ни в кинетической, ни в диффузионной области скорость катодного процесса не возрастает.
Известно, что восстановление нитрит-ионов происходит по следующей реакции:
NO-Г + 6е" + 7Н+ —— V NH3 + 2НгО (2,1)
Следовательно, при наличии достаточно чувствительного метода анализа аммиака можно, поляризуя длительно катод в малом объеме электролита при различных потенциалах, определить то значение, при котором этот процесс протекает. Весьма чувствительным индикатором на аммиак является реактив Несслера (0,00007 мг/л). Растворы, содержащие малые концентрации аммиака, окрашиваются реактивом Несслера в желтый цвет:
 2K2(HgI4) + ЗКОН + NH4OH —
2K2(HgI4) + ЗКОН + NH4OH —
л
= /NHJ + 7KI + ЗН20 (2,2
Hg
 Анализы показали, что при катодной поляризации стали в нейтральных электролитах аммиак обнаруживался лишь при отрицательных значениях потенциала (—0,6-=—0,7 В), намного превосходящих потенциал коррозии. При стационарном потенциале аммиак этим весьма чувствительным мєтодоім обнаружить не удалась.
Анализы показали, что при катодной поляризации стали в нейтральных электролитах аммиак обнаруживался лишь при отрицательных значениях потенциала (—0,6-=—0,7 В), намного превосходящих потенциал коррозии. При стационарном потенциале аммиак этим весьма чувствительным мєтодоім обнаружить не удалась.
![]() Основная причина высокого перенапряжения для этой реакции заключается в строении нитрит-иона, отличающегося устойчивой электронной структурой, затрудняющей подход к катоду и деформацию иона в электрическом поле. Известно, что подход к отрицательно заряженному катоду частиц с отрицательным знаком возможен лишь в случае сложных анионов, способных к деформации в электрическом поле. Однако нитрит-ион настолько мал и обладает столь устойчивой электронной структурой, что его деформация, которая способство — Рис — 2>2- Влияние нитрита натрия на — анодное растворение стали:
Основная причина высокого перенапряжения для этой реакции заключается в строении нитрит-иона, отличающегося устойчивой электронной структурой, затрудняющей подход к катоду и деформацию иона в электрическом поле. Известно, что подход к отрицательно заряженному катоду частиц с отрицательным знаком возможен лишь в случае сложных анионов, способных к деформации в электрическом поле. Однако нитрит-ион настолько мал и обладает столь устойчивой электронной структурой, что его деформация, которая способство — Рис — 2>2- Влияние нитрита натрия на — анодное растворение стали:
(- 1 н. Na2S04; 2 — I н. Na2SO4+0.6%
NaN02.
ного пространства, затруднена. Потенциал катода должен иметь слишком большое отрицательное значение, чтобы произошла деформация нитрит-иона и его восстановление. Опыты показывают, таким образом, что пассивное состояние стали в нейтральных электролитах в присутствии нитрит-ионов не связано с увеличением эффективности катодного процесса; оно наступает в результате непосредственного влияния этих анионов на кинетику анодной реакции.
Механизм процесса может в корне измениться, если изменится pH коррозионной среды. В частности, в кислых и слабокислых электролитах восстановление нитрит-ионов сильно облегчается вследствие образования азотистой кислоты, которая, в свою очередь, образует окись азота, легко восстанавливающуюся на различных металлах:
3HNOa = 2NO + NO3 + Н+ + Н20 (2,3)
NO + 5е~ + 6Н+—— >■ NH+ + Н20 12,4)
Возникновение нового катодного деполяризатора приводит часто к усилению коррозии. Хотя плотность катодного тока и растет, она не столь велика, чтобы перевести металл в пассивное состояние. Этим объясняется усиление коррозии охладительных систем, защищенных нитритом натрия, при случайном подкислении среды.
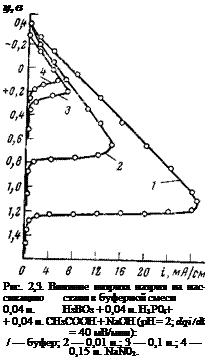
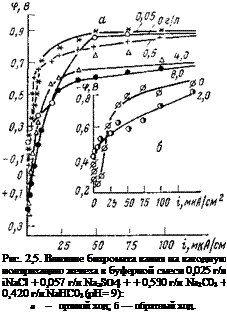
Обращает на себя внимание, однако, одна интересная особенность. Оказывается, что с помощью достаточных концентраций нитрита натрия можно запассивировать сталь и в кислых электролитах, в которых стабильность фазовых пленок низка. На рис. 2,3 представлен ряд потенциодинамических кривых, полученных в кислом буферном электролите (pH=2), в котором концентрация нитрита натрия непрерывно менялась. По мере увеличения концентрации нитрита натрия в буферном электролите пассивация стали облегчается: потенциал пассивации смещается в отрицательную сторону, а токи пассивации падают. При концентрации нитрита натрия 0,15 н. ток пассивации снижается с 20 мА/см2 в чистом буферном электролите до 6 мА/см2, а потенциал пассивации — с -{-1,1 В до +0,05 В. Если же довести концентрацию нитрита натрия до 0,25 н., сталь переходит в пассивное состояние, на что указывает значение стационарного потенциала <pCT = = +0,33 В).
Наблюдающееся и в присутствии нитрита натрия влияние нитрит-ионов на пассивацию можно объяснить их адсорбцией, которая уменьшает свободную энергию системы и затрудняет переход ионатомов металла из решетки в раствор. Вероятность того, что нитрит-ионы изменяют характер пассивирующего слоя, мала. На это, в частности, указывает прямолинейная зависимость между потенциалом пассивации и pH, которая обычно характерна для электрохимической реакции возникновения окисного слоя. По-видимому, при высоких концентрациях нитрита натрия скорость катодного процесса возрастает настолько, что становится возможной пасси
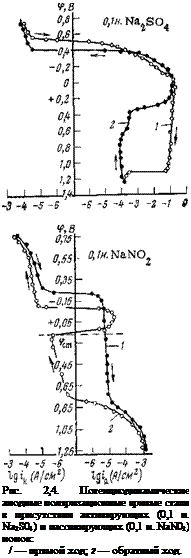
вация по механизму ускорения катодной реакции (см. ниже). Можно ли на практике осуществить защиту металлов в кислых электролитах с помощью нитрита натрия, имея в виду его постепенное восстановление, сказать трудно; требуются дополнительные исследования О наличии принципиально различных свойств у пассивирующих слоев, возникающих на стали в ингибированных и неингибированных электролитах, можно судить и по потен — циодинамичеоким анодным поляризационным кривым, изображенным на рис. 2.4. При снятии прямого и обратного хода анодной поляризационной кривой в сульфате и нитрите на кривой обнаруживаются гистерезисные петли, указывающие на возникновение на электроде в обоих электролитах пассивирующих слоев фазового или адсорбционного характера. В присутствии нитрита натрия пленки обладают более высокими пассивирующими свойствами. Об этом, в частности, свидетельствует тот факт, что после анодной поляризации стали в растворе нитрита натрия на анодной поляризационной кривой в широкой области потенциалов регистрируются катодные токи. Их появление связано с тем, что из-за низкой ионной проводимости пассивирующих пленок плотность анодного тока, необходимая для поддержания металла в пассивном состоянии, намного ниже плотности катодного тока восстановления кислорода (восстановление нитрит-ионов при этих потенциалах, как было выше показано, исключается) .
 Заслуживает также внимания то обстоятельство, что если в сульфате анодное растворение начинается при потенциале ~—0,5 В, то в нитрите этот процесс начинается при более положительных значениях потенциала (~—0,15 В). Потенциал полной пассивации при относительно быстром изменении потенциала (80 мВ/мин) регистрируется только при обратном ходе поляризационной кривой, когда пассивирующая пленка на электроде уже сформировалась. Значения потенциалов полной пассивации, характеризующие пассивирующие свойства электролита, различны; в сульфате фп. п=~+0,4 В, а в нитрите +0,15 В. Характерно, что
Заслуживает также внимания то обстоятельство, что если в сульфате анодное растворение начинается при потенциале ~—0,5 В, то в нитрите этот процесс начинается при более положительных значениях потенциала (~—0,15 В). Потенциал полной пассивации при относительно быстром изменении потенциала (80 мВ/мин) регистрируется только при обратном ходе поляризационной кривой, когда пассивирующая пленка на электроде уже сформировалась. Значения потенциалов полной пассивации, характеризующие пассивирующие свойства электролита, различны; в сульфате фп. п=~+0,4 В, а в нитрите +0,15 В. Характерно, что
При положительных потенциалах сульфат-ионы хорошо адсорбируются на хроме, вытесняя с поверхности ионы хлора. Аналогичным же образом действуют на стали ингибирующие ионы (N02, ОН-, CrOf-), которые, в свою очередь, вытесняют
|
прямой и обратный ход в сульфате при потенциалах более отрицательных, чем +0,25 В, совпадают, т. е. анодно образованные пассивирующие слои легко восстанавливаются при смещении потенциала в отрицательную сторону. Сохраняются они на поверхности только при потенциалах более положительных, чем +0,25 В. В нитрите натрия пассивирующие слои сохраняются на поверхности и при более отрицательных потенциалах, а ток пассивации на несколько порядков ниже, чем в сульфате. Из всего изложенного можно сделать вывод, что нитрит-ион значительно облегчает анодную пассивацию стального электрода. Необходимо, однако, иметь в виду, что пассивирующие свойства анионов сильно зависят от присутствия в растворе активирующих ионов и их соотношения; при преобладающей концентрации активирующих ионов (Cl” SO?" и NO3 для стали) пасси* вация электрода затрудняется. Такое поведение электрода, несомненно, связано с конкурирующей адсорбцией. Адсорбционная природа этих явлений была выше продемонстрирована на примере взаимного влияния сульфат — и гидроксил-ионов по отношению к хлорид-иону. |
 с поверхности сульфат-ионы, являющиеся агрессивными по отношению к стали. Требуемые для пассивации стали отношения концентраций активирующих и пассивирующих ионов определены (см. ниже).
с поверхности сульфат-ионы, являющиеся агрессивными по отношению к стали. Требуемые для пассивации стали отношения концентраций активирующих и пассивирующих ионов определены (см. ниже).
К классическим пассиваторам, сильно тормозящим анодную реакцию, относятся и хроматы. Однако в отличие от нитрита натрия они тормозят в некоторой степени и катодную реакцию, по
этому могут быть отнесены к смешанным ингибиторам. Хроматы и бихроматы, несмотря на то что относятся к окислителям и, кажется, могли бы увеличить эффективность катодного процесса, не проявляют этих свойств в нейтральных электролитах. На рис. 2,5 представлены гальваностатиче — екие катодные поляризационные кривые, полученные в буферном растворе (pH» »9), содержащем различные концентрации бихромата калия.
![]() Как нетрудно заметить, обычная катодная кривая, характерная для реакции восстановления с тремя областями (ионизации кислорода, диффузии кислорода и разряда ионов водорода), наблюдается лишь в электролите, не содержащем ингибитора. Все остальные кривые с самого начала круто поднимаются вверх, что свидетельствует о каких-то затруднениях, возникающих при протекании катодного процесса.
Как нетрудно заметить, обычная катодная кривая, характерная для реакции восстановления с тремя областями (ионизации кислорода, диффузии кислорода и разряда ионов водорода), наблюдается лишь в электролите, не содержащем ингибитора. Все остальные кривые с самого начала круто поднимаются вверх, что свидетельствует о каких-то затруднениях, возникающих при протекании катодного процесса.
Бихромат калия не только не восстанавливается при смещении потенциала от стационарного значения в отрицательную сторону на 0,3+-0,4 В, но и уменьшает в этой области потенциалов скорость восстановления кислорода. Восстановление ионов бихромата наступает лишь при потенциалах более отрицательных, чем —0,6ч—0,8 В, а не при тех значениях, которые можно было ожидать, исходя из окислительно-восстановительного потенциала реакции
Сг2027" -f 14Н+ + 6е~ +=± 2Сг3+ + 7Н20 (2,5)
Равновесный потенциал этой реакции фрн=о = +1,33 В, однако протекает она, как видно из рис. 2,5, с большим перенапряжением.
Исследование процесса восстановления хромат-ионов, проведенное Лингейном и Колытофом на ртутном электроде [36], также показало, что восстановление протекает с большим перенапряжением. На катодных поляризационных кривых небуферированных растворов хлористого калия наблюдались четыре волны: при
—0,66; —0,76; —1,31 и —1,56 В. Можно полагать, что первая вол
на, наиболее важная для понимания процесса коррозии железа в присутствии хроматов, соответствует восстановлению ионов хромата по уравнению
СгО!~ + 4Н20 + Зе~ ——- >- Сг(ОН)з + 50Н" (2,6)
Анализ кривых, однако, указывает на то, что первая волна не соответствует восстановлению Сг®+ до Сг3+. Последние три волны по расчетам соответствуют реакциям
|
CrOl" + 4Н20 + Зё~ |
—» Сг(ОН)3 — f 50Н" |
(2,7) |
|
СЮ!- + 4Н„0 + 4е~ |
-> Сг(он)2 бон- |
(2,8) |
|
Сг0!- + 4Н20 + 6е" |
Сг + 80РГ |
(2,9) |
Потенциалы восстановления хромат-ионов по последней схеме лежат, однако, в области более отрицательных значений потенциалов по сравнению с теми, при которых происходит процесс коррозии железа в нейтральных средах.
Высокое перенапряжение процесса восстановления хроматов и бихроматов на ртути связывают с образованием на поверхности пленок из гидроокиси хрома или основного хромата, которые затрудняют процесс восстановления. Поэтому полное восстановление хромат-ионов даже до Сг3+ не начинается, пока потенциал не достигнет значения —0,76 В. Очевидно, что на твердых электродах, и в особенности на железном катоде, склонном к пассивации, в условиях, когда исходная поверхность катода не обновляется, пленки из гидроокиси хрома или основных хроматов будут более устойчивыми и возникнут гораздо легче, чем на капле ртути, живущей доли секунды. Все это должно привести к увеличению перенапряжения, необходимого для полного восстановления хромат — или бихромат-ионов на железном катоде. Кажущееся на первый взгляд противоречие между этим утверждением и обнаружением в некоторых случаях в защитной пленке ионов трехвалентного хрома объясняется следующим. По-видимому, в начальный момент погружения железного электрода в электролит происходит некоторое восстановление хромат-ионов. Однако как только на поверхности железа образуется пленка из гидратов окиси хрома и железа, дальнейшее восстановление хромат-ионов прекращается. Таким образом, такой сильный окислитель, как бихромат калия, не только не увеличивает эффективность катодного процесса в нейтральном электролите, а уменьшает ее.
Ингибирующие свойства хроматов заключаются не столько в замедлении реакции восстановления кислорода, сколько в их способности уменьшать скорость анодной реакции. На рис. 2,6 представлены потенциостатические кривые, полученные на стали в сульфатном растворе с различными хроматами [37]. Как видно, хроматы сильно уменьшают скорость анодной реакции ионизации металла. Пассивирующие свойства сильно зависят и от состава органического катиона. Это указывает на то, что последний участвует в процессе пассивации.
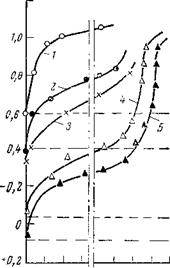
Сильные пассивирующие свойства бихромат-ионов выявляются и при гальваностатической анодной поляризации. Достаточно ввести в электролит 0,25—0,50 г/л бихромата калия, чтобы плотностью тока всего около 10 мкА/см2 сместить потенциал до +1,2-=—1-1,5 В (рис. 2, 7 а).
![]()

 При исследовании анодного поведения стали была обнаружена интересная особенность, свидетельствующая о возможности активации электрода малыми концентрациями бихромата калия и наглядно выявляющаяся при рассмотрении прямого и обратного хода поляризационных кривых (рис. 2, 76). Малые концентрации бихромата калия при поляризации от больших плотностей к малым активируют поверхность железа. В итоге потенциал железа приобретает более отрицательные значения по сравнению со значениями до поляризации. Эта разница зависит от концентрации бихромата калия и может достигнуть +0,4 В (0,5 г/л).
При исследовании анодного поведения стали была обнаружена интересная особенность, свидетельствующая о возможности активации электрода малыми концентрациями бихромата калия и наглядно выявляющаяся при рассмотрении прямого и обратного хода поляризационных кривых (рис. 2, 76). Малые концентрации бихромата калия при поляризации от больших плотностей к малым активируют поверхность железа. В итоге потенциал железа приобретает более отрицательные значения по сравнению со значениями до поляризации. Эта разница зависит от концентрации бихромата калия и может достигнуть +0,4 В (0,5 г/л).
Потенциал стали после анодной поляризации в растворе, содержащем 0,1 г/л бихромата калия, более отрицателен, чем в исходном электролите. Если сравнить скорости растворения стали при одном потенциале в той области, где это можно сделать, например при +0,25++0,5 В, то легко заметить, что скорость растворения в результате предварительной адсорбции небольших количеств бихромата калия увеличивается на 2—3 порядка. При больших концентрациях бихромата калия (1,5 г/л и выше) потенциал электрода по мере снижения плотности тока остается в пассивной области.
Таким образом, механизм действия хроматов обусловлен торможением скоростей обеих электрохимических реакций, причем преимущественно анодной. Поэтому по электрохимической классификации хроматы относятся к ингибиторам смешанного типа.
До сих пор рассматривались ингибиторы, защищающие металл от коррозии, главным образом благодаря замедлению кинетики анодной реакции, однако за последнее время было показано, что запассивировать металл можно в определенных условиях и за счет ускорения катодной реакции [38]. С помощью неорганических ингибиторов этого сделать нельзя.
|
Рис. 2,7. Активация стали малыми добавками бихромата калия в буферной смеси (состав см. рис. 2,5): а — прямой ход; б — обратный ход. |
Обычные неорганические окислители (O2, Na2Cr04, NaN02), как было показано выше, не восстанавливаются в нейтральных электролитах со сколько-нибудь заметной скоростью; токи восстановления их анионов при потенциале коррозии (—0,3н—0,4 В) не превышают нескольких десятков мкА/см2 (рис. 2,8, кривые 1—3). Поэтому за счет этих токов нельзя сместить потенциал металла до значений, при которых начинает формироваться пленка, способная запассивировать металл. Однако, как показали наши исследования, можно добиться исключительно высоких скоростей восстановления, например групп N02, если ввести их в состав органических соединений; при введении ЙОг-группы в бензольное кольцо, где она фактически нейтральна, скорость восстановления резко увеличивается. Еще большей скорости восстановления можно добиться, если дополнительно ввести в бензольное кольцо какой — либо электрофильный заместитель, уменьшающий электронную плотность на азоте (рис. 2,8, кривые 4—5).
Если в качестве электрофильных заместителей выбрать карбоксильную группу и вторую нитро-группу, то, применяя такой окислитель, можно добиться увеличения эффективности катодного процесса, а кроме того, защитить ряд цветных металлов. При восстановлении таких соединений можно получить плотности тока, достигающие 10—20 мА/см2.
В некоторых случаях и этих плотностей тока может не хватить Для пассивирования металла. Поэтому помимо большой скорости восстановления необходимо, чтобы в составе ингибитора были
У, В органические катионы или анио
![]()

 ны, которые хорошо адсорбируются поверхностью металла и покрывают значительную часть ее поверхности. В этих условиях облегчается достижение на непокрытых участках поверхности тех критических плотностей тока, которые необходимы для пассивирования. Весьма эффективными могут оказаться и анионы, образующие с металлом нерастворимые соединения.
ны, которые хорошо адсорбируются поверхностью металла и покрывают значительную часть ее поверхности. В этих условиях облегчается достижение на непокрытых участках поверхности тех критических плотностей тока, которые необходимы для пассивирования. Весьма эффективными могут оказаться и анионы, образующие с металлом нерастворимые соединения.
![]() Как видно, здесь реализуется принципиально новый путь создания ингибиторов, основанный не на традиционном принципе торможения электрохимических реакций, а на принципе увеличения эффективности катодного процесса, приводящий к смещению потенциала к значениям, при которых становится возможным формирование пассивирующего слоя.
Как видно, здесь реализуется принципиально новый путь создания ингибиторов, основанный не на традиционном принципе торможения электрохимических реакций, а на принципе увеличения эффективности катодного процесса, приводящий к смещению потенциала к значениям, при которых становится возможным формирование пассивирующего слоя.
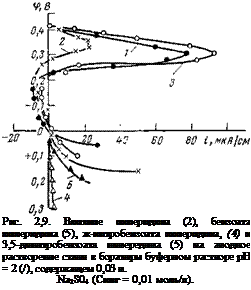
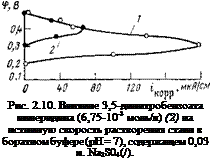
В правильности предложенного механизма можно убедиться при рассмотрении результатов потенциостатических исследований анодного процесса [39]. Еісли ввести в боратный буфер 0.01 моль/л пиперидина, пассивируемость системы резко возрастает: расширяется в значительной степени область пассивного состояния и уменьшаются токи пассивации. Такая же концентрация бензоата пиперидина эффекта не дает. Однако если ввести 0,01 моль/л нитробензоата пиперидина или 3,5-динитробензоата пиперидина, начальный потенциал системы смещается далеко за потенциал полной пассивации металла в боратном буфере (рис. 2,9).
Все это указывает на возможность формирования на железе пассивирующего окисла в присутствии этих соединений. Однако, поскольку в присутствии нитробензоатов на электроде должен протекать эффективный катодный процесс, обычные потенциоста — тические кривые в токовых координатах не могут дать полную информацию об анодном процессе. В связи с этим была изучена зависимость скорости растворения от потенциала по изменению массы.
Было обнаружено, что в присутствии нитробензоатов аминов наблюдается большая разница между токовыми показателями и гравиметрическими. Если оценить истинную скорость анодного
процесса по скорости растворения при одинаковых значениях потенциала (рис. 2,10), то становится ясным, что нитробензоаты аминов не влияют на анодный процесс (анодные кривые в. ингибированных и неингибировэнных электролитах совпадают) . Отсюда следует, что наблюдаемое смещение потенциала стали за потенциал пассивации является следствием увеличения эффективности катодного процесса. Аналогичным образом пассивируют нитробензоаты сплавы на железной основе и в отсутствие внешней анодной поляризации.
 Ценную информацию о механизме действия ингибиторов можно получить, используя метод химической пассивации[2] [40].
Ценную информацию о механизме действия ингибиторов можно получить, используя метод химической пассивации[2] [40].
Этот метод исследования кинетики растворения металлов был впервые применен авторами работы [41]. Было показано, что независимо от того, чем задается потенциал электроду (внешней анодной
поляризацией или окислителями), скорость растворения одинакова. Такая закономерность не всегда соблюдается. Очевидно, она может иметь место лишь в том случае, когда функции окислителя сводятся лишь к «навязыванию» металлу того или иного окислительно-восстановительного потенциала. Если же компоненты раствора химически адсорбируются на поверхности электрода, изменяется кинетика анодной реакции и потенциал уже не будет однозначно определять скорость растворения.
На рис. 2,11 представлена кривая зависимости скорости коррозии стали от потенциала, который задавался электроду с помощью ж-нитробензоата амина. Если сравнить эту кривую с анодной потенциостатической кривой, полученной методом внешней анодной поляризации (рис. 1,5), то легко заметить, что при внешнем общем сходстве они по кинетическим параметрам отличаются: потенциал пассивации в присутствии ингибитора намного отрицательнее потенциала пассивации, который наблюдается при внешней анодной поляризации; токи растворения при одинаковых потенциалах в присутствии ингибитора намного ниже.
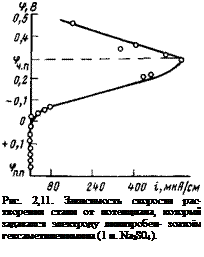 Зависимость скорости коррозии от потенциала при внутренней поляризации нитробензоатом амина такая же, как и при внешней анодной поляризации: вначале при смещении потенциала в положительную сторону скорость растворения увеличивается. После достижения определенного потенциала, который мы назвали потенциалом частичной пассивации <рч. п, скорость коррозии начинает резко падать и при достижении другого потенциала фп. п электрод переходит в пассивное состояние. Как видно, получается типичная для металла, склонного переходить в пассивное состояние, кривая с тремя участками: активного растворения, активно-пассивного состояния и пассивного состояния.
Зависимость скорости коррозии от потенциала при внутренней поляризации нитробензоатом амина такая же, как и при внешней анодной поляризации: вначале при смещении потенциала в положительную сторону скорость растворения увеличивается. После достижения определенного потенциала, который мы назвали потенциалом частичной пассивации <рч. п, скорость коррозии начинает резко падать и при достижении другого потенциала фп. п электрод переходит в пассивное состояние. Как видно, получается типичная для металла, склонного переходить в пассивное состояние, кривая с тремя участками: активного растворения, активно-пассивного состояния и пассивного состояния.
Анализ экспериментального материала показывает, что в области активного растворения смещение потенциала в положительную сторону обусловлено восстановлением нитробензоата амина и увеличением благодаря этому эффективности катодного процесса. На границе активно-пассивного состояния потенциал смещается в положительном направлении преимущественно благодаря торможению анодной реакции; устанавливающееся в пассивной области значение потенциала определяется процессом окисления металла кислородом воды, участвующим в формировании пассивирующего слоя.
 21 августа, 2015
21 августа, 2015  admin
admin 
 Опубликовано в рубрике
Опубликовано в рубрике 