Как было показано выше, у исследователей нет единой точки зрения на молекулярный механизм действия ингибиторов. Квантовохимические расчеты могут помочь понять свойства ингибиторов
Исходными числовыми данными при расчете являлись координаты атомов, входящих в рассматриваемую молекулярную систему, и потенциалы ионизации всех базисных орбиталей рассматриваемых атомов. Координаты определялись по известным межатомным расстояниям и углам между связями Сг—О в хромат-ионе. В свободном состоянии CrOl" несет заряд, равный двум электронам.
 |
 |
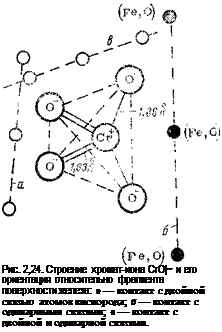
В литературе недостаточно сведений об ориентации хроматиона на поверхности металла при адсорбции. Поэтому анализировали несколько возможных положений хромат-иона относительно фрагмента поверхности (см. рис. 2,24, положения а, б, в). Преимущество отдавали конфигурациям, в которых хромат-ион расположен к поверхности незанятыми связями; эту модель рассматривали особенно подробно.
Поверхностные фрагменты выбирали таким образом, чтобы качественно можно было проследить за особенностями поведения хромат-ионов при различных положениях на поверхности железа или его окислов и определить изменение зарядов на атомах кислорода и хрома. Модель поверхности представлена несколькими сочетаниями атомов железа и кислорода: 3Fe, 2Fe-f-0; Fe-f-20; Fe-i-40. Эти сочетания моделируют возможные условия адсорбции на восстановленном и окисленном железе. Все атомы металла лежат в одной плоскости по отношению к хромат-иону. Он ориен-
тируется поочередно со стороны различных связей тетраэдра: а) 1,63 А и 1,63 А; б) 1,86 А и 1,86 А; в) 1,86 А и 1,63 А. Длины связей брались из литературных данных: Fe—Fe— 2,45 А,
Fe—О — 1,65 А; Сг=0 — 1,86 А и Сг—О — 1,63 А.
Вычисления проводили методом МО ЛКАО без самосогласования. При расчете для атомов железа и хрома учитывали атомные 4s-, 4/7-, Зй-орбитали, для атома кислорода 2s-, 2/7-орбитали.
Потенциалы ионизации атомов принимали равными: для железа— 4s=—8,469 В; 4/7=—5,072 В; Ы=~ 12,164 В; для (Кислорода — 2s =—32,364 В; 2/7=—15,872 В; для хрома — 4s =
=—6,597 В; 4/7=—3,559 В; 3d=—7,179 В. Вычисления проводили по модифицированной программе с учетом атомных Зй-орбиталей. Использовали электронно-вычислительную машину М222 ВЦ ИФХАНа.
Следует подчеркнуть, что в анионе СЮ?^ атом хрома блокирован со всех сторон атомами кислорода, поэтому взаимодействие с поверхностью металла недиссоциированного иона СгО?“ возможно только через атомы кислорода, и маловероятно, чтобы модель Картледжа, предусматривающая взаимодействие центрального атома хрома с электронами защищаемого металла, могла быть реализована.
В табл. 2,3 приведены полученные на ЭВМ данные о заряде на атомах свободного хромат-иона, т. е. иона, не испытывающего никаких возмущений со стороны металла, а также хромат-иона, возмущенного фрагментом поверхности; в табл. 2,4 — данные о заряде на связях.
Анализ изменений зарядов на атомах и на связях позволяет получить информацию о поведении хромат-иона на поверхности
|
Таблица 2,3. Заряды, по Малликену, на атомах СгО| в свободном и адсорбированном на поверхности Fe и FeO состояниях
|
металла и его окионой пленке. Как видно из табл. 2,3, <в свободном анионе СгО?- заряд на атоме хрома намного меньше шести, т. е. заряд оттянут на атомы кислорода. Из анализа зарядов на атомах можно сделать вывод, что в зависимости от того, как ориентирован тетраэдр СгО!" на поверхности железа, атом хрома может либо приобрести заряд, либо потерять заряд, т. е. быть и донором, и акцептором. Это относится только к атому хрома. Бели же рассматривать хромат-ион в целом (сумма зарядов на атомах), то заряд на СгО*- становится в основном более отрицательным, что является прямым указанием на то, что хромат-ионы при взаимодействии с поверхностными фрагментами железа проявляют акцепторные свойства. Исключение составляет конфигурация 2Fe, .0, которая при взаимодействии с хромат-ионами создает значительные отрицательные заряды на связях Сг—О в тетраэдрах СгО|~, однако это соответствует разрыхляющим молекулярным орбиталям, т. е. положению, в котором система в целом является неустойчивой и возможна диссоциация иона.
Анализ зарядов на связях (см. табл. 2,4) позволяет сделать вывод о поляризации связей в хромат-ионе в адсорбированном состоянии (по сравнению с состоянием свободного хромат-иона). Отношение зарядов на связях Сг=Оі, бз и Сг—Oi. se в свободном хромат-ионе составляет 1,255 (см. табл. 2,4), что соответствует структуре СгО*", приведенной на рис. 2,24. В адсорбированном состоянии это отношение изменяется в зависимости от того, как ориентирован хромат-ион относительно фрагмента поверхности. Бели хромат-ион обращен к поверхности двойными связями, то
|
Таблица 2,4. Заряды, по Малликену, на связях в ионе СгО! в свободном и адсорбированном на поверхности Fe и FeO состояниях
|
это отношение уменьшается, а если одинарными — увеличивается. Поляризация связей хроматиона влечет за собой изменение химической активности на поверхности металла, которая увеличивается в первом случае и уменьшается іво втором. Этот результат показывает, что наиболее вероятное положение хромат-иона при адсорбции такое, при котором контакт с поверхностью достигается за счет свободных валентных связей (см. рис. 2,246).
 Квантовохимические расчеты свойств хромат-ионов в адсорбированном состоянии показывают, таким образом, что хромат-ионы выступают и качестве акцепторов электронов по отношению к железу. Взаимодействие с железом происходит посредством двух атомов кислорода аниона СгО?-; при этом изменяется химическая активность хромат-ионов.
Квантовохимические расчеты свойств хромат-ионов в адсорбированном состоянии показывают, таким образом, что хромат-ионы выступают и качестве акцепторов электронов по отношению к железу. Взаимодействие с железом происходит посредством двух атомов кислорода аниона СгО?-; при этом изменяется химическая активность хромат-ионов.
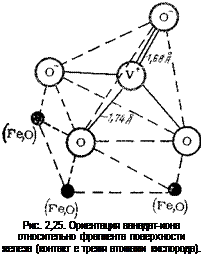
Аналогичным образом было изучено адсорбционное состояние ванадат-ионов. Анион рассматривался в свободном состоянии и при взаимодействии с фрагментами поверхности железа: а) со
стороны связей 1,74 А, 1,74 А и 1,74 А; б) со стороны связей 1,74 А, 1,74 А и 1,68 А (рис. 2,25). Анализ результатов табл. 2,5 показал, что возмущение любого из рассматриваемых фрагментов не изменяет знаки зарядов на атомах VO?- . Это означает, что в адсорбированном состоянии заряд на центральном ионе металла остается положительным, а отрицательный заряд оттянут к атомам кислорода на периферию аниона. Сумма зарядов на атомах кислорода в адсорбированном состоянии возрастает по сравнению с зарядом свободного радикала. Это свидетельствует о том, что взаимодействие анионов подобного типа с металлом происходит посредством кислородных атомов.
Изменение заряда на центральном атоме ванадия возмущенного аниона VO!” незначительно, в то время как суммарный заряд на атомах кислорода изменяется сильно. Это указывает на то, что в адсорбированном состоянии ванадат-ион проявляет акцепторные свойства в основном посредством атомов кислорода. Это противоречит гипотезе о том, что электронное взаимодействие ингибиторов, имеющих общий анион типа №0’’с, с поверхностью металла происходит через центральный положительно заряженный атом металла. Адсорбция VO!" на фрагментах железа не приводит к значительному изменению парциальной заселенности, что также
свидетельствует об ограниченном участии центрального атома ванадия во взаимодействии с поверхностью железа.
Этим же методом изучались и алифатические амины. В отличие от других работ, в которых при расчетах учитывали лишь электронную структуру амина в свободном равновесном состоянии, мы учитывали электронную структуру в адсорбированном состоянии, так как эти состояния могут сильно отличаться друг от друга. Рассматривая ингибитор в адсорбированном состоянии, можно получить сведения о механизме защиты.
Мы исследовали электронную структуру (величину зарядов на атомах и связях) модели поверхностного комплекса металла с аминами (этил амином, диэтиламином, триэтиламином), для сравнения брали аммиак. Рассматриваемые комплексы алифатических аминов с железом близки по геометрической структуре (в каждой молекуле атом азота имеет по одной неподеленной паре электронов) и представляются совокупностью только молекулярных 0-орбиталей. Межатомные расстояния амина, входящего в комплекс, для расчета принимали равными равновесному состоянию между ядрами в свободном амине. Расстояние между атомом железа и атомом азота принимали равным сумме металлического радиуса железа и ковалентного радиуса атома азота (для железа в кубической объемно-центрированной решетке г—1,231 А, а для азота г=0,69 А).
Большинство исследователей сходится на том, что адсорбция аминов на окислах и металлах происходит за счет неподеленной пары электронов атома азота, поэтому в исследуемой модели комплекса атом железа был помещен на одной оси с атомом азота. В одной из наших работ было установлено, что между логарифмом защитной концентрации и основностью алифатических аминов рАа имеется следующее соотношение:
lg сзащ = -2,28 + (3 (11,0 — р/Са) (2,20)
|
Таблица 2,5. Заряды, по Малликену, на атомах VO|“ в свободном и адсорбированном на поверхности Fe и FeO состояниях.
|
|
Таблица 2,6. Заряды на атомах свободного амина и амина в комплексе с железом
|
Так как рК& является мерой основности амина, которая, в свою очередь, зависит от заряда на атоме азота, создаваемого в основном неподеленной парой электронов, можно ожидать корреляции между зарядом атома азота и величиной обратной защитной концентрации. Сопоставление разности зарядов на атоме азота, входящего в комплекс, и на атоме азота свободного амина с величиной логарифма обратной защитной концентрации ингибитора показало, что эти зависимости удовлетворительно коррелируют между собой.
Результаты квантовохимического расчета изменения заряда атомов в комплексах по сравнению с зарядами свободных молекул, полученных на ЭВМ, представлены в табл. 2,6.
Из данных табл. 2,6 видно, что электронная структура молекул ингибитора в свободном состоянии значительно отличается от структуры в адсорбированном состоянии. Изменение заряда атома азота в молекуле свободного амина по сравнению с зарядом в комплексе свидетельствует о том, что в комплексе заряд перераспределяется на атом железа, что соответствует донорно-акцепторной связи, в которой амин в отличие от хромат — и ванадат-ионов является донором электронов. Этот вывод подтверждается и экспериментально по изменению контактной разности потенциалов при адсорбции аминов на железе (табл. 2,7).
 22 августа, 2015
22 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 