Если два металла с разными работами выхода электронов <pt и ср2 контактируют друг с другом, то на границе их соприкосновения с атмосферой (или вакуумом) возникает разность потенциалов Ек=е-(ф2—фі), называемая контактной разностью потенциалов (КРП)[3]. Работа выхода ф представляет собой работу, которую надо затратить, чтобы перенести электрон из металла в вакуум на расстояние 10-3~10-5 см. Если металл не имеет избыточного заряда, то
ф = — И — = zel — Р = — (dG/dn)PtT
где [X, jx—электрохимический и химический потенциалы электронов; ze — заряд электрона; % — поверхностный электростатический потенциал металла, представляющий собой скачок потенциала на границе раздела М —вакуум; б —энергия Гиббса; п — число электронов.
Изменение ф металла при адсорбции определяется изменением %. Второе слагаемое р определяется объемными свойствами металла и при адсорбции не изменяется.
Имеется много методов определения КРП, однако наиболее приемлемым является конденсаторный метод Кельвина. После его усовершенствования Зисманом он широко применялся в исследованиях физико-химических процессов, протекающих на поверхности металлов.
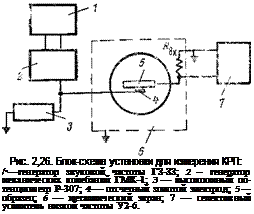
В этом методе исследуемая поверхность вместе с электродом сравнения образует конденсатор, разность потенциалов на обкладке которого (или КРП), как указывалось выше, численно равна разности работ выхода электронов из обкладок Ук. Для измерений этой разности одна из пластин (обычно электрод сравнения) периодически колеблется, изменяя тем самым емкость конденсатора С. Вследствие этого в цепи течет ток I=VKdCldt, пропорциональный Ук. Ток / весьма мал, и на практике обычно усиливают падение напряжения AU (AU ~ 10~5-М0-3 В), возникающее на большом входном сопротивлении Rbx усилителя (AU=RBXI). Так как выходной сигнал зависит кроме Ук от ряда технических факторов (например, от А С/С, величины усиления и т. д.), для определения Ук лучше использовать метод компенсации. Для этого в схему вводится посторонний источник э. д. с. Ув. Тогда при Ук=—Ув, AU—0 и сигнал на выходе усилителя минимален, а показания потенциометра равны Ук с обратным знаком.
Так как метод чувствителен к помехам, ячейка с исследуемым и отсчетным электродом и первый каскад усилителя защищались заземленным металлическим экраном. Чувствительность установки определения КРП (при соблюдении ряда условий) достигает 1 мВ. Блок-схема установки для измерения КРП представлена на рис. 2,26.
Для того чтобы исключить возможную ошибку от адсорбции ингибиторов на отсчетном электроде (пластинка из золота), измерения КРП производили в процессе десорбции ингибитора, адсорбированного ранее в замкнутом объеме. Постоянство работы выхода отсчетногоэлектрода периодически контролировали, заменяя исследуемый образец на эталонную пластину (никель), и при необходимости вводили поправку. При изучении контактных ингибиторов в этом необходимости не было. Для иллюстрации возможностей этого метода приведем некоторые результаты, полученные
при адсорбции летучих ингибиторов на железе из газовой фазы (табл. 2,7).
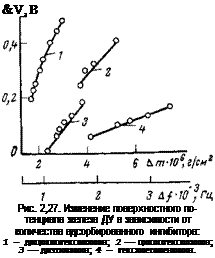
 Результаты исследования показывают, что изученные ингибиторы являются донорами электронов, поскольку при их адсорбции работа выхода электронов уменьшается на 0,14-0,7 В (поверхностный потенциал равен изменению работы выхода электронов с обратным знаком). Все они при адсорбции на поверхности железа заряжаются положительно. Адсорбционный положительный заряд, локализованный на молекулах ингибитора, компенсируется отрицательным зарядом, расположенным на внутренней границе окисла Fe—FeOx. Изменение поверхностного потенциала Ах или работы выхода электрона Д<р=—АУк(эВ) прямо пропорционально количеству адсорбированного на электроде вещества (рис. 2,27). Приближенные расчеты показывают, что напряженность электрического поля в окисле при этом достигает л?106 В/ем. Она, несомненно, в состоянии, с учетом направления поля, затормозить транспорт катионов через пленку.
Результаты исследования показывают, что изученные ингибиторы являются донорами электронов, поскольку при их адсорбции работа выхода электронов уменьшается на 0,14-0,7 В (поверхностный потенциал равен изменению работы выхода электронов с обратным знаком). Все они при адсорбции на поверхности железа заряжаются положительно. Адсорбционный положительный заряд, локализованный на молекулах ингибитора, компенсируется отрицательным зарядом, расположенным на внутренней границе окисла Fe—FeOx. Изменение поверхностного потенциала Ах или работы выхода электрона Д<р=—АУк(эВ) прямо пропорционально количеству адсорбированного на электроде вещества (рис. 2,27). Приближенные расчеты показывают, что напряженность электрического поля в окисле при этом достигает л?106 В/ем. Она, несомненно, в состоянии, с учетом направления поля, затормозить транспорт катионов через пленку.
Другим следствием адсорбции ингибиторов является изменение способности поверхности стали адсорбировать воду. На электроде, на котором предварительно были адсорбированы ингибиторы,
|
Таблица 2,7. Изменение поверхностного потенциала, напряженность поля в окисле и электронно-химическая эффективность молекул ингибиторов
Плотность А N измеряется количеством молекул, адсорбированных 1 см2 поверхности. * |
![]() сильно падает количество адсорбированной воды. При этом область полимолекулярной конденсации не наступает вплоть до давлений 0,9 р/р„
сильно падает количество адсорбированной воды. При этом область полимолекулярной конденсации не наступает вплоть до давлений 0,9 р/р„
 Максимальное количество воды, которое при этом адсорбируется, не превышает в присутствии бензоатов монослоя.
Максимальное количество воды, которое при этом адсорбируется, не превышает в присутствии бензоатов монослоя.
Поскольку анодная реакция включает стадию гидратации ионов металла, это не может не сказаться на скорости коррозии, которая, как показали эксперименты, полностью прекращается. При этом количество адсорбиравэнного из газовой фазы ингибитора (бензоата, нитробензоата) может оказаться недостаточным даже для образования одного моноатомного слоя[4].
Незначительная степень заполнения поверхности ингибиторами зафиксирована и при адсорбции из электролитов. В частности, при исследовании адсорбции пертехнат-ионов на железе методом радиоактивных индикаторов в одной из наших работ [50] было показано, что на 1 см2 железа адсорбируется «4-Ю13 ионов ТеС>4, что также недостаточно для монослойного заполнения. По данным Картледжа [48], степень покрытия поверхности железа технецием оказалась равной 3-Ю12 атомов на 1 см2. Брашер и Стов [51], изучавшие адсорбцию хромат-ионов на железе, установили, что количество адсорбирующегося хрома составляет 5,2 -1015 атомов на 1 см2. По данным Пауэрса и Хаккермана [52], количество адсорбированного хрома оказалось равным 5,2 • 1013 атомов на 1 см2.
Ясно, что такая незначительная степень заполнения поверхности исключает возможность интерпретации защиты, исходя из механизма экранирующего действия. Наиболее вероятным является изменение энергетического состояния системы металл — электролит, которое может быть обусловлено либо изменением строения двойного электрического слоя, например за счет положительного значения фі-потенциала при адсорбции органических катионов, либо за счет изменения свойств поверхностных атомов. Возможно, что адсорбция поверхностно-активных ионов или молекул блокирует наиболее активные центры поверхности, например участки дефектной структуры, которые обычно и являются наиболее
реакционно-способными. В таких условиях вовсе не требуется, чтобы степень покрытия поверхности составляла монослой.
Что касается характера адсорбции, то экспериментальные данные указывают на то, что под влиянием ингибиторов коррозии поверхность металла претерпевает необратимые изменения. В этом плане интересные результаты были недавно получены в одной из наших работ [53]. Исследуя изменение КРП после извлечения электрода из ингибированных электролитов, промывки его в дистиллированной воде и высушивания, обнаружили, что пассивация металла электрода неорганическими ингибиторами приводит к стойким изменениям электронных свойств поверхности металла. Металл обладает как бы эффектом «памяти», сохраняя те изменения, которые вызвал ингибитор. Сдвиг контактного потенциала ДУК указывает на увеличение работы выхода электрона Дф, что соответствует сдвигу электродного потенциала в положительную сторону (табл. 2,8).
Как видно, изменения контактного и электродного потенциалов противоположны по знаку и близки по значениям для многих ингибиторов. Это означает, что изменение обоих параметров (Ук и фэл) определяется одними и теми же физическими процессами, а состояние поверхности, обеспечивающее устойчивую пассивность, существует вне раствора. Изменение ДУК может быть лишь следствием изменения скачка потенциала в пассивирующей пленке окисла.
|
Таблица 2,8. Изменение контактных AVK и электродных Дфэ потенциалов стали в результате пассивации в растворах неорганических ингибиторов
|
|
Рис. 2,28. Зависимость плотности тока коррозии стали (корр (/) и контактного потенциала ДРК (2 и 3) от электрохимического потенциала электрода <рЭл. (Кривые 1 и 2 — 0,1 н. Na2S04; 3—1 н. Na2S04; <=6 ч. Для сравнения кривых экспериментальные точки пронумерованы.) |
Можно думать, что мы имеем дело с относительно замороженным распределением дефектов в пределах весьма тонкого слоя пассивирующего окисла, который формируется под воздействием ингибитора, кислорода и воды. При этом отрицательные заряды локализуются преимущественно у внешней границы окисла, а положительные— вблизи внутренней границы, поскольку работа выхода при пассивировании растет. Весьма вероятно, что у границы М—МО пленка содержит избыток положительных ионов металла, а вблизи границы МО — раствор (воздух) — избыток отрицательных ионов кислорода (гидроксила). Это согласуется с развиваемыми представлениями об окислении металлов[5].
Возникновение скачка потенциала в окисле происходит, вероятно, по следующему механизму: при специфической адсорбции исследованных ингибиторов с общим анионом типа МОу~ на поверхности окисленных металлов с глубокими незаполненными cf-орбиталями электроны аниона затягиваются в решетку окисла[6]
и, в предельном случае, происходит полный перенос отрицательного заряда в металл без последующего распада аниона. Суммарное поле возникающих поверхностных зарядов приводит к перераспределению заряда в воздушно-окисленной пленке, как это наблюдается по измерению КРП, в результате чего металл переходит в пассивное состояние при весьма малых токах восстановления.
Таким образом, благодаря специфической адсорбции неорганических ингибиторов пассивация, как уже указывалось, может быть достигнута без восстановления самих ингибиторов. Обнаруженный эффект «памяти» у стали после воздействия ингибиторов указывает на возникновение электрического поля в окисле. Подтверждением выдвигаемого механизма могут служить данные по электрохимической пассивации стали с помощью внешней анодной поляризации с одновременным изменением КРП после извлечения электрода из электролита. Было обнаружено, что при поляризации стали в интервале потенциалов от —0,4 до +0,55 В кривая фэл=/(ЛКк) внешне сходна с обычной потенциостатической кривой срэл==/ О’корр) > где /корр — плотность тока коррозии, определенная по потерям массы (рис. 2,28).
Видно, что сдвиг потенциала в сторону положительных значений в активной области сопровождается увеличением работы выхода на ^400 мВ, в активно-пассивной области работа выхода падает и по достижении потенциала полной пассивации она достигает минимального значения, но все же остается на 110 мВ выше работы выхода воздушно-окисленной поверхности. Это значение совпадает с изменением работы выхода, зарегистрированным для электродов, запассивированных применением защитных концентраций ингибиторов (см. табл. 2,8).
Уменьшение работы выхода, наблюдаемое после достижения тока пассивации, обусловлено, по-видимому, появлением положительного объемного заряда, тормозящего движение катионов через пленку в раствор. Когда величина объемного заряда становится столь существенной, что ионный ток через пленку практически прекращается, наступает пассивное состояние. Поскольку установившееся значение ДКк весьма стабильно вне раствора (электрод «запомнил» поляризацию и релаксацию VK становится заметной лишь через несколько суток), имеются основания считать, что объемный заряд прочно локализован в пленке. Дальнейшее смещение электродного потенциала в сторону положительных значений даже на такое большое значение, как один вольт, не приводит к изменению 1+ (см. кривую 3 на рис. 2,28)[7], что также указывает на достаточную электрическую прочность структуры в пленке окисла, обеспечивающей пассивность.
 23 августа, 2015
23 августа, 2015  admin
admin 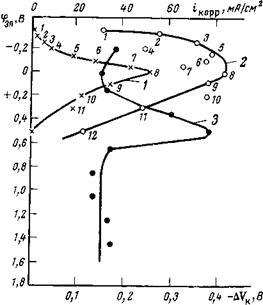
 Опубликовано в рубрике
Опубликовано в рубрике 