Титан часто подвергается травлению как для снятия альфиро — ванного слоя, так и для глубокого травления (химическое фрезерование). Ввиду того что титановые сплавы склонны к наводо — роживанию, при их травлении стараются применять азотную и фтористоводородную кислоты, ненаводороживающие титан (основным катодным процессом в азотной кислоте является не реакция разряда ионов водорода, а реакция восстановления азотной кислоты)[12]. Однако в некоторых случаях для непродолжительного травления, а также в ряде химических производств титан и его сплавы находятся в контакте с серной и соляной кислотами. Поэтому изыскание ингибиторов коррозии для титана представляет определенный интерес.
Защитные свойства азотсодержащих органических веществ по отношению к титановому сплаву ОТ4 в соляной кислоте были изучены в работе [136]. Ингибирующий эффект при комнатной температуре в 3-=-Ю н. НС1 обнаруживают л-динитробензол, купфер — рон и пикриновая кислота (у=4-^840). С ростом температуры защитные свойства соединений, за исключением пикриновой кислоты, заметно падают. Пикриновая кислота сохраняет свои защитные свойства по отношению к сплаву ОТ4 в широком интервале температур.
В серной кислоте (5-І-10 н.) эти соединения также ингибируют коррозионный процесс, однако несколько в меньшей степени, чем в соляной кислоте. Пикриновая кислота и в данном случае обнаруживает наиболее высокие защитные свойства. С повышением температуры ингибирующий эффект падает. Защитные свойства ингибиторов объясняются их высокими окислительными свойствами, способствующими пассивации сплава. Из двух ингибиторов,, отличающихся высокими ингибирующими свойствами по отношению к титановым сплавам, следует упомянуть /г-нитроформани — лид, динитробензойные кислоты, ц-нитрозодиметиланилин, хлорангидрид тринитробензойной кислоты, ft-нитрозодифениламин,, тринитротолуол (табл. 6,19). Как видно из данных этой таблицы, некоторые ингибиторы, в частности нитрозодиметиланилин, оказались эффективными и при высоких температурах.
Влияние на коррозию титана (ВТ-1) в 5 н. H2SO4 смесей катионоактивных веществ [пиридина, акридина, о-фенантролина, це — тилпиридинийхлорида и параалкилбензилпиридинийхлорида (ка — тапин А)] с анионоактивными добавками (хлоридом, бромидом, иодидом, роданидом калия, тиокарбамидом и калиевой солью бензолісульфокислотьі) исследовал Брынза с сотр. [137]. Анионоактивные добавки сами слабо ингибируют коррозию титана в серной кислоте. В связи с возникновением отрицательного адсорбци-
|
Та блина 6,19. Защитный эффект ингибиторов по отношению к титановому сплаву ОТ4 в НС1 (сИНг = 3 ммоль/л)
|
онного потенциала они ускоряют разряд ионов гидроксония и этим самым о-слабляют эффект, возникающий из-за покрытия электрода анионами (эффект блокирования). Однако в присутствии органических катионов, в частности Каталина, они усиливают защитные свойства катионоактивных веществ. Эффект зависит от концентрации анионов и (Проходит через максимум. По своей активности, т. е. способности вы
 зывать максимальную защиту при минимальной концентрации, анионоактивные вещества располагаются в следующий ряд:
зывать максимальную защиту при минимальной концентрации, анионоактивные вещества располагаются в следующий ряд:
KCNS > КІ > (NH2)2CS > C6H5S03K > KBr > ксі
Механизм действия анионоактивных веществ авторы связывают с тем, что адсорбированные анионы создают соединительные мостики между атомами металла — и органическими катионами.
В работе Андреевой и Яковлевой [138] было показано, что ингибирующими свойствами по отношению к сплаву ВТ-1 в соляной и серной кислотах обладает азотная кислота и молекулярный хлор. Так, в 18—20%-ном НС1 при 90 °С коррозия сплава ВТ-1 снижается с 28,6 до 0,45-f-0,55 г/(м2-ч) при барботировании хлора и до 0,220 г/(м2-ч) при введении 0,14 моль/л HN03, в 40%-ной H2SO4 — с 87,1 до 0,56 и 0,223 г/(м2-ч) соответственно. В концентрированных растворах соляной (34%) и серной (60—75%) кислот эффективность этих же ингибиторов, в особенности при высоких температурах, падает.
Пассивирующие свойства азотной кислоты объясняются авторами тем, что образующаяся при восстановлении азотной кислоты двуокись азота окисляет ионы трехвалентного титана
Ti3+ + Ш2 ——— ► Ті4+ + N07
Ионы Ті4+ обладают пассивирующими свойствами.
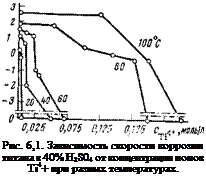
На рис. 6,1 показано, как влияют добавки ионов Ті4+ на скорость коррозии титана в 40%-ной H2S04. Как видно, при умеренных температурах требуются небольшие до башта ионов Ті4+, чтобы полностью подавить коррозионный процесс. При более высоких температурах (80—100 °С) необходимая концентрация ингибирующих ионов растет, однако она остается еще на невысоком уровне (0,25 моль/л). Считают, что коррозионная стойкость титана определяется стабильностью его защитной пленки, состоящей из дву
окиси титана. Увеличение в растворе концентрации ионов Ті4_ь сдвигает равновесие реакции растворения ТІО2
ТЮ2 + 2H2S04 Ti(S04)2 + 2Н20
ИЛИ
ТЮ2 + 4Н+ Ti4+ + 2Н20
влево и этим самым предотвращает растворение окисной пленки.
Имеются также указания на то, что пассивирующими свойствами обладает титанил-ион ТЮ2+, который возникает в растворе (благодаря сильному сродству Ті4+ к кислороду) по реакции
ТЮ2 + H2S04 ч=г=>: TiOS04 + Н20
или
Ті02 + 2Н+ ТЮ2+ + Н20
 1 сентября, 2015
1 сентября, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 