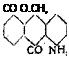
1. Бета (/5)-сульфокислотЫ антрахинона.’1 А. 2-МОНОСУЛЬФОКИСЛОТА И ПРОИЗВОДНЫЕ. Для получения 2-моносульфокис-
со
чистый 99,5 — 99,8%-ный антрахинон сульфируется приблизительно однократным количеством олеума с содержанием 26 — 30% Свободного ангидрида в присутствии 0,5 — 1% поваренной овли.
Операция ведется в железных аппаратах, снабженных рубашкой (для подогревания паром и охлаждения водой) и мешалкой. Антрахинон замешивают сначала с 20%-ным олеумом, с последующим добавлением нужного по расчету количества 38%-ной дым. серной кислоты. В конце реакции, продолжающейся от 5 до 6 час., температуру поднимают до 125—140°. По охлаждении до 110° масса выдавливается в воду. Отделение не вошедшего в реакцию антрахинона, так называемого обратного антрахинона в количестве приблизительно 50%, ведется посредством фильтрпресса с деревянными рамами, с приспособлением для промывки. Полотна — нитробязь или верблюжье сукно. Можно фильтровать и на нуче с кислотоупорными пористыми плитками. Обратный антрахинон перед повторным сульфированием должен быть отварен в автоклаве с едким натром и гипохлоритом [в маточных растворах некоторое количество серебристой соли и 2-оксиант- рахинона]. В раствор в виде сульфосолей переходят в круглых цифрах, считая на сульфированный антрахинон, 80% 2-моносульфокислоты и 20% смеси 2, 6-й 2, 7-дисульфокислот. Выделение так называемой серебристой соли по [немецки „Silbersalz" дословно—серебряная соль, названная так вследствие серебристого блеска ее кристаллических чешуек, мы предпочитаем называть это соединение „серебристой солью", как представляющее собой натриевую, а не серебряную соль данной сульфокислоты], происходит при концентрации кислого раствора [освинцованные выпарительные баки, свинцовые закрытые змеевики, освинцованные мешалки] до 20—22°Б, с постепенным добавлением некоторого избытка сульфата натрия. Фильтрование через фильтрпресс с деревянными рамами и приспособлением для промывки. Промывка до нейтральной реакции раствором сульфата натрия. Содержание промытой мокрой серебристой соли после продувки воздухом равняется 50 — 60%, считая на ализарин.
|
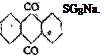 |
а) Ализарин;
б) 2-хлорантрахинон;
в) 1,4-дихлор — 6-сульфокислота;
г) 1-нитро-6-сульфокислота;
д) 2-оксиантрахинон —* 1-хлор-2-оксиантрахинон;
е) 2-аминоантрахинон —* бензатронхинолин.
шими выходами согласно герм. пат. Фр. Байера №205195, Фр. 9,673.
1 часть серебристой соли растворяется в 30 частях воды, затем вносят 3 части соляной кислоты — 20°Б, и при температуру кипения [с обратным холодильником] постепенно прибавляют раствор 2 .частей хлорновато-кислого натрия в 5 частях воды. Реакцию ведут до полной замены сульфогруппы на хлор. Выхода теоретические, качество продукта прекрасное. 2-хлорантрахинон может быть получен и синтетическим путем [см. ниже].
Служит для синтеза — индантрен оранжевого [1137] (эти поставленные за наименованием красителя в скобках цифры указывают на соответствующий номер английского справочника Кулер — Индекса красителей; индантрен бордо [1146] и др.
![]() so. hCC0 голу‘
so. hCC0 голу‘
со а
чается по методу Баденской фабрики [герм, пат; №21’б071 (1917 г.); Фр. 9,672] хлорированием серебристой соли в отсутствий водб [крепкая серная кислота, олеум, иод, как передатчик].
При конденсации с метаниловокислым и уксуснокислым натрцем при 200° образуется а нтр а хин оно в ый с и н е — з ел е — ный [1082]. ,
![]()
![]() г) 1-н и тр о-6-е у л ьф о к и с л о та
г) 1-н и тр о-6-е у л ьф о к и с л о та
/*
Клаусом в 1882 г. [Вег. 15,1514; см. также Вег. 17,899] нитрованием серебристой соли.
Конденсацией с ароматическими аминами [Баденская фабрика герм. пат. №113011 (1899); Фр. 6,309], с последующим введением брома в положение [4] и заменой последнего ариламинным остатком. (Баденская фабрика, герм. пат. №151384 (1900); Фр. 7,221] Получается антрахи неновый’зеленый [1081].
|
|
|
|
|
|
ковым плавом серебристой соли согласно методу Фарбверке [герм. пат. № 106505; Фр. 5,275]. 15 частей серебристой соли сплавляются в автоклаве с 15 частями извести в 120 частях воды при температуре 170°, в течение 24—30 час. Плав вносится в 300 частей воды и осаждается соляной кислотой. Выход на 2-окси — антрахинон не превышает 70—75% теории [герм. пат. № 152175; Фр. 7,167]. .
СО CI
///он
Служит через 1-хлор-2-оксиантрахинон 1^
CQ
для синтеза желтого кубового красителя [1160] и др.
 е) 2-аминоантрахинон
е) 2-аминоантрахинон
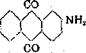
еще в 1869 г. [Вег. 12,1419, 567] нагреванием серебристой соли с водным аммиаком при 190°. Вследствие восстановительного действия образующегося в процессе реакции сернистокислого аммония, выхода на амино-производное не превышают 50% теории. В 1911 г. Баденской фабрикой был взят патент [№256515; Фр. 17,551] на способ работы с добавлением окислителей: перекись марганца, бихромат, мышьяковая кислота. Выхода на аминоантрахинон повышаются при этом и достигают 75 — 90%. Прекрасное действие оказывает и добавление хлористого бария, выводящего вредную сернистую кислоту из сферы реакции в виде трудно растворимого сульфита бария [М. Л. Фр. герм. пат. № 267212; Фр. 11,552 и № 277393 (1913); Фр. 11,553, а также №273810 (1913); Фр. 12,411].
250 частей серебристой соли, в виде 50%-ной пасты размешиваются с 156 частями 80%-ной перекиси марганца и 130 частями воды. Затем добавляют 180 частей 25%-ного аммиака и нагревают 24 часа при 200°. Образовавшийся 2-аминоантрахинон освобождается от избыточной перекиси марганца обработкой бисульфитом и сушится. Температура плавления приблизительно 300°; выхода почти количественные. •’
2-аминоантрахинон с прекрасными выходами получается и нагреванием с водным аммиаком 2-хлорантрахинонав присутствии медных солей. [Баденская ‘фабрика (1912), герм. пат. № 295624; Фр. 13,398].
250 частей 2-хлорантрахинона, 4000 частей 20%-ного аммиака и 8 частей медного купороса нагреваются в автоклаве при 200° в течение 36 час.
Метод дает возможность получения 2-вмнно — автрахинона синтетическим путем, исходя из хлорбензола.
Баденской же фабрикой герм. пат. № 288996 (1913); Фр. 12; 412 разработан метод получения 2-аминоантрахинона через мезодихлор — антрацен 2-сульфокислоту [герм. пат. т 260362 (1912), Фр. 11, 537].
100 частей 50%-ной пасты мезо-мезодихлорантрацен сульфокислото натрия нагреваются при 200° в течение 30 час, с 94 частями 80%-ной перекиси марганца и 600 частей 25%-ного аммиака. Обработка бисульфитом и т. д. ■ ‘
СС1 со
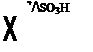 |
|
2-а м и н о а н[т р а х и н о н представляет собой полуфабрикат чрезвычайной важности, служит исходным продуктом для получения таких красителей как индантрен [1106], флавантрен [1118], алголовый красный Б [1115], антрацен коричневый [1120], гелцндоновый желтый [1138] и т. д.
При нагревании с глицерином и серной кислотой 2-аминоан — трахинон образует хинолиновое производное — бензантрон-
 |
||
/
индантренового темносинего БТ [1117].
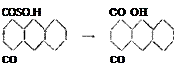
Б. 2, Є-ДР, СУЛЬФОКИСЛОТ А И ПРОИЗВОДНЫЕ. В. 2, 7-ДИСУЛЬФОКИСЛОТА И ПРОИЗВОДНЫЕ. СО СО
(2,6-) (2,7-)
При сульфировании антрахинона 2,6- и 2,7-дисульфокислоты всегда образуются одновременно, приблизнтельнб в равных количествах. Такие же соотношения имеют место и при сульфировании антрахинона на моносульфокислоту, т. е. при избыточном антрахиноне. Остающиеся в растворе после выделения серебристой соли сульфокислоты, в количестве приблизительно 20%, состоят в круглых числах из 30 частей 2-сульфо — кислого натрия, 40 частей 2,6-дисульфо — и 30 частей 2,7-ди — сульфокислого натрия. После известкования "и выпаривания раствора до 23° Б, при подкислении, выпадает смесь 2-сульфо ч 2,6-дисульфокислого натрия; 2,7-дисульфосоль остается і маточном растворе и дает после сплавлевия с едким натрот изопурпурин очень чистой марки.
При сульфировании на дисульфокислоты реакцию можно вести таким образом, что 2,7-дисульфокислота образуется в некотором избытке, именно в отношении 55 к 45 частям 2,6-дисульфокислоты. Процесс сульфирования ведут в этом случае следующим образом: антрахинон замешивается сначала на холоду при энергичном перемешивании с возможно меньшим количе — ’60
![]()
ством смеси, 20 и 38%-ным олеумом. Остальное — количество 38%-ного олеума добавляется постепенно в течение реакции. Температура медленно поднимается до 178 —180°. Антрахинон сульфируется почти количественно. Общее количество олеума, с средним содержанием 34—34l/2% SO„ составляет 200—220% на вес взятого антрахинона. Разделение дисульфосолей ведется выпариванием кислого раствора, с постепенным прибавлением сульфата натрия, до 32 — 33°Б. При охлаждении до 40° выпавший
2,6- дисульфокислый натрий отделяется от маточного раствора фильтрпрессом и промывается раствором сульфата. После продувки воздухом получается продукт, содержащий приблизительно 20% C14HeOa (S03Na)2, Маточный раствор после известкования выпаривается с добавлением некоторого количества гипохлорита натрия до густой консистенции в освинцованных баках. Можно выпаривать и в чугунных и медных аппаратах; железные баки для этой цели не годятся, так как сульфосоли антрахинона действуют на железо разрушающим образом, даже в слабо щелочных растворах. Полученный продукт, не считая примеси сульфата [и некоторого количества окрашивающих примесей!, представляет собой почти химически чистую 2,7-дисуль — фокислую соль и дает при щелочном плавлении изопурпурин превосходного качества.
Разделение дисульфосолей можно вести и в нейтральных или слабо щелочных растворах, но кислое разделение ведется в более концентрированных растворах и потому экономичнее.
Производные 2,6-й 2,7-дисульфокислоты.
дихлорантрафлавйновая 4 кислота
2.6- ![]()
![]() диокси — 3,7-дисуль — 4 фокислота
диокси — 3,7-дисуль — 4 фокислота
2.6- диокси — 1,5-динитро — 4 3,7-дисульфокислота
1,5-дифениламино — 2,6- диокси — 3,7-дисульфокислота [1086]
в) 2 — хлор — 6 — суль — -*■ 2-окси — 6 — хлорантра-
фокислота хинон.
г) 2,6-дисульфохло — -* 2,6-дихлорантрахинон рид
д) 2-амино — 6-суль — -»• 2,6-диаминоантрахинон фокислота
![]() ‘ а) изопурпурин [1040]
‘ а) изопурпурин [1040]
б) 2,7-дисульфохло — ■* 2,7-дихлорантрахинон рид
в) 2-амино — 7 — суль — -»<2,7-диаминоантрахинон. р фокислота
а) Флавон урн урин [см. ниже].
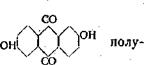 б) Антрафлавиновая кислота
б) Антрафлавиновая кислота
чается известковым плавом 2,6-дисульфокислоты [герм, пат. № 106505; Фр. 5,275]. Как побочный продукт [в количестве примерно 1/3], наряду с флавопурпурином, антрафлавиновая кислота получается при обыкновенном щелочном плавлении 2,6-дисульфокислоты [см. ниже]. Служит для получения темнокубового кислотного протравного красителя, выдающихся прочностей [1086]. При щелочном хлорировании переходит в ^лоропроиз — водное [герм. пат. № 152175 (1902); Фр. 7,167], служащее исходным материалом для получения коричневых кислотно-протравных красителей [герм. пат. № 237946 (1909); Фр. 10,610].
СО
![]() *ЧАА^ — Полу-
*ЧАА^ — Полу-
чается обработкой 2,6-дисульфокислого натрия в разбавленной соляной кислоте на кипу медленным добавлением Хлорновато — кислого натрия. 2-хлор-6-сульфокислота может служить для получения 2-окси-6-хлорантрахинона [известковый плав].
г) 2,6-дихлорантрахинон получается по герм. пат. Мей — стер-Люциус № 284976 (1913), Фр. 12,409 через 2,6-дисульфо — хлорид.
50 частей 2,6-дисульфохлорида нагреваются со 100 частями тионилхлорида на 220° в течение 8 час. Выхода до 60% теории.
Исходный сульфохлорид получается по герм. пат. Мейстер — Люциус № 266521 Х1912); Фр. 11,542 нагреванием сульфосоли с хлорсульфоновой кислотой. 412 частей 2,6-сульфокислого натрия нагреваются в течении 5 — 6 час. с 3000 частей хлорсульфоновой кислоты при температуре 90—100°. Масса выливается на воду, выделившийся сульфохлорид промывается горячей водой, сушится.
|
|
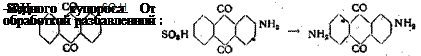
д) 2-ам ин о — 6-су л ь ф о к и с л о та , [герм. пат. Фр. Байер (1901) № 135634; Фр. 6,305].
20 кг 2,6-дисульфокислого натрия нагреваются при 90° . в течение 5 час. с 200 кг воды и 100 кг 20%-ного аммиака.
2,6- диаминоантрахинон [герм. пат. Баденской фабрики (1911) № 256515; Фр. 11,551].
40 частей 2,6-дисульфокислого натрия нагреваются при 200° в течение 25 час. с 250 частями 25%-ного аммиака и 78. частями
2,7-
 |
дисульфокислота и производные, а) Изопурпурин. Главное применение 2,7-дисульфокислоты—щелочное сплавление с едким натром для получения ценного изопурпурина [см ниже].
б) 2,7-дисульфохлорид, а равно и 2,7-дихлорантра — хинон получаются аналогично 2,6-производным.
Как 2,7-, так и 2,6-д ихлорантрахином являются исходными продуктами многих красителей, как: индантрен красный Ж [1142]; кубовый бордо Б [1141]; индантрен красный Р [1142]; индантрен бордо Б [1143].
в) 2-амино-7-сульфокислота, а равно и 2,7-диаминоантрахи — нон получаются аналогично 2,6-производным. Ни 2,6-, нй 2,7-диами — ноантрахиноны технического применения не получили.
2. Альфа [а]-сульфокислоты. а-сульфопроизводные антрахи — нона получаются сульфированием антрахинона в присутствии ртути [Ильинский, Вег. 36(1903), 4199 R. Е. Schmidt Вег. 37,66; Фр. Байер герм. пат. № 149801—(1902); Фр. 7,194; герм. пат. № 157123 (1903), Фр. 8,230].
Легкое получение а-сульфопроизводных антрахинона открывает для синтеза новых красителей антрахинонового ряда по истине грандиознейшие перспективы. В 7 томе своих Fortschr d. Teerfarbenf. Фридлендер [стр. 195] пишет по поводу этого открытия: „Реакция эта является важнейшим достижением, имевшим место в этой области за последнее время", [см. также патенты Ильинского и Ведекинда: английский № 10242 (1903); франц. № 332709; амер. 851423, 826509, 826510; русский 9652.]
Для получения 1,5 — и 1,8-дисульфокислот антрахинона повышают как температуру реакции, так и количество олеума. Наряду с 42^-46% 1,5-дисульфокислоты образуется 22 — 26% 1,8-дисуль — фопроизводного. По выделении 1,5-и 1,8-дисульфокислот [см. ниже] в маточных растворах остается 2-сульфокислота и 1,6- и 1,7-дисульфокислоты, не имеющие технического применения. Гидролизом альфа-сульфогруппы, кислоты эти могут быть превращены в 2-сульфокислоту. Операция эта едва ли окупается [см. Krebser, Ueber die Katalitische Disulfierung des Anthrachinons — Диссертация 1925 г.], также Anderau, die Anthrachinonsulfosauren. [Диссертация 1925 г.], а также обстоятельную работу К. Лауэра в немецком журнале „Практическая химия* за 1931 г., № 7 — 9].
200 частей антрахинона вносятся в 240 частей 20%-ного олеума и нагреваются до 110° до полного растворения антрахинона. Затем в течение 6 час. при 110—120° постепенно добавляются 200 частей 66%-ного олеума. Реакция ведется до полного исчезновения антрахинона. По охлаждении до 50° прибавляют 100 частей крепкой серной кислоты. Высадившуюся в кристаллическом виде 1,5-дисульфокислоту отсасывают через асбест. При раз"
лєвии маточного раствора половинным объемом воды — криетал- лизуется 1,8-дисульфокислота.
А. 1-МОНОСУЛЬФОКИСЛОТА И ПРОИЗВОДНЫЕ. 100 частей антрахйнон» растираются с 1 частью окиси ртути, вносятся в 115 частей 25%’ного олеума и нагреваются в течение 21/а час. при 135°. Сульфосмесь выливается в 800 частей воды, не вошедший в реакцию антрахйнон отфильтровывается. При прибавлении к горячему фильтрату хлористого калия сейчас же выпадает трудно растворимая калиевая соль 1-сульфокислоты. Фильтруют при 60°, промывают теплой водой. Выхода на 1-сульфокислоту достигают 70% теории {см. Anderau 1. с., см. также Фр. 7,194].
В маточных растворах получается некоторое количество 1,5-й
1,8- дисульфокислот, и а — ^-сульфоироизводных.
Схема 3.
Производные 1-сульфокислоты.
![]() ‘1-метоксиантрахинон 1 — метокси -4-нитроантра^ хинон
‘1-метоксиантрахинон 1 — метокси -4-нитроантра^ хинон
1-метокси — 4-аминоан-
трахинон
|
1 |
![]() 1 — окси — 4 -нитроантрахи — нон
1 — окси — 4 -нитроантрахи — нон
1 -окси — 4 — аминоантрахи — нон?
в) 1-аминоантрахи- I 1 — амино-4-нитроантра-
нон —* I хинон
( 1,4-диаминоантрахинон
г) 5- [8] — нитро — 1-ок — 5- [8]-амино — 1-оксиантра-
сиантрахинон —* хинон
д) 1-метиламиноан- трахинон
 |
||
а) 1-хлорантрахинон получается аналогично /?-проиэ- •водному [см. выше] действием хлорноватокислого натрия на горячий раствор 1-сульфокислой соли в разведенной соляной кислоте. Реакция протекает легче нежели с ^-производным. Качество продукта прекрасное, выхода почти теоретические. Служит дйя получения 1-метоксиантрахинона [нагревание в автоклаве с раствором едкого натра и метиловым спиртом]. При нитровании метоксипроизводного образуется 1-метокси — 4-н и тр о антрахйнон, переходящий при восстановлении в 1-метокси-4-аминопроизводное, исходный продукт для получения так называемых а л голового алого [1129].
б) 1-окси антрахйнон получается известковым плавлением 1-сульфокислоты [см. Lassar-Cohn Arbeitsmethoden, Spezieller Teil, стр. 77—78; а также фран. патент № 336938]. Выход и чистота продукта прекрасные.
При нитровании [герм. пат. Фр. Байера № 163042 (1904); Фр. 8,268] образуется с хорошим выходом:
1-окси-. 4-нитроантрахинон, переходящий при восстановлении в 1-окси-4- аминоантрахинон, бензоилпроиз — водное которого носит название алголовой — розы [1128]. Служит также через 1-хлор-4-оксиантрахинон исходным продуктом для получения хинизарина [см. ниже].
![]() СО NOo
СО NOo
в) 1 — аминоантрахинон с хорошим выходом £85%] получается по методу фирмы Chem. Industrie Basel, [герм. пат. .Ns 391073 (1921); Фр. 14,847], нагреванием 1-сульфокислого калия с водным аммиаком и нитробензол-сульфокислотой.
![ПОЛУПРОДУКТЫ АНТРАХИНОНОВОГО РЯДА Подпись: 165 частей 1-сульфокислого калия, 500 частей 24%-ного аммиака и ,60 частей нитробензол-сульфокислого натрия нагреваются в автоклаве на 160—165° в течение 12 час. При нитровании оксалилпройзводного образуется 1-амино- 4-нитро антрахйнон, переходящий при восстановлении в 1,4-диа- мино производное, служащее исходным продуктом для получения алголового красного 5Ж [1131]. СО NHS СО NH2 СО NH2 / // /// ///У і 1 I M-j f I -»■ I I ) I ■ CO CO N02 CO NHS г) При нитровании 1-сульфокислоты антрахинона образуется смесь 5-й 8-н итропроизводного, переходящая при восстановлении в соответствующий 1-амино - 5 - [8]-с у л ь ф о а н- трахинон. Бромированием [в положении 2 (4)], с последующей заменой брома [в положении 4] на фениламинный остаток получается после сульфирования в боковой цепи, кислотный али- зарин-цианол Б [1087]. СО SO,H](/img/1208/image119_2.gif) |
 |
 |
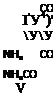 |
СО S08H СО NHS
|
|
![]() 5 М. Ильинский. Красители.
5 М. Ильинский. Красители.
д) 1-мет’йламино-антрахинон получается нагреванием 1-сульфокислого калия с 10%-ным раствором метиламина в течение 4 час. на 150—160° [Фр. Байер, герм. пат. № 175024 фр. 8, 283 [(1902)].
![]() СО S03H СО NH. CH,
СО S03H СО NH. CH,
Служит для получения ализарин-астрола [1075], синего кислотного красителя, выдающихся прочностей, а равно и ализарин рубинола [1091], красного кислотного, выдающейся светопрочности,
Схема 4.
 |
![ПОЛУПРОДУКТЫ АНТРАХИНОНОВОГО РЯДА Подпись: і 1,5-диокси - 2,6-дисуль- I фоантратрахинон 41.5- диокси, 4,8-динитро- 2,6-дисульфоантрахи- I нон * 1 -5-диокси - 4,8-диамй- но- 2,6-дисульфоантра- хинон ализарин - сафирол [1054] 11.5- диокси-4,8 динитро- антрахинон ♦ 1,5-диокси -4,8-диамино- антрахинон (диамино- антраруфин)](/img/1208/image133_2.gif) |
|
Производные а-дисульфокислот.
 |
||
‘ а) 1,8-дихлорантра — хинон
а) 1,5-й 1,8-дихлорантрахинон с легкостью получаются обычным путем действием хлорноватокислого натрия на разбавленные растворы с о о т в. сульфосолей, в присутствии соляной кислоты.
1,5-
 |
|
дихлоран£рахинон служит для получения индан — трен-фиолетового PH [1163]
б) 1,5-диоксиантрахинон [антраруфин] получается известковым плавлением 1,5-дисульфокислоты. Служит исходным продуктом для получения ализарин-сафирола [1053-т-1054]. (Через 1,5-д и о кс и—2,6-дисульфо — 1,5-диокси — 4,8-ди — нитро —2,6-д исульфоантрахи нон).
1,8- диоксиантрахинон [хризазин] вышеописанным путем переходит в кислотный краситель, аналогичный ализарин-сафи — ролу — несколько более зеленого оттенка.
Обыкновенно для получения продажной марки ализарин-сафирола исходят из смеси антраруфина и хризазина.
Нитрованием антраруфина в крепкой серной кислоте получается 1,5-диокси — 4,8-динитропроизводное, нитрованием хризазина, изомерный 1,8-диокси — 4,5-антрахинона (см. выше). ,
При восстановлении оба изомера переходят соответственно в аминопроизводные — 1,5-дно к си-4,8-диамино и
1,8- д иокси-4,5-диаминоантрахинон [диамииоантраруфин идиаминохриэазин] (см. выше).
С бенаоилхлоридом диамииоантраруфин дает кубовый краситель — индантрен яркофиолетовый [1134], ,ч выдающихся прочностей,
В отличие от некрасящего диаминоантраруфина, диамино — хризазин окрашивает хромированную шерсть в красивый 5* ” 6?
зеленовато-синий if оттенок. Красящей способностью обладает и д и н и т р о х р и з а з и н, дающий по хромированной шерсти густые темносинис окраски [герм. пат. Фр. Байер (1897), № 98639 и 100138; Фр. 5,245]. •
 |
 |
Заменой сульфогруппы на аминогруппу 1,5 и 1, 8-дисульфо — антрахиноп переходят в 1,5 и 1,8-диаминопроизводные. Реакцию ведут согласно методу герм. пат. М. Л. Бр. № 273810 (1913); Фр. 12,411, в автоклаве с водным аммиаком, в присутствии хлористого бария.
Выхода на диаминопроизводное ао 55% теории:
200 частей 1, 5-дисульфокислого натрия.
2 700 частей 25%-ного аммиака.
300 частей воды.
240 частей хлористого бария нагревают в течение 48 часов при 180—186°.
• В отличие от 2,6-диамино,1,5-диаминоантрахинон имеет значительное техническое применение. Бромированием в 2,4, 6,8- положение с последующей конденсацией [положение 4,8] с анилином ■ [или п-толуидинами] и сульфированием в боковой цепи, получается так называемый антрахиновый синий СР[1089]. Сплавлением 1,5-диаминоантрахинона с едким кали, получается индантреновый серый [1 123],кубовый краситель, прекрасных прочностей [дешевле из диаминоантрахянона, полученного восстановлением 1,5, и 1,8 динитроантрахинона].
Дибензоил производное 1,5- и 1,8-диаминоантрахи — нона представляет собой так называемый а л го л о в ый ж е л — тый Р [1132], прочный к мытью и хлору, но не отличающийся особой еветопрочностью [дешевле из диаминоантрахинона, полученного восстановлением сырого динитроантрахинона].
Индантре н-к о р и н т [1144]—конденсация 1,5-диаминоантрахинона с 2 молекулами 1-хлорантрахинона, с последующим нитрованием, восстановлением и бензоилированием. Кубовый краситель прочный к кислотам, хлору и свету.
Инд антрен бордо Б [1146], кубовый краситель прочный к мытью, свету, хлору, кислотам и щелочам, получается конденсацией. 1,5-диаминоантрахшюна с 2-хлорантрахиноном.
3. Нитропроизводные. При нитровании антрахинона с нитро — вальной смесью в крепкой серной кислоте [5-кратное количество 5 —10% избытка HNOg против теории,:—температура до 70 — 80°] образуется в главной массе смесь 1,5-, 1,8-, 1,6-и 1,7-дин итро — гроизв одных. В числе изомеров в малых количествах имеются и /9-/?-дйнитропрризводные.
(и других изомеров)
Выхода сырого динитроантрахинона теоретические. Разделение отдельных изомеров представляет большие трудности.
Сравнительно легко, обработкой спиртом, ацетоном и другими растворителями сырого продукта удается удалить легко растворимые нитроизомеры, в остатке смесь 1,5- и 1,8-динитроантрахи- нов, служащая исходным продуктом для получения антрацет нового синего [1059]. 2,7-динитрохинон, реактив Фритце [Zeitschrlft fur Chemie 1869, 114] получается длительным нагреванием антрахинона с разбавленной азотной кислотой. Образуют со многими углеводородами характерно окрашенные продукты присоединения.
СО СО
![]()
![]()
разбавленная азотистая кислота СО ~”
4. Аминоантрахиноны. Из технически важных аминоантра — хинонов назовем:
1-аминоантрахинон [схема 3] — замена сульфогруппы на амин.
1- метиламиВоантрахинон [схема 3] —замена сульфо-’ группы на метиламин.
2- аминоантрахинон [схема 1] — замена сульфогруппы на амин.
1.4- диаминоантрахинон [схема 3]—через 1-амино — 4-нитроантрахинон.
1.5- и 1,8-д и а м ин о а нт р а х и н о н [смесь] восстановлением соответствующей смеси динитроантрахинонов.
1.6- и 1,7-д и а м и н о а н т р а х и н о и [смесь] выделяется из маточных растворов при очистке сырых диаминоантрахинонов органическими растворителями.
Разделение смесей диамйнопроизводных, получаемых восстановлением сырых динитроантрахинонов лабораторным путем, ведется по методу, описанному Нельтингом и Вортманном [Вег 39, 637]. Технические методы разделения еще не выработаны. Обыкновенно довольствуются удалением с органическими растворителями легко растворимых альфа-бета и бета-бета-диаминов.
При нагревании на водяной бане эквимолекулярных смесей диацетил 1,6- или 1,7-диамино — и ацетил-1-амино — антрахинона с оксихлоридом фосфора получается и яд ант — реи оранжевый РТ [1 157], кубовый краситель, прочный
к мытью, хлору, свету, щелочами и кислотами [герм. пат. Баденской фабрики (1907), № 198048; Фр. 9, 789].
5. Галоидопроизводные. Прямое хлорирование антрахино — на ведется герм. пат. Фр. Байер № 228901 (1909 г)]. Фр. 10,578 в растворе моногидрата или слабо дым. серной кислоты, пропусканием через раствор при нагревании, определенного количества хлора, в присутствии катализаторов.
 50 кг антрахинона растворяют в 500 кг моногидрата серной кислоты с добавлением 1 кг иода. Затем при 130° пропускают хлор, в расчете на 4 атома хлора.
50 кг антрахинона растворяют в 500 кг моногидрата серной кислоты с добавлением 1 кг иода. Затем при 130° пропускают хлор, в расчете на 4 атома хлора.
 Образующийся 1,-4,-5,-8-тетрахлорантрахинон
Образующийся 1,-4,-5,-8-тетрахлорантрахинон
шнает выделяться уже из горячего раствора в виде микроскопических иголочек. По охлаждении продукт отсасывается, промывается и сушится.
Аналогично реагируют с образованием того же продукта 1-хлор, 1,5- и 1,8-дихлорантрахинон. 2-хлорантрахинон образует пента (пятизамещенный) хлорантрахинон; 2,6- и 2-7-дихлорант1 рахинрн образуют гекса [шести], замещенные хлоропроизводные. ■ —
Технического значения продукты эти не Имеют.
Главнейшие хлоропроизводные антрахинона получатся почти исключительно заменой сульфогруппы определенного строения на хлор. С реакцией этой мы познакомились уже при рассмотрении сульфопроизводных.
1- хлорантрахинон [см. схему 3].
2- Хлорантрахинон [см. схему 1].
1.5- и 1,8-дихлорантрахинон [см. схему 4]. :
2.6- и 2,7-дихлорантрахинон [см. схему 2].
1-хлор-2-оксиантрахинон получается щелочным хлорированием 2-оксиантрахинойа [см. схему 1].
Согласно герм. пат. Баденской фабрики № 228876 (1910); Фр. 10,. 577 хлорозамещенные антрахиноны определенного строения^ получаются хлорированием соответствующих сульфокислот антрацена в солянокислом растворе, причем одновременно с заменой сульфогруппы на хлор протекает и окисление продукта в сульфокислоты антрахинона. Реакция эта может иметь техническое значение в случае 2,6- и 2,7-дихлорантрахинонов, так как замена сульфогруппы на хлор • в этих сульфокислотах антрахинона протекает с трудом.
6. Оксипроизводные. Оксипрорзводные антрахинона (по английской терминологии для обозначения оксипроизводных антрахинона почти исключительно применяется термин „гидроксй" Так например 1-оксиантрахинон по-английски носит название
1- гидроксиантрахинона и т. д. Вернее было бы эти соединения называть’ не „окси“ и не „гидрокси“ а гидроксилпроизводными:
2- гидроксцлантрахинон и т. д.) представляют выдающийся техни
ческий интерес. Не говоря о красящих представителях этого’ рода, как 1,2-диокси-, 1,2, 6- и 1, 2, 7,- а также 1, 2, 3-триокси 1, 2, 5,8-тетраоксиантрахиноны, которые мы — рассмотрим в главе 70 ’ ‘ ‘
![]()
о красителях, имеется целый ряд некрасящих оксипроизводных, как 1- и 2-моноокси, 1,5-, 1,8-и 2,6-диоксиантрахиноны и их производные, а равно н 1,4-диоксиантрахинон,—соединения, являющиеся исходными продуктами для получения тех или иных красителей. С большинством этих соединений мы познакомились уже при рассмотрении сульфоппоизводных; так:
1- оксиантрахинон [см. схему 3].
2- Оксиантрахинон [см. схему 1].
1 Д>- и 1,8-диоксиантрахинон [см. схему 4].
2,6- д и о кси антр а х и но н [см. схему 2].
Особняком стоит 1,4-д иоксиантрахинон, так называемый хинизарин, для получения которого [за неимением соответствующей дисульфокислоты] приходится прибегать к особым методам.
По методу Фр. Байера [герм. пат. № 161954 (1904); Фр. 8,252].
СО он
средственно из антрахинона нагреванием последнего с крепкой серной кислотой и нитритом в присутствии борной кислоты и ртутных солей.
10 кг антрахинона, 20 кг нитрита, 5 кг борной кислоты, 0,2 кг сернокислой закиси ртути в 300 кг серной кислоты 66° Б, нагреваются до120—150°. Для разложения промежуточно образующегося 1-окси — 4 — диазоантрахииона температура массы поднимается до 180°. При выливании на воду выпадает хинизарин, загрязненный антрахиноном и пурпурином. Выхода на ализарин достигают 80%, но очистка продукта представляет затруднения.
Лучшие результаты дает метод Фр. Байера [герм. пат. №203083 (1906) Фр. 9,681], исходным продуктом которого является легко •доступный 1-оксиантрахинон, через 1-окси-4-хлорантрахинон с последующим гидролизом в крепкой серной кислоте, в присутствии борной кислоты [замена хлора на гидроксил].
10 кг 1-хлор-4 — оксиантрахинона. нагревают при температуре 100° с 50 кг 20%-ного олеума, 50 кг серной кислоты 66° Б и 5 кг борной кислоты. По окончании реакции массу выливают в воду, выпавший хйнизарин отфильтровывается и промывается.
Хинизарин хорошо получается синтетическим путем, как например конденсацией фталевого ангидрида с гидрохиноном [Вег. 6, 972(1873); 7,972 (1874)], а также, исходя из фталевого ангидрида и п-(и о) — хлорфенола [англ, пат, № 245587 (1926)].
Смесь о — и п-хлорфенолов нагревают в моногидрате в течение 1 часа до 90—100°, затем прибавляют раствор фталевого ангидрида и борной кислоты в серной кислоте, и нагревают в течение 16 час. до 250е. Охлажденная до 40—50° масса выливается в воду. Выхода на хинизарин достигают 88% теории. Здесь особенно интересен тот факт, что о-хлорфенол или смесь о — и п-продукта, дают такие же выхода на хинизарин как и р-хлорфенол (метод нами не про — веред), ■ ■■ ‘ ,
Метод получения хинизарина, исходя из п-дихлорбензола и фталевого ангидрида (через 1,4-дихлорантрахинон) дает плохие выхода. —
Хинизарин служит исходным продуктом для ряда кислотных красителей, выдающихся прочностей, как ализарин-цианин зеленый [1078]; ализарин яркозеленый Ж [1079]; али — зарин-иризол [1073] ализарин-циано л [1074].
К полупродуктам антрахинонового ряда, получаемых синтетическим путем, кроме метилантрахинона [см. выше] и хинизарина следует отнести в так называемый антрахризон [1,3,5,7-те — траоксиантрахинон], получаемый конденсацией 3,5-диокси — бензойной кислоты с крепкой серной кислотой. [Barth und Lenho — fer, Ann. (1872), 164; Либерман, Вег. 35 (1902), 2305; Hohenemser Вег. 35,2305].
он/соон^ / он///ч,
/ + НООС/Ьн /А. Л>н
Антрахризон служит исходным продуктом для ряда ценных кислотных красителей, как динитроантрахризон-дисульфокисло — та [1047] диаминоантрахризон-дисульфокислота [1048]; кислотный ализариновый краситель [1049]Г
7.Бензантрон. Продукт конденсации антрахинона с глицерином, так называемым бензантрон, получается нагреванием антра — нола [или оксантранола] с глицерином в крепкой серной кислоте. Восстановление антрахинона в антранол ведется в одной и той же операции добавлением в качестве восстановителя железных, медных стружек и т. п. Рекомендованный в герм. пат. Баденской фабрики [№ 176018 (1904); Фр. 8,372] сульфат анилина дает худшие — результаты. Реакцию ведут следующим образом.
 |
|||
В железный котел загружаются 100 частей купоросного масла, 10 частей антрахинона и при температуре 40 — 50° добавляется в течение 1 часа 7 г медной или железной стружки. Смесь размешивается при той же температуре в течение нескольких часов, затем вносят 10 г глицерина, постепенно поднимая температуру до 102 — 105°, и ведут нагревание до исчезновения реакции на антрахинон [нагревание пробы с цинковой пылью в 10%-ной щелочи не должнб давать красного окрашивания]. По охлаждении до 70® смесь выливают на воду, сливают с непрореагировавшей стружки; осадок отсасывают, промывают горячей водой, затем горячей 1%-ной щелочью [до светложелтого цвета промывных вод]. Сухой продукт извлекают горячим хлорбензолом, — в остатке 10—12% нерастворимых примесей. По охлаждении выделяется в кристаллической форме чистый бензантрон с температурой плавления 170—172°. Выхода до 90% теории.
, Бензантрон и его хлоропроизводные служат исход — ним материалом для получения ряда кубовых красителей, непревзойденных прочностей к мытью, свету и хлору. Так калиплавлением получается индантрен темно — синий БО, так называемый виолантрон [1099]. Хлорированием виолантрона образуется индантрен фиолетовый РТ [1100]. Окислением с последующим метилированием получен так называемый нефритовый зеленый [1101] — сине-зеленый краситель, необычной для кубовых красителей яркости, прочный к хлору, кислотам, свету и мытью. Нитрованием виолантрона получается индантрен зеленый В, переходящий при обработке гипохлоритом на волокне в черный—кубовый—индантрен- черный Б [1102], дающий на мерсеризованной пряже абсолютно прочные окраски. При хлорировании бензантрон дает хлоропроизводные, переходящие при сплавлении с едким кали в изов. и<н~ лантрон, переходящий при охлорении в индантрен фиолетовый 2 Р [1104], прочный к мытью, свету и хлору.
 20 августа, 2015
20 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 