1. Строение и производные. Карбазол открыт в 1872 г. Гребе и Глазером [Вег. 5,13: Ann. 163,343] в каменноугольной смоле при очистке антрацена. В сообщении нет указания на выделение карбазола калиплавлением, хотя метод этот применялся тогда уже Перкином в фабричном масштабе и был сообщен Перкином Баденской фабрике, сотрудником которой был Глазер. Только после опубликования этого метода самим Перкином в 1877 г. [Joum. of fhe Soc. of Arts] о методе калиплавления сообщает и Г’ребе.
[Ann, 202 (1880), 21]. Гребе же установлено и строение фецан- трена как производного дифениламина [Ann. 167 (1873), 125]. При пропускании дифениламина через раскаленную трубку происхо — дит замыкание кольца в ортоположенйи к связывающей два фенильных остатка иминной группе, с выделением водорода:
NH NH
Освобождающийся водород только частью выделяется как таковой, главная масса — его идет на восстановление исходного дифениламина до бензола, анилина и аммиака, так что выхода на кар- базол при этом синтезе очень незначительны.
По Бланку [Вег. 34 (1891), 306] карбазол получается и при нагревании ортоаминодифенила с известью.
Этими реакциями строение карбазола устанавливается с несомненной ясностью, независимо от того, что и все свойства этого, содержащего азот соединения, как нельзя лучше подходят к этой формулировке. Таким образом все главные спутники антрацена являются производными дифенила и генетически связаны друг с другом, различаясь между собой лишь по характеру замыкания кольца и средних орто-ортогруппировок. У фенантрена групповой остаток — СН = СН, у флуорена — СН2, у карбазола NH.
С подвижностью водорода при азоте мы познакомились уже при рассмотрении методов очистки сырых антраценов.
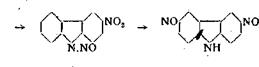
NK N. N0
карбазол-калий 9-нитрозокарбазол
|
/____ У к АЛ/1 — слу* N. CjHs |
Важное значение имеет N-этилпроизводное
жащее исходным материалом для получения так называемого гидронового синего, марки Б, одного из выдающихся пред* .ставителей красителей карбазолового ряда.
|
|
|
|
 |
![]()
№ 218371; Фр. 10,301]. .-■■■
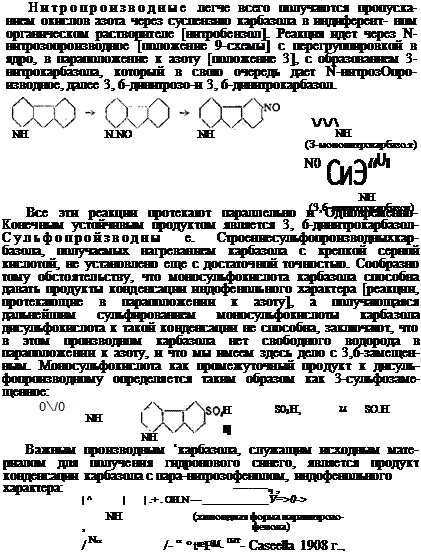
2. Использование карбазола. Техническое применение карбазола ведет свое начало с 1908 г., когда фирме Касселла, конденсацией нитрозофенола с карбазолом [еда. выше] и последующим сплавлением ■ образующегося индофенола с полисульфидом натрия удалось получить синий сернисто-кубовый краситель, так называемый гидроновый синий [герм. пат. № 221215; Фр. 10,304; С. 970]. По светопрочности краситель этот превышает как индиго, так и все синие сернистые красители и приводится Фйрцем в его руководстве органических красителей [стр. 53:—54] в числе избранных 12, разнообразных групп, не изменяющих своего оттенка даже в слабых выкрасках (2%), при инсоляции в течение двух летних солнечных месяцев. Краситель этот в отличие от сернистых красителей прочен к хлору. Крашение ведется из сернистого натрия с добавлением гидросульфита и не представляет никаких затруднений. Кроме гидронового синего имеются и другие сернистые красители, производные карбазола, дающие темносиние и черные, прочные к хлору, окраски [англ. пату № 234631; франц. пат. №№ 588874 и 591511]. Динитрокар — базол и сульфокислота карбазола согласно опытам Экспериментальной лаборатории Анилтреста [J3. К. Эйхман и Г. И. Гершзон], могут служить исходным материалом для получения прочных к свету сернистых оливковых красителей.
Касательно применения карбазола как исходного материала для получения искусственных дубителей см. М. А. Ильинский, к вопросу о выработке синтетических дубителей, журнал Химическая Промышленность, .1931 г., № 7.
Имеются указания на то, что карбазол может служить исходным материалом для получения резиновых ускорителей [3-нитрозо — карбазол и др„ амер. пат, фирмы Goodyear Tire Rubber Company № 1, 580089; Zentralblatt 1926, II стр. 116].
Решение вопроса об использовании карбазола как спутника антрацена неразрывно связано с разрешением антраценовой проблемы в общем. Антрацен, фенантрен, карбазол должны быть выделены как таковые и соответственно использованы.
IV. АЦЕНАФТЕН.
А А.
I. Строение и производные. Аценафтен содержится в сравнительно значительных количествах, во фракции каменноугольной смолы, переходящей между 265—285° [Бер и фан-Дорп, Вег. 6(1873), 60; Ann. 172 (1874), 263]. Синтетически этот углеводород получек впервые еще Вертело в 1867 г. пропусканием паров нафталина через накаленную трубку. Первоначально аценафтену придавали
/VvfHe
строение диортозамещенного нафталина: III) а продук-‘
ту окисления аценафтена, так называемой нафталовой ки — 54
|
|||
|
|
||
(1888), 217] синтезом нафталовой кислоты исходя из 1,8-нитро-
![]()
NOa СООН
кислоте следует придать строение, , а стало быть и аце-
СН.-СН,

![]() нафтен будет 1,8-производным нафталина:
нафтен будет 1,8-производным нафталина:
чистого аденафтена из соответствующей фракции каменноугольной смолы облегчается [согл. герм. пат. О-ва для использования смолы в Дюисбург-Мейдерихе, № 277110 (1913); Фр. [12,104] вторичной разгонкой трудно разделяемой смеси аденафтена с бифенил-оксидом и флуореном выделяющейся при стоянии фракции 275—285°, с равным количеством метилнафталиновой фракции, переходящей между 240 — 260°. При охлаждении дестиллата выделяется в главной массе аценафтен, тогда как кристаллизирующие обычно вместе с аценафтеном примеси остаются в растворе.
2. Применение аценафтена. Окислением аденафтена в известных условиях [10 частей аценафтена, 70 частей ледяной уксусной кислоты нагреваются до 100°, после чего вносится 40 — 50 частей бихромата натрия в порошке] получается с хорошими выходами аценафтенхинон.
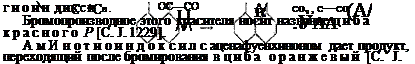 |
Конденсацией этого хинона с тиоиндоксилом получается краситель выдающейся прочности тиоиндигового ряда, так называемый тиоиндиг оалый [С. J. 1228]:
 18 августа, 2015
18 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 