Скипидар (терпентинное масло) — сложная смесь, состоящая в основном из терпенов состава С10Н16.
Скипидар представляет собой бесцветную или окрашенную до темно-бурого цвета жидкость с характерным сосновым запахом; температура кипения скипидаров колеблется от 150 до 225° С, а плотность 0,85—0,87.
Скипидар смешивается с большинством неполярных растворителей, абсолютным этиловым спиртом, ацетоном, этиловым эфиром, бензином, хлорированными углеводородами. В воде скипидар не растворяется.
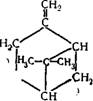
Состав скипидара неоднороден и зависит от сырья, из которого его получают.
В состав отечественного соснового живичного скипидара
СП, I 3 С
Нс^^сн
|
HX |
|
Н2С. |
|
З-Карен (10—18%) |
II 1,С—с^-си J
А-Пинен (60—70% )
Р-Пинен (6—8%)
|н3с-с^сн3|
|
Входят: |
Н*с I
.СН
|
СН2 II 5 Сч |
|
Н3с—Р^сн |
Н2С I Ч-СНа
|
(НзС-С-СНз! |
|
Или |
|
Нх |
|
Чсн |
|
Хн |
L/CH3
Сн,
|
Н, с Но |
|
Сн II Сн2 |
|
Мирцен (1—2%) |
Сн
С
Сн, I 3 /С.
|
Сн I СП, |
Дипентен или лимонен (4—6%) нгС
Сн I
НзсАСНз
Ли монен
СН, I
|
НС Н2С |
|
СН, „СН2 |
Терпинолен (2—3%)
Н3С—С—СН,
|
Сн. |
Х’Ч
НС
У"
|
Сн |
|
НС I НС. |
|
Цимол (2-4%) НС: |
Н3с—сн—СН3 П — цимол
СН
/СН3
СН • Чн3
■«-цимол
Скипидар получают из смолы хвойных деревьев (главным образом сосны, а также ели, пихты, кедра и т. д.).
При надрезании коры растущего хвойного дерева выделяется прозрачная жидкая смола — живица (терпентин).
Вытекающая из трещин коры и подсыхающая на воздухе смола называется серой.
При перегонке живицы или серы с водяным паром получается жидкий скипидар (живичный или серный). После отгона остается твердая смола— канифоль.
Скипидар весьма реакционноспособен, легко окисляется на воздухе, особенно на свету.
При окислении скипидара сильными окислителями (например, HNO3) он самовоспламеняется. Под действием кислот и тепла скипидар легко полимеризуется.
Окислившийся скипидар разрушает волокна и особенно окраску при последующей обработке изделий.
Скипидар горюч, температура вспышки 90—105° С, нижний предел взрывчатости паров скипидара в воздухе 0,8 об. %.
Скипидар является раздражающим веществом, но его действие зависит от степени очистки и сортности. Пары скипидара раздражают слизистую оболочку глаз и горла. При попадании скипидара на кожу могут развиться воспалительные процессы (терпентинные лишаи).
Предельно допустимая концентрация паров в воздухе 0,3 мг/л.
В СССР выпускаются следующие виды скипидара.
1. Скипидар серный или живичный — терпентинное масло (ГОСТ 1571-54), получают перегонкой сосновой живицы с водяным паром. Этот наиболее ценный вид скипидара представляет собой бесцветную прозрачную жидкость =0,855—0,863, Гкип 153—180° С.
2. Скипидар экстракционный (ТУ МБДП 451-54) получают при переработке пневого осмола сосны путем экстракции органическими растворителями.
Прозрачная или слегка желтоватая жидкость df =0,850— 0,864, Гкип 150—220° С.
3. Скипидар-сырец сухоперегонный (ТУ МБДП-247) получают сухой перегонкой смолистой сосновой древесины.
|
81 |
Выпускается двух сортов — «лимонный» — прозрачная жидкость от лимонного до оранжевого цвета, d° =0,880, Т^ип 155— 227° С (отгон 95%) и «красный» — жидкость от красного до
4 Заказ Л"» 2217
Темно-красного цвета, допускается слабая муть, =0,90, ТкИп 155—227° С (отгон 85%).
4. Скипидар сухоперегонный очищенный (ВТУ РЛПС 2-50) получают из сырца очисткой от примесей и перегонкой с водяным паром.
Этот скипидар должен быть прозрачным, допускается слабый желто-зеленый оттенок.
Выпускается трех сортов:
I п ш
Dl°……………………………………………….. 0,855—0,862 0,860—0,865 0,053—0,87
Гкип…………………………………………….. 157—180 157—180 150—180
Объем отгона до 180°, % … . 95 90 80
5. Скипидар кедровый (ВТУ МБДП 653-55) получают путем переработки кедровой живицы, df =0,86—0,87, TKsm 153—170° С. Скипидар — прозрачная летучая жидкость.
6. Скипидар живичный без пинена (ТУ МБДП 716-56) получают путем очистки от полимеров отходов производства камфары,^0 = 0,855—0,877, 7КИп 165—190°С; прозрачная жидкость от слабо-желтого до светло-желтого цвета.
Скипидар перевозят и хранят в деревянных бочках, покрытых изнутри клеем, а также в стальных бочках или стеклянных бутылях.
Скипидар хорошо растворяет жиры, масла, смолы, лаки, краски, эмали, засохшие масляные краски, деготь и т. д.
В химической чистке одежды скипидар применяют для выведения пятен, он входит также в состав некоторых пятновы — водных средств.
Скипидар хорошо удаляет засохшие масляные пленки, но ткань, смоченную скипидаром, нельзя оставлять на длительное время, так как скипидар на воздухе окисляется. Рекомендуется применять скипидар для чистки легких тканей, так как из тяжелых тканей впоследствии трудно удалить запах.
Диоксан (парадиоксан, 1,4-диоксан, диэтилендиоксид, ди — этиленовый эфир); df> = 1,0338, мол. вес. 88,10.
Г I2
< >
V-‘r
Бесцветная подвижная жидкость с легким запахом, напоминающим эфир; 7КИП 101,32° С. При охлаждении диоксан застывает и превращается в кристаллы Тпл—11,8° С. Диоксан является универсальным растворителем, он смешивается с водой, спиртом, эфиром, скипидаром, бензином, бензолом и многими другими растворителями.
Диоксан представляет собой циклический простой эфир и по химическим свойствам подобен алифатическим простым эфи — рам, он устойчив к действию кислот, щелочей, аммиака, металлического натрия.
Хлорирование диоксана при температуре 90° С дает 2,3-ди — хлордиоксан, а дальнейшее хлорирование в присутствии йода при температуре 155—160° С — 2,2,3,3-тетрахлордиоксан:
НгС СП2 90» Н2с СН-С1 2 С12; 155-160°
TOC o "1-3" h z | | + С1, —————————- >- | | ———————— у
Н2С С—С12
——- I I + 2 HCI
Н2С С-С12 Х(У
2,2,3,3-Тетрахлордиоксан может гидролизоваться, образуя эти — ленгликоль, щавелевую и соляную кислоту
Н2С C—CI, СН2ОН СООН
+ 4 HjO—>- I + + 4 HCI
Н2С C-CI, СНгОН ioOH
>
При температурах 50—300° С и под давлением от 400 до 1000 ат диоксан реагирует с этиленом, образуя высокоплавкие воски.
Диоксан получают дегидратацией этиленгликоля в присутствии серной кислоты (или катионобменной смолы) при температуре около 160°С
/СН2——— СНгч /:н2—— С Нл
Н|0 х0|н1 /
Оч О + 2 Н20
/
НО 1
^СН2——- CHi^ ‘ NCH2—СН2’
4* 83
По мере отгонки образующегося диоксана в реактор непрерывно вводят свежий этиленгликоль.
|
СН2—- СН2. |
|
YCHj—СН2Ч^ |
|
/ О |
|
|
|
О |
|
-сн |
|
•сн? |
|
Сн2—— сн2 2 |
Таким же образом получают диоксан и из диэтиленгликоля:
Н20
Диоксан можно получать также непосредственно из окиси этилена:
^сн2—сн/
Реакция протекает в паровой фазе.
Окись этилена пропускают при температуре 120° С над ще — лочнобисульфатным катализатором. В качестве катализатора можно применять и кислый сульфат натрия.
Возможно получение диоксана из p-хлорэтилового эфира
0+2 NaOH
УСН2—сн2ч^ >■ О 0+2 NaCl + н20
Диоксан растворяет ацетатный шелк, легко воспламеняется, пары его взрывоопасны, температура вспышки 5° С (в закрытой чашке), пределы взрывоопасных концентраций 1,97—22,5%.
Диоксан ядовит, он является наркотическим средством, вызывает тошноту, раздражает слизистую оболочку, действует на печень и почки. Предельно допустимая концентрация паров диоксана в воздухе 0,01 мг/л.
Диоксан выпускают в соответствии с ГОСТ 10455-63, плотность Df = 1,0320—1,0350, температура затвердевания 10,5— 11,5° С, содержание перекисных соединений (в пересчете на
активный кислород — не более 0,01—0,015%. Фасуют диоксан в склянки не более 1 кг, на которых должна быть надпись: «Во избежание несчастных случаев проверять продукт перед употреблением на содержание перекисей».
При хранении в диоксане накапливаются взрывчатые перекиси. Поэтому его надо хранить над хлористой сурьмой или сернокислым железом.
Поскольку в молекуле диоксана находятся два эфирных атома кислорода, диоксан обладает исключительной растворяющей способностью.
Диоксан хорошо растворяет жиры, минеральные и растительные масла, смолы, каучук, канифоль, мастику, воски, асфальт, ацетилцеллюлозу и нитроцеллюлозу.
Кроме того, диоксан растворяет также и неорганические вещества — бром, йод, фосфор, серу, хлористое железо, перман — ганат калия.
Диоксан растворяет многие вещества, употребляемые для фармацевтических и косметических целей, а также некоторые органические красители.
В смесях с органическими растворителями диоксан повышает их растворяющую способность.
Применение диоксана ограничено из-за его токсичности.
Пиридин df =0,9819, мол. вес. 79,098
СН.
|
‘ 5 З1 НсЬ. |
Уч
Нсгг ^сн
■ СН
N
Бесцветная гигроскопичная жидкость с резким неприятным специфическим запахом; 7,КИп
115,58° С, Гпл—41,8° С. Пиридин смешивается с водой и большинством органических растворителей во всех соотношениях. Структура пиридина установлена Дьюаром и Кернером в 1869 г.
Пиридин является типичным ароматическим соединением, имеющим секстет я-электронов, образующих, как и у бензола, единую замкнутую электронную систему. Однако благодаря специфическим свойствам атома азота пиридин значительно отличается от бензола по своим химическим свойствам. Заряд ядра азота на единицу больше, чем заряд ядра углерода, поэтому атом азота более электроотрицателен, чем атом углерода.
По сравнению с атомом углерода атом азота обладает большой электронопритягивающей силой и смещает общую плотность электронов в ароматическом ядре, особенно в положениях 2,4 и 6. Поэтому реакции замещения в пиридине протекают значительно труднее, чем в бензоле. Так, пиридин нитруется лишь при 300° С, образуя 3-нитропиридин с небольшим выходом: сн СН
Нс/сн 1>зоо — hc/V-no2 2——————————- + 2KN03 + H2S04 >-2 +
HcL ])сн нсЦУсн
N N
4- K, S04 + 2 11,0
Введение второй нитрогруппы в пиридиновое кольцо не удалось осуществить до настоящего времени.
Сульфирование пиридина производят дымящей серной кислотой в присутствии сернокислой ртути при 230° С в течение 24 ч; при этом получается пиридин-З-сульфокислота. Галоиди- рование пиридина также производится при высоких температурах. Бромирование пиридина при температуре 300°С приводит к образованию смеси 3-бромпиридина и 3,5-бромпиридина, а при 500° С — смесь 2-бромпиридина и 2,5-дибромпиридина.
Так же, как и бензол, пиридин устойчив к действию окислителей. Пиридин не окисляется хромовой и азотной кислотами и медленно окисляется перманганатом калия при нагрева-нии.
При гидрировании пиридина в спирте или каталитическом гидрировании над никелем образуется пипиридин:
|
N NH |
Введение аминогруппы в пиридин осуществляется сравнительно легко при нагревании с амидом натрия до 110°С (А. Е. Чи — чибабин, 1914 г.)
С СН СН
HCfScH Нс{ сн Н20 НС(Г сн
+ NaNH 2— Н — f — — i*- + NaOH
HCI^JCH 2 HClIJcNHNa HC<L Jc-NH,
N NN
Пиридин был впервые выделен Андерсеном в 1849 г. из костяного масла.
В настоящее время основным источником получения пиридина является каменноугольная смола, в которой содержится до 0,08% пиридина. При перегонке смолы пиридин концентрируется во фракции, называемые легким маслом. Из легкого масла смесь пиридинов («пиридиновые основания») извлекается разбавленной серной кислотой, выделяется щелочами и перегоняется.
Простой промышленный синтез пиридина пока еще не известен.
Пиридин разрушает ацетатное волокно.
Температура воспламенения пиридина 23,3° С, взрывоопасные концентрации его в воздухе 1,81—12,4 объемных процентов.
Пиридин очень токсичен, максимально допустимая концентрация его паров в воздухе 0,005 мг/л.
Чистый пиридин выпускают в соответствии с ГОСТ 2747-44. Он представляет собой бесцветную или слегка зеленовато-желтоватую прозрачную жидкость: DG =0,982—0,986; Гкип 114— 117° С.
Пиридин транспортируют и хранят в стальных бочках емкостью до 200 л или в стеклянных бутылях емкостью до 40 л. На таре должна быть надпись «Ядовито».
Пиридин — хороший растворитель, в том числе и для многих неорганических солей (AgBr, Hg2Cl2 и др.); по своей растворяющей способности превосходит бензол.
Крепкие водные растворы пиридина обесцвечивают красители, даже кубовые.
Из-за сильной токсичности применение пиридина на фабриках химической чистки ограничено.
 19 ноября, 2012
19 ноября, 2012  admin
admin 
 Опубликовано в рубрике
Опубликовано в рубрике 