Следует также упомянуть о возможности использования в качестве временных средств защиты ингибиторов, введенных в состав полимерных покрытий. Нами совместно с Рубинштейн разработан метод модифицирования полимерных покрытий ингибито
рами коррозии, который сильно повышает защитные свойства этих покрытий [213]. С помощью тонких пленок таких покрытий, можно защищать от атмосферной коррозии разнообразные изделия.
Пленки могут быть трех видов: легкоснимаемые, смывающиеся и постоянные. Последние при необходимости покрывают постоянными лакокрасочными покрытиями. Съемные покрытия не обладают адгезией к металлу, и поэтому, когда в них отпадает необходимость, легко снимаются с поверхности металла. Смывающиеся покрытия после выполнения защитных функций могут быть удалены с помощью органических растворителей или воды. Ниже приведен. перечень разработанных ТИПИ ЛКП ивгибитированных покрытий для временной защиты металлов от атмосферной коррозии, съемные: лак-ХС-596 — для защиты крупногабаритных изделий из черных и цветных металлов в условиях складского хранения; состав А-535 — для межоперационной защиты стали и цветных металлов; состав АК-535П — для межоперационной защиты окрашенных поверхностей (кроме нитроцеллюлозы); смывающиеся: составы ИС-1 и ИСМ-3 — для временной защиты черных и цветных металлов; постоянные: краска ГФ-570РК— для временной защиты стальных листов и проката (может быть использована в качестве грунта); эмаль 1181 (бывш. МС-596) — для временной защиты листового и фасонного проката.
В заключение приводим перечень (табл. 10,3) средств защиты металлов от атмосферной коррозии. Он поможет практикам в выборе наиболее эффективного средства и метода консервации изделий.
Интересующимся вопросами ингибирования, не нашедшими отражения в настоящей монографии, рекомендуем монографию
С. Шклярской-Смяловской [214], обзорные доклады Фиджи [215], а также труды европейских симпозиумов по ингибиторам [216].
|
||
|
||
|
 |
|
|
||
|
||
|
||
|
||
|
||
|
П р о д о л ж е н и е
|
5. Ингибитор нитрит Сталь и чугун всех марок натрия
 а. Водные растворы (20—
а. Водные растворы (20—
45%)
б. Вязкие водные растворы (6-30%)
6. Ингибитор бенз — Медь и медные сплавы триазол (0,15—
1,0%)
IV. Порошки ингибиторов
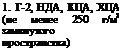
![]()
Распыление, подвешивание мешочков из неплотной бязи с порошком ингибитора в упаковочном пространстве
![]()
V. Ингибитиро ванный воздух
(ингибиторы: НДА,
КЦА, ИФХАН-1)
Продувка воздуха, насыщенного парами ингибитора, получаемого в специальных установках
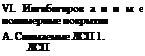
![]()
![]()
![]()
![]()
Сталь; сталь с металлическими и неметаллическими неорганическими покрытиями; все цветные металлы Сталь; чугун; сталь и чугун с металлическими и неметаллическими неорганическими покрытиями; алюминий и его сплавы, не содержащие медь
Сталь; сталь с металлическими и неметаллическими покрытиями; все цветные металлы
Сталь; чугун; сталь и чугун с металлическими и неметаллическими неорганическими покрытиями; алюминий и его сплавы; медь и ее сплавы
Черные и цветные металлы и сплавы
Черные и цветные металлы и сплавы
Окунание или нанесение кистью (толщина слоя 100 мкм); распыление (толщина слоя 60 мкм) Окунание в расплав при температуре 160—190 °С
Распыление (толщина слоя не менее 80 мкм)
Окунание или нанесение кистью (толщина слоя 100—150 мкм) для марки А
Распыление или окунание (толщина слоя 10— 20 мкм) для марок Б, В Окунание или распыление
Окунание и распыление
|
|||
|
|||
|
|
||
|
|
||
|
|
||
|
|||
|
|||
|
|||
[1] Здесь и далее потенциалы приводятся по отношению к нормальному водородному электроду.
[2] Этот метод правильнее было бы, очевидно, назвать методом внутренней анодной поляризации, поскольку и при внешней анодной поляризации пассивация возникает в результате химической реакции, развивающейся на поверхности металла.
[3] КРП следует отличать от внутренней разности потенциалов, развивающейся на границе соприкосновения этих металлов.
[4] Делается допущение, что для монослойного заполнения требуется молекул на 1 см2.
[5] Метод КРП, позволяющий измерить поверхностный потенциал вне электролита, исключает (возможные изменения в двойном электрическом слое и фиксирует, таким образом, лишь изменения в металле.
[6] Возможно, что здесь сказывается влияние воды.
[7] Необходимость измерения VK в 1 н. Na2S04 вызвана тем, что в 0,1 н. Na2S04 после + 0,8 В наблюдается пробой окисной пленки.
[8] Здесь исключаются крайние случаи, когда не происходит дифференциации электродных реакций по поверхности или когда. металл полностью запассивирован.
[9] При идеальной поляризуемости весь подводимый ток тратится на перестройку двойного слоя. На электрохимическую реакцию ток не расходуется.
[10] (П)—регулятор ценообразования.
[12] Технологические процессы глубокого травления титановых сплавов, включая и высокопрочные, в подобных средах, которые не приводят к наводорожива — нию сплавов, были разработаны Розенфельдом совместно с Бабкиным [135].
[13] Перед травлением окалина разрыхляется © электролите (200 — f- 250 г/л) +КМп04 (40—50 г/л); Г=80°С; *=30 мин.
[14] Имеется в виду коррозионная активность, определяющаяся лишь агрессивными свойствами двуокиси углерода. Содержание С1~ и SO|~ не учитывается.
[15] При защите от коррозии необходимости в удалении кремниевой кислоты нет (см. стр. 184).
[16] Испытание воды на склонность к образованию накипи, а также методы кислотной обработки регламентирует ГОСТ 3313—46.
[17] Тринатрийфосфат испытывается только в системах охлаждения автомобилей «Урал-355», где нет алюминиевых деталей.
[18] Растворимость определена при парциальном давлении газов 0,1 МПа.
Содержание сероводорода во многих газовых месторождениях составляет 5-4-10% (масс.), а его концентрация в водном конденсате достигает 250—500 мг/л. Если учесть, что кроме сероводорода в природном газе часто содержится и двуокись углерода, которая также подкисляет электролит, то можно уверенно утверждать: основная часть сероводорода, абсорбирующегося водным или углеводородным конденсатом, находится не в ионной, а в молекулярной форме. На основании этих фактов многие выдвинутые до сих пор теории, связывающие механизм усиления сероводородной коррозии с каталитическим действием гидросульфидных и сульфидных ионов, оспариваются, поскольку объяснить происхождение этих ионов в электролите невозможно. Между тем конечными продуктами коррозии стали являются сульфиды железа, которые не могут в принципе возникнуть за счет неионного взаимодействия. Что же касается реакции Fe+H2S—>FeS+2H+, к которой часто прибегают для описания механизма сероводородной коррозии и водородного охрупчивания, то она не отражает истинный механизм процесса и сильно упрощает картину. В связи с этим Гоник [191, с. 52] и другие исследователи высказывают мнение, что механизм
 12 сентября, 2015
12 сентября, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 