Ацетон (диметилкетон, пропанон) df = 0,7908; мол. вес 58,08
СН;,—С-СН;,
II
О
Ацетон — простейший кетон, бесцветная, прозрачная, легкоподвижная жидкость с характерным запахом. Смешивается в любом соотношении с водой, спиртом, эфиром, бензином и другими органическими растворителями, Гкип 56,24° С; Гпл —95,35° С.
Ацетон обладает типичными химическими свойствами кето- нов. Он с трудом окисляется, каталитически восстанавливается до изопропилового спирта. При восстановлении ацетона щелочными реагентами и в особенности амальгамами магния или цинка происходит конденсация и восстановление, завершающиеся образованием пинакона
СН3—СО—CHS Hg ^ сн3—СОН—сн3 Сн3—со— сн3 сн3—сон—сн3
Ацетон окисляет вторичные спирты в кетоны в присутствии Трет-Бутилата алюминия (реакция Оппенауэра)
ПснзЬ-со] А1 Rx
Снон + сн3—с—сн3 Ь > с=о + сн3—сн—сн3
R II R’ I
О ОН
При применении большого избытка ацетона реакция сдвигается вправо.
Ацетон вступает в различные ракции конденсации.
При альдольной конденсации [6] происходит образование ди — ацетонового спирта, который применяют в качестве растворителя
СН., NaOH СН,
^с=о + сн3-с-сн3—————— >- х-сн2-с-сн3
II сн^ «
При кротоновой конденсации [7] последовательно получается окись мезитила, а затем форон. Окись мезитила используют для снижения летучести растворителей для лакокрасочных покрытий.
СН3 ___________ (COOH)s СН3
О +TQCH~C-CH3 ‘ > ^С=СН-С-СН3 + НгО
О
|
СН8′ £ сн/ £ |
Окись мезитилй
|
———- ё> Ч™, 150-170° |
|
Н2 + О |
СН3 /СН3 NaOH
TOC o "1-3" h z СН, /СН3
—— С = С н — С — С н—с + н2о
Форон
При конденсации трех молекул ацетона под действием концентрированной серной или соляной кислоты образуется симметричный триметилбензол или мезитилен
/СНз /СН
СН3—СО СО—СН3 СН3 — С С-СНз
I V II I + зн2о
I I
При конденсации с ацетиленом ацетон образует диметил — карбинол, который легко переводится в изопрен:
СН, 5%NaOH НСЗГ СН3 н
С=о + СН=СН—————- >■ хс —-—►
Сн3у 95-100° но’ хсн3
3-метил-3-5цтинол
ХСН3 ц„яо,
—- >■ Н2С = СН —С Н.;С=СН-С = СНг + н2о
I хсн3 * I
При конденсации ацетона с формальдегидом в присутствии небольших количеств щелочей образуется ацетоспирт, который при действии йода или кислот при нагревании легко отщепляет воду, переходя в метилвинилкетон:
СН3 —СО — СН3 + СНоО ——- >■ сн3—со—сн2—сн2он—— >-
——► С Н; J—со — с н = с н 2 + н2О
При конденсации уксусноэтилового эфира с ацетоном получается ацетилацетон:
CH3COOC2H5"+ СН3—СО—СН3—— >- СН3—CO—CH2—CO—СН;(+ С2Нг, ОН
Одной из наиболее важных реакций ацетона является присоединение к нему синильной кислоты, в результате чего получается ацетонциангидрин:
Сн3^ СН;, ^ОН
^С = 0 + HCN————- > ^с
• СН3 СНз CN
|
СНз CN С11 |
Ацетонциангидрин превращается в эфир а-метакриловой кислоты (мегилметакрилат) при одновременном гидролизе, дегидратации и этерификации метиловым спиртом в присутствии серной кислоты:
+ СНзОН + H2S04——- СН2=С-СООСН3 + N11.11 ISO.)
3
Р4
Метилметакрилат является ценным продуктом для производства высокополимеров. Ацетон реагирует с аммиаком и водородом в присутствии никеля или меди, образуя амины:
Ni •
СН3—СО—СНЯ + NH, + Н2———- ->- СНз—СН—СН3 + НГО
Nh2
Бцтиламин
Реакция обычно проходит при температуре 125—175° С и давлении 5—10 ат.
При действии на ацетон металлического натрия или амида натрия получается ацетоннатрий, представляющий собой натриевый алкоголят изопропенилового спирта:
2СНа—СО-СН3+ 2Na———- >■ 2СН2 = С — СН3 + Н2
ONa
СН3—СО—СНз + NH2Na ———- VCH2 = C-CH3 + NH3
ONa
При пиролизе ацетона (500—700° С) над глиноземом или на раскаленной электрическим током платиновой проволоке в специальном приборе, называемым кетенной лампой, получается простейший кетен: _•■]
СН3—С-СНз——— >- СН2= С —
II |
|
->- сн2=с=о + сн4 |
|
СНз Н |
В присутствии щелочей ацетон легко реагирует с галоидами с образованием хлороформа, йодоформа и бромоформа:
CH3-CO-CH3 + 4NaOH + 3CI2 ————— ►
—>- СНС13 + CH3COONa + 3NaCl + 3 НгО
Ацетон также присоединяет хлороформ, образуя хлоретон, применяющийся в качестве антисептика:
СНз СНз /С С13
С=0 + CHCI3————- >■ ^С
С Н ъ 011
№
В промышленности ацетон получают следующими способами.
1. Сухой перегонкой древесины или при термическом разложении уксуснокальциевой соли (уксусный порошок), являющейся продуктом сухой перегонки древесины
;са ——— —> ^С=0 + СаСОз
2. Биохимическим способом при ацетоно-бутиловом брожении Сахаров (из кукурузы, зерна, патоки)
2СеН,2Ов—— ► СН3—СО-СН3 + СН3(СН2)зОН + 5С02 + 4 Н2
3. Каталитическим разложением паров уксусной кислоты при повышенной температуре (400—450°С); катализаторы — углекислый кальций или барий, окиси кальция, алюминия, тория, урана, цинка, соли марганца и др.
2 СН3СООН—— СН3—СО—СН3 + со2 + н2о
4. При каталитическом дегидрировании паров этилового спирта при температуре 450—500° С; катализаторы — окись железа, активированная известь и др.
С2Н5ОН—— >- СН3С^ + н2
Н
Ацетальдегид
2СН3С^ +н20————— СН3-СО-СН3 + С02 + 2Н,
Н
5. При каталитическом окислении пропана кислородом воздуха
4 00°
СЯН8 + о2———— >■ СН3—СО-СН, + н2о
6. Основным промышленным способом получения ацетона из сырья нефтяного происхождения является дегидрирование или окисление воздухом изопропилового спирта.
Сырьем для получения изопропилового спирта служит пропилен (получение изопропилового спирта см. на стр. 56).
Дегидрирование изопропилового спирта:
СН3 СН3
^СНОН————— ► ^с = 0+ Н2—16.7 к к ал
СНз СНз
Дегидрирование проводят в паровой фазе при температуре 350—400° С над катализатором из окиси цинка, который получают нагреванием пемзы, пропитанной ацетатом цинка. В качестве катализатора может применяться также ZnS или сплав цинка и железа.
Вследствие эндотермического характера реакции процесс ведут обычно в трубчатом реакторе, узкие длинные трубки которого обогреваются дымовыми газами. Производительность процесса увеличивается при повышенных давлениях (около 2,7— 3,4 ат).
Активность катализатора постепенно снижается, так как на его поверхности отлагается сажа и смолистые вещества. Регенерация катализатора заключается в выжигании углеродистых отложений кислородом, разбавленным инертными газами. Срок службы катализатора составляет около 6 месяцев.
Отходящие газы конденсируются и промываются водой для отделения ацетона и спирта от водородного потока, затем ацетон извлекается перегонкой. Одним из преимуществ этого метода по сравнению с методом окисления изопропилового спирта, который описывается ниже, является получение водорода в качестве побочного продукта.
Окисление изопропилового спирта:
СН3 , СН3
СНОН + Ц,02——- > "Гс=0 + Н20 + 43 ккал
СНз СН3
В качестве катализатора применяется серебро, медь, никель, платина и др.
В этом процессе воздух, насыщенный парами изопропилового спирта, пропускается над тонким слоем катализатора при температуре 400—650° С. Продукты реакции быстро охлаждают, и конденсат после нейтрализации небольших количеств уксусной кислоты дистиллируют. Выделенный технический ацетон ректифицируют, а непрореагировавший изопропиловый спирт
Возвращают на окисление. Окисление изопропилового спирта может сопровождаться побочными реакциями:
СН3
^СНОН + 4Цо2——— >■ 3 С02 + 4НоО
/СНОН—— >-СН3-СН=СНо + н2о
СНз^
СН3
^снон + Цо2—>~сн4 + СН3СООН
СН3
Реакция окисления изопропилового спирта высоко экзотер — мична и с трудом поддается контролю. Поэтому рекомендуется в одной реакции объединять и окисление, и дегидрирование, с тем чтобы суммарный тепловой эффект приближался к нулю.
7. Получение ацетона из ацетилена основано на пропускании смеси ацетилена и водяного пара над катализатором из окиси железа или окиси цинка, нанесенными на стальные шарики, при температуре 470° С.
Реакция протекает по уравнению:
2 СН=СН + ЗН20—— ►СНз—СО-СН3 + С02 + 2Н2 +40 ккал/моль.
Процесс проходит через следующие стадии:
/Р Н20
Сн=сн + н, о—>■ сн3с’ ———- ► сн3соон + н2
Н
2CH3COOH—► сн3—со—сн3 + со2 + н2
Ацетилен и водяной пар смешивают в объемном отношении 1 : 10 и пропускают над катализатором. Продукты реакции промывают водой, а затем подвергают перегонке. Выход ацетона из ацетилена составляет 85%.
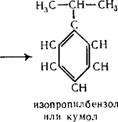
8. Кумол — гидропероксидный способ.
Этот способ также является одним из основных промышленных способов получения ацетона, он на 40% дешевле способа получения ацетона из изопропилового спирта. Исходными продуктами служат бензол и пропилен.
Алкилирование бензола пропиленом производят в присутствии катализатора хлористого алюминия при температуре 50° С. В качестве катализаторов использовали также концентрированную серную кислоту, фтористый водород, фтористый бор и др.
|
|
|
+ сн,-сн=сн2 Сн 3 |
Окисление кумола проводится кислородом воздуха при 4— 5 ата и 110—120° С, при этом получается гидроперекись кумола.
ООН I
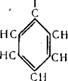
|
(Лен |
НзС—СН—СНз н3с—с—сн3
С
НС ‘
! I + °2
Ней Усн
V
Сн
Гидроперекись кумола при температуре 30—60° С в присутствии примерно 0,1% серной кислоты разлагается на фенол и ацетон:
|
|
ООН
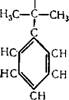
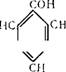
|
СП, + /С=0 СП, |
|
3(1-60" [1С1 сн |
H2SO4
Кумолпероксидный способ разработан П. Г. Сергеевым-, Б. Д. Кружаловым, Р. Ю. Удрисом и впервые осуществлен в промышленном масштабе в Советском Союзе.
9. Одним из новейших способов получения ацетона является совместное получение ацетона и перекиси водорода путем неполного окисления изопропилового спирта кислородом воздуха при температуре 105—110° С и давлении 25 ата.
Н3С СН3
Продукты реакции разбавляют водой и отгоняют из них ацетон и непрореагировавший изопропиловый спирт. Перекись водорода получается в виде 6—10%-ного водного раствора.
10. Другим новым способом является способ прямого окисления пропилена в присутствии воды или водяного пара и хлористого палладия или хлористой меди.
Эта реакция протекает следующим образом:
СН3—CH=CH2 + PdCl2 + Н20 —СН3—-С —CH3 + Pd + 2 НС]
О
Pd + 2 CuCl2 —>- Pd CI 2 + 2 Си CI
2 Си CI + 1’/2 02 + 2 HCI ——- »-2CuCl2 + H20
Суммарно реакция получения ацетона выглядит так:
PdCl, ; CuCl2
СН3-СН=СН2 +1>/2 о2 —————— ——— 1—— СН3-С-СН3
Преимущество этого способа состоит в том, что ацетон получают в одну стадию окислением олефина. Высокая избирательность процесса позволяет осуществить его с минимальным количеством побочных продуктов. Выход ацетона составляет 92— 94%.
Этот способ экономически выгоден. Относительная себестоимость ацетона, полученного дегидрированием изопропилового спирта 100%, кумолпероксидным способом 50—60%, прямым окислением пропилена — 35%.
На текстильные волокна ацетон не действует, за исключением ацетатных, которые растворяет.
Ацетон огнеопасен, температура воспламенения 20°С; пределы взрываемости смесей с воздухом 2,55—12,80% (объемные).
Ацетон малотоксичен, предельно допустимая концентрация паров в воздухе 0,2 мг/л.
Технический ацетон выпускается по ГОСТ 2768-44 I и II сортов.
Содержание кетона в продукте I сорта—98%, II сорта — 96%, плотность dj° в пределах 0,790—0,795.
Использование ацетона II сорта допускается только для производства органического стекла.
Ацетон разливают в оцинкованные или стальные бочки и стеклянные бутыли. Бутыли закупоривают корковыми или деревянными пробками с пергаментом. На таре должна быть этикетка «Огнеопасно».
Ацетон технический для розничной продажи выпускают в соответствии с ТУ МХП ОШ 263—54 в бутылках емкостью по 0,1 и 0,25 л.
Ацетон — превосходный растворитель жиров, масел, многих смол, нитролаков, сургуча, канифоли.
Ацетон растворяет также целлулоид, нитро — и ацетилцеллю — лозу. Каучук, пек и мастиковые смолы не растворяются в ацетоне.
Благодаря своей малой токсичности, хорошей растворяющей способности ацетон находит очень широкое применение на предприятиях химической чистки.
 19 ноября, 2012
19 ноября, 2012  admin
admin 
 Опубликовано в рубрике
Опубликовано в рубрике 