![ФОСФАТЫ Подпись: Фосфаты широко применяются в качестве ингибиторов коррозии, в особенности в водоснабжении, охладительных системах и энергетических установках. О защитных свойствах монофосфатов в пресной воде можно судить по данным [101], приведенным в табл. 5.4.](/img/1208/image233.gif) |
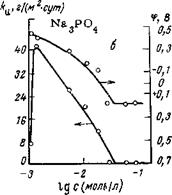
Из таблицы видно, что с увеличением концентрации Na2HP04 и особенно Na3P04 скорость коррозии сильно уменьшается (у = = 16-1-50). Однозамещенный фосфат натрия NaH2P04 является слабым ингибитором, а при больших концентрациях он превращается в стимулятор коррозии. Защитные свойства фосфатов находятся в прямой зависимости от pH, которое они создают: три- натрийфосфат, имеющий наиболее щелочную реакцию, лучше защищает сталь от коррозии, чем двузамещенный фосфат. Слабые
 |
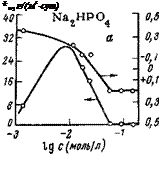 |
Рис. 5,30. Влияние добавок фосфатов к 0,1 н. Na2S04 на истинную скорость
коррозии и электродный потенциал стали.
защитные свойства однозамещенного фосфата обусловлены подкислением среды в результате его гидролиза.
Фосфаты Na3P04 и Na2HP04, как показали наши исследования, способны при концентрациях, не обеспечивающих полную защиту, увеличивать истинную скорость коррозии (рис. 5,30), что связано с частичной пассивацией электрода, приводящей к смещению потенциала электрода в положительную сторону [102]. Однако это смещение потенциала не так велико, чтобы вывести потенциал стали за потенциал полной пассивации, поэтому истинная скорость коррозии увеличивается. При достаточных концентрациях фосфатов коррозия полностью подавляется.
Исследование состава защитных пленок, образующихся на стали в присутствии фосфатов, методом электронной дифракции показало, что пленки состоят из смеси y-Fe2C>3 и FeP04-2H20 при использовании Na2HP04 и y-Fe203 со следами FeP04-2H20 при использовании Na3P04 [103].
В последние годы широко используют в качестве ингибиторов полифосфаты, их применяют в США для обработки естественных
|
Таблица 5,4. Скорость общей коррозии k0 стали Ст. 45, защитный эффект у и pH растворов фосфатов
|
вод, а также для защиты охладительных циркуляционных систем как от коррозии, так и от отложения солей кальция [104]. Полифосфаты получают в результате термической дегидратации МаНгНРС^ и считают, что они имеют состав гексаметафосфата натрия (ЦаРОз)б-
Розенштейн [105] первым обнаружил, что добавление к воде ничтожных концентраций полифосфата предотвращает осаждение карбонатов кальция из естественных вод, а уже в 1956 г. свыше 200 муниципалитетов в США предпочли в коммунальном водоснабжении применять полифосфаты для предотвращения коррозии, карбонатных отложений, а также для стабилизации растворенных в воде железа и марганца. Минимальная концентрация полифосфата, необходимая для предотвращения коррозии малоуглеродистых сталей, зависит от состава воды и скорости ее движения. Для обработки пресных вод и вод, содержащих хлориды, применяют обычно от 0,5 до 100 мг/л, однако в большинстве случаев ограничиваются 10 мг/л или еще меньшими концентрациями. Полифосфаты эффективны также при защите от коррозии стали в морской воде 4000 мг/л).
Большинство исследователей считают, что полифосфаты наиболее эффективны в движущейся воде. Однако в работе [104] сообщается, что удалось защитить от коррозии сталь в неподвижном электролите (2500 мг/л NaCl), введя в его состав 140 мг/л гексаметафосфата натрия (ГМФ) и 100 мг/л солей кальция в расчете на кальций. Для электролита, содержавшего 25000 мг/л NaCl, потребовалось 210 мг/л гексаметафосфата (в пересчете на NaP03) и 500 мг/л кальция.
Ионы двухвалентных металлов, в частности кальция, обеспечивают более действенную защиту полифосфатами. Поскольку кальций неизменно присутствует в естественных водах, то добавлять его обычно не приходится. Отношение концентрации ионов кальция к полифосфату должно равняться по крайней мере 0,2, предпочтительнее 0,5. Добавление солей кальция необходимо лишь в случае конденсата нли мягких вод. Цинк более эффективен, чем кальций, хотя последний все же необходим. Нужно иметь также определенную концентрацию кислорода в воде: в отсутствие кальция минимальное содержание кислорода в воде должно быть 1 мл/л, при наличии же кальция концентрация кислорода может быть снижена до 0,15 мл/л. Оптимальное значение рН = =5-f-7. В более щелочных средах полифосфаты могут привести к точечной или питтинговой коррозии.
Преимущества полифосфатов перед другими ингибиторами состоят в том, что они нетоксичны и обеспечивают защиту при малых концентрациях. К недостаткам полифосфатов следует отнести способность к превращению в ортофосфат, который способствует карбонатным отложениям. Однако в дистиллированной воде при комнатной температуре в течение 30 суток превращается в ортофосфат лишь 10% полифосфата. При 85°С и рН=7-ь9 защитное
действие полифосфатов сохраняется в течение 24 ч. При 99 9С максимальное количество полифосфата, превращающегося в ортофосфат, достигает за 6 ч 40%. Стабильность полифосфатов падает с уменьшением pH и в присутствии кальция.
![]()

 Механизм действия полифосфатов является довольно
Механизм действия полифосфатов является довольно
СЛОЖНЫМ, (ПОСКОЛЬКУ они выполняют двоякую роль — защищают металл от коррозии и предотвращают отложение карбонатов кальция. Исследование влияния гексаметафосфата натрия (ГМФ) на электродный потенциал стали показало [46], что он сильно сдвигает потенциал в отрицательную сторону (рис. 5,31). Экспериментально подтверждено, что этот полифосфат преимущественно замедляет скорость
катодной реакции. Со временем наблюдается некоторое смещение потенциала в положительную сторону, что связано, очевидно, с повышением прочности защитной пленки, замедляющей частично и скорость анодной реакции.
Гексаметафосфат натрия обладает способностью создавать с ионами кальция и другими ионами металлов растворимые комплексы, в результате чего ионы кальция, а также железа удерживаются в растворе. Именно это предотвращает образование карбонатных отложений кальция и железа, ухудшающих теплопередачу. При избытке ионов кальция образуется труднорастворимое соединение Ca5(P3Oio)2 [104], поэтому необходимо строго соблюдать соотношение концентраций полифосфата и ионов кальция.
Для предотвращения накипеобразования и выпадения железа в виде карбонатов наиболее эффективными полифосфатами являются гексаметафосфат натрия и метатриполифосфат Na5P3Oi0. При их взаимодействии с солями кальция образуются растворимые комплексные соединения
Са2+ + Na6P6018 ч=> Na4CaPe018 + 2Na+
Для полного комплексообразования необходим некоторый избыток полифосфата. Назначение последнего — сдвинуть диссоциацию комплекса настолько, чтобы удержать возможно большее число ионов кальция в комплексе. Некоторые авторы [106] объ-
ясняют уменьшение накипеобразования адсорбцией полифосфатов на кристаллических плоскостях, вызывающей прекращение роста кристаллов. Полифосфаты частично входят в состав пленок, возникающих на поверхности металла, и улучшают их защитные свойства. Эти пленки состоят в основном из у-РегОз, поэтому не ухудшают теплопередачу и защищают металл от коррозии.
Шклярска-Смяловска с сотр. [107] считает, что даже в присутствии кислорода и ионов кальция полифосфаты непосредственно не являются ингибиторами. Защитные свойства проявляют лишь продукты гидролиза (НРОІ-), которые вместе с ионами гидроксила, возникающими на электроде при восстановлении кислорода, способствуют отложению фосфата кальция на металле по реакции
2НРОІ- + 20Н" + ЗСа2+ —— >- Са3(Р04)2 + 2Н20 (5,11)
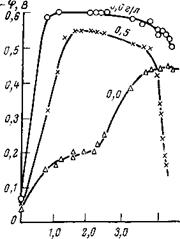
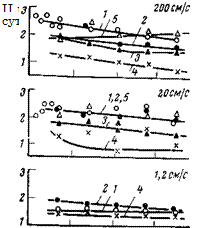
Влияние гексаметафосфата натрия на коррозию малоуглеродистой стали показано на рис. 5,32 и 5,33. Как видно, этот ингибитор существенно замедляет коррозию как в растворе, содержащем малые концентрации хлорида (25 мг/л NaCl), так и растворах, содержащих большие концентрации хлорида (2500 мг/л NaCl) (рис. 5,33). Защитный эффект возрастает при наличии в электролите ионов кальция и цинка, а также с увеличением скорости размешивания электролита. В отсутствие двухвалентных ионов скорость коррозии стали в присутствии Na2HP04 возрастает (см. рис. 5,32. кривая 5). Это весьма интересно, поскольку ортофосфат является продуктом превращения гексаметафосфата. В присутствии ионов двухвалентных металлов отрицательное влияние ортофосфата ослабевает и требуются меньшие концентрации (NaP03)6 для защиты стали от коррозии (см. табл. 5,5).
Особого внимания заслуживают результаты, полученные в концентрированных растворах хлоридов (близких к морской воде). При повышении концентрации ионов кальция от 100 до 500 мг/л скорость коррозии, равная ~3 мг/(дм2-сут), достигается при снижении концентрации полифосфата с 400 до 140 мг/л. Минимальное отношение кальция к фосфору равнялось 0,8-М,0, что близко к ранее найденному значению 0,7 и соответствует отношению кальция к гексаметафосфату не менее 0,2.
С увеличением скорости движения воды защитный эффект гексаметафосфата в сочетании с ионами кальция возрастает. В разбавленном растворе хлорида (25 мг/л) поддержание концентрации гекса метафосфата на уровне 12 мг/л и кальция на уровне 8 мг/л обеспечивает 93%-ную защиту при скорости движения электролита, равной 200 см/с (см. рис. 5,32). При этой же скорости движения электролита в концентрированных растворах хлоридов (2500 мг/л) (см. рис. 5,33) скорость коррозии стали снижается с 2000 мг/(дм2-сут) до 100 мг/(дм2-сут) при относительно небольших концентрациях гексаметафосфата, а также кальция или цинка.
 |
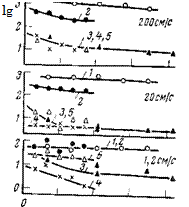 |
Рис. 5,32. Скорость коррозии малоуглеродистой стали в растворе, содержащем
25 мг/л NaCl (фон) и различные концентрации гексаметафосфата натрия (ГМФ)
‘(7=35 сут):
/ — фон; 2—10 мг/л ГМФ (поддерживалась постоянно); 5—100 мг/л ГМФ (добавлено в на-
чале опыта); 4—12 мг/л ГМФ-І-8 мг/л кальция (поддерживались постоянно); 5 — 25 мг/л
Na2HP04 (добавлено в начале опыта).
Рис. 5,33. Скорость коррозии імалоуглеродистой стали в растворе, содержащем
2500 мг/л NaCl (фон) и различные концентрации гексаметафосфата натрия
(/ = 35 сут; ингибиторы добавляли в начале опыта):
/ — фон; 2—100 мг/л ГМФ; 5—100 мг/л ГМФ+60 мг/л Са; 4—100 мг/л ГМФ+60 мг/л Zn;
5 — 50 мг/л ГМФ+30 мг/л Са.
В тех случаях, когда защита эффективна (наличие соответствующих концентраций гексаметафосфата и ионов кальция или цинка), поверхность стали покрывается тонкой вязкой пленкой. Состав пленки, возникшей на металле в электролите, содержащем 2500 мг/л NaCl, 100 мг/л ГМФ и 60 мг/л кальция в течение 84 сут, соответствовал комплексному соединению метафосфата натрия состава (NaH)FeCa(P03)5*8H20.
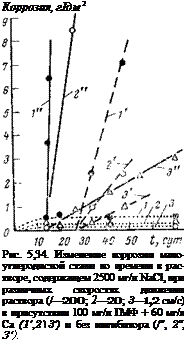
Исследования Бутлера [104] показали, что с помощью гексаметафосфата натрия и солей кальция можно приостановить и начавшуюся коррозию (рис. 5,34). При этом сформировавшаяся на поверхности стали пленка сохраняет свои защитные свойства в течение определенного времени (14 сут) и в том случае, когда образец переносится в неингибированный электролит. Это означает, что фосфаты обеспечивают эффект последействия, т. е. нет необходимости в постоянной подаче ингибитора. Опыты (И, 2 3′, рис. 5,34) были поставлены таким образом, что из 27 сут образцы находились 13 сут в электролите с ингибитором и 14 сут в электролите без ингибитора.
Относительно возможного механизма усиления полифосфатами коррозии высказывается следующая точка зрения: в отсутст
вие ионов двухвалентных металлов (Са, Zn) гексаметафосфат может выступить как в качестве ингибитора, так и стимуляторсш коррозии. Если скорость движения в электролите невелика, а концентрация ингибитора мала, проявляются в основном комплексообразующие свойства гексаметафосфата. Это должно ускорять анодную реакцию, а следовательно, и коррозию. Когда концентрация гексаметафосфата увеличивается, предел растворимости комплекса хможет быть превзойден и на поверхности металла осаждается пленка, замедляющая анодную реакцию.
 Сравнивая защитные свойства полифосфатов (ГМФ) с хроматами и нитритами, Бутлер [104] приходит к выводу, что полифосфаты имеют значительные преимущества. Хотя в чистой воде защитные концентрации хромата и нитрита натрия ниже, чем у гексаметафосфата, в растворах хлоридов положение меняется (табл.
Сравнивая защитные свойства полифосфатов (ГМФ) с хроматами и нитритами, Бутлер [104] приходит к выводу, что полифосфаты имеют значительные преимущества. Хотя в чистой воде защитные концентрации хромата и нитрита натрия ниже, чем у гексаметафосфата, в растворах хлоридов положение меняется (табл.
5,5).
Как видно, применяя гексаметафосфат натрия в комбинации с кальцием, можно получить защиту при гораздо меньшей суммарной концентрации этих ингибиторов по сравнению с хроматом и нитритом натрия.
В заключение приведем сводную таблицу (табл. 5,6) с данными о защитных концентрациях исследованных неорганических ингибиторов. Обращают на себя внимание низкие значения за-
|
Таблица 5,5. Защитные концентрации хромата, нитрита и гексаметафосфата натрия для стали в растворе NaCI
|
|
Таблица 5,6. Защитные концентрации неорганических ингибиторов в 0,1 н. Na2S04 для стали
|
щитных концентраций для ингибиторов, образующих труднорастворимые соединения, и почти одинаковые значения защитных концентраций для ингибиторов, содержащих общий анион типа MOf^, за исключением метаванадата.
 30 августа, 2015
30 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 