§ 1. ХРОМАТЫ
Хроматы давно применяются в качестве ингибиторов коррозии, поскольку обладают высокой защитной способностью и могут защищать от коррозии практически все важные металлы. До последнего времени, пока не были открыты универсальные защитные свойства солей нитробензойных кислот [38], хроматы были единственными соединениями, используемыми для защиты от коррозии одновременно черных и цветных металлов.
Скорость коррозии стали в разбавленном электролите 30 мг/л NaCl + 70 мг/л Na2S04 резко падает уже при введении небольшого количества бихромата. При концентрации 6,2-10~3 моль/л бихромата коррозия полностью приостанавливается.
Несколько иное положение с частично погруженными образцами: при наличии ватерлинии требуется большая концентрация ингибитора, чтобы приостановить коррозию, которая развивается преимущественно у поверхности раздела, т. е. на границе трех фаз. В этом случае приостановить коррозию удается при концентрациях ингибитора 20004-3000 мг/л, однако всегда имеется опасность, что из-за расхода ингибитора в зоне мениска коррозия вдоль ватерлинии возобновится. Поэтому такие системы лучше всего защищать комбинированным методом, включающим применение протекторов и ингибиторов.
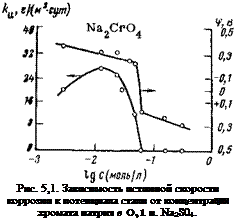
Хроматы как анодные ингибиторы способны при неполной защите увеличивать интенсивность коррозии, что можно видеть из рис. 5,1. Зависимость интенсивности коррозии от концентрации хромата калия выражается кривой с максимумом. Иными словами, имеется критическая концентрация, ниже которой интенсивность коррозии непрерывно возрастает с концентрацией ингибитора. При увеличении концентрации ингибитора за критическое значение интенсивность коррозии начинает падать и при 0,062 моль/л достигается полная защита. Бихромат калия, а также другие неорганические хроматы изменяют общую коррозию и ее интенсивность по такому же закону, как и хромат калия. Однако защитная концентрация у бихромата как более кислого реагента для стали почти в 3 раза выше, чем у хромата. Для алюминия же более эффективен бихромат. Защитные концентрации хроматов по отношению к стали
0,1 н. Na2S04 приведены ниже:
Хромат…………………………. Na2Cr04 К2Сг207 1л2СЮ4 (NH4)2Cr04
с, моль/л……………………….. 0,062 0,170 0,067 0,052
В дистиллированной воде защитная концентрация хромата калия, по данным [97], не превышает 10~4-М0~3 моль/л. В этой же работе сообщается, что в электролитах, не содержащих агрессивные ионы, коррозия носит более или менее равномерный характер и опасность локализации процесса не столь велика, как полагали ранее. Не обнаружено также особого влияния метода подготовки поверхности (полировка, травление, дробеструйная обработка) на защитную концентрацию ингибитора.
В связи с наметившейся тенденцией использовать органические хроматы в качестве ингибиторов в полимерных покрытиях, а также в других системах появился интерес к исследованию их защитных и пассивирующих свойств. Нами изучены хроматы цианамида, гуанидина, метиламина, диметиламина, изопропиламина, триметиламина, диэтиламина, н-пропиламина, изопропиламина, изобутиламина, дициклогексиламина, циклогексиламина [общей формулы Иг-НаСгО^ где R — амин].
 О защитных свойствах органических хроматов можно судить по свойствам хромата циклогексиламина, типичного представителя этого класса ингибиторов (рис. 5,2). Как видно, в дистиллированной воде защита достигается при весьма малой концентрации ингибитора. Для хромата циклогексиламина она равна ~5-10-4 н. С увеличением концентрации сульфата коррозия в не полностью ингибированных средах возрастает и защитные концентрации ингибиторов растут. В 0,1 ,н. Na2S04 защитная концентрация хромата циклогексиламина равна ~7-10~2 н. Аналогичная картина наблюдается и в присутствии хлоридов, за исключением того, что при относительно высоких концентрациях хлорида (0,01 н. и 0,1 н.) для полной защиты требуются более высокие концентрации ингибитора, чем в сульфате.
О защитных свойствах органических хроматов можно судить по свойствам хромата циклогексиламина, типичного представителя этого класса ингибиторов (рис. 5,2). Как видно, в дистиллированной воде защита достигается при весьма малой концентрации ингибитора. Для хромата циклогексиламина она равна ~5-10-4 н. С увеличением концентрации сульфата коррозия в не полностью ингибированных средах возрастает и защитные концентрации ингибиторов растут. В 0,1 ,н. Na2S04 защитная концентрация хромата циклогексиламина равна ~7-10~2 н. Аналогичная картина наблюдается и в присутствии хлоридов, за исключением того, что при относительно высоких концентрациях хлорида (0,01 н. и 0,1 н.) для полной защиты требуются более высокие концентрации ингибитора, чем в сульфате.
На кривых (рис. 5,2) отсутствуют максимумы, обычно проявляющиеся на кривых скорость коррозии — концентрация ингибитора. Дело в том, что в данном случае определяли скорость общей коррозии, а не истинную скорость коррозии.
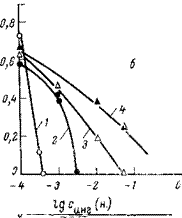 |
Рис. 5,2. Зависимость скорости общей коррозии железа от концентрации хромата
циклогексиламина в электролитах Na2S04 (а) и NaCl (б):
1 — Н2О; 2 — 0,001 н.; 3 — 0,01 н.; 4 — 0,1 н. электролит.
(Шкалы по оси абсцисс у рис. а и б одинаковы.)
Если сравнить защитные свойства органических и неорганических хромитов, то нетрудно увидеть, что органические хроматы в ряде случаев лучшие ингибиторы. Так, в 0,001 н. Na2S04 хроматы циклогексиламина и изобутиламина обеспечивают защиту стали при концентрации 0,003 н., в то время как при такой же концентрации хромата калия. коррозия еще наблюдается (табл. 5,1). То же наблюдается и для хромата изобутиламина в присутствии 0,01 и. Na2S04, а также для хромата циклогексиламина и дициклогексиламина в присутствии 0,001 н. NaCl (табл. 5,2).
Как видно из табл. 5,1 и 5,2, с увеличением концентрации агрессивных ионов С1_ и SOI" защитная концентрация ингибито-
|
Таблица 5,1. Защитные свойства хроматов в Na2S04 (/=10 сут)
|
ра растет, но не настолько, чтобы нельзя было получить экономически приемлемую защиту.
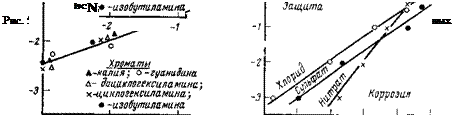
Если построить в логарифмических координатах график зависимости защитной концентрации хроматов от концентрации агрессивного иона SO, то защитные концентрации разграничиваются от незащитных прямой линией (рис. 5,3). Иными словами, между концентрацией агрессивного компонента и защитного имеется линейная зависимость.
Влияние концентрации агрессивных ионов на защитные свойства хроматов изучалось также в работе [97]. Было установлено, что и для других анионов (хлорид и нитрат) наблюдается прямолинейная зависимость между логарифмом концентрации хромата калия и логарифмом концентрации агрессивного иона (рис. 5,4). Наклон прямых, разграничивающих защитные концентрации хромата калия от незащитных, зависит от характера аниона; наиболее сильно подавляют пассивирующие свойства хромата хлорид — ионы, в меньшей степени нитрат-ионы. Сульфат-ионы занимают промежуточное положение. При больших концентрациях агрессивных ионов депассивирующие свойства нитрат — и хлорид-ионов выравниваются. В присутствии хромата калия наклон прямой равен примерно 0,7 для хлорида и сульфата и 1,1 для нитрата. Так же, как и в наших работах (см. рис. 5,1), отмечено, что хромат калия способен вызывать локальную коррозию, но она менее опасна, чем в присутствии нитрита натрия.
Защитные концентрации хроматов зависят от температуры. В отсутствие ингибитора коррозия стали и других металлов с повышением температуры вначале растет, а потом из-за снижения растворимости кислорода начинает падать. В присутствии же хромата, если только коррозионный процесс не подавлен полностью, наблюдается непрерывный рост коррозии с повышением темпера-
|
Таблица 5,2. Защитные свойства хроматов в NaCl (^=10 сут)
* Растворимость ингибитора мала. |
 |
туры. Такая закономерность связана, очевидно, с тем, что эффективность катодного процесса, возрастающая за счет частичной пассивации электрода, перекрывает эффект, возникающий за счет уменьшения растворимости кислорода. С повышением температуры возрастает и защитная концентрация ингибитора. Тех концентраций, которые обеспечивали полное подавление коррозии при 20 °С, явно не хватает при 80 °С. Их необходимо повысить в 2— 3 раза.
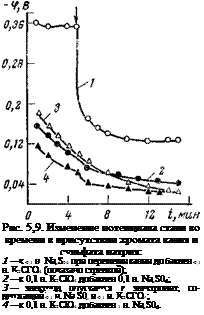
В работе [97] отмечается, что в дистиллированной воде при повышении температуры от 5 до 60 °С защитная концентрация хромата калия возрастает примерно в 2—5 раз, а в интервале 60—90 °С — в 10 раз. При 5 °С защита достигается при 10~4 моль/л хромата; при 40°С — 2-Ю-4; при 60°С — 5-Ю-4, а при 90°С — 10_3 моль/л. При концентрациях хромата, не обеспечивающих полную защиту, характер коррозии примерно такой же, как в дистиллированной воде; при более высоких температурах возникает интенсивная локальная коррозия. Когда коррозионный процесс полностью подавляется в процессе испытаний (100 сут), наблюдается незначительное изменение pH электролита. При малых же концентрациях ингибитора, не обеспечивающих защиту, значение pH электролита увеличивается, причем тем сильнее, чем выше температура (при 5 °С с 6 до 6,3; при 90 °С с 6 до 8,1).
О пассивирующих свойствах хроматов можно судить по их влиянию на электрохимический потенциал и кинетику анодного растворения. На рис. 5,1 показано, как изменяется потенциал стального электрода при введении в 0,1 н. Na2S04 хромата натрия. Вначале по мере увеличения концентрации потенциал стали сдвигается в сторону положительных значений незначительно, и это сопровождается ростом интенсивности коррозии. При приближении к защитной концентрации хромата наблюдается сильный сдвиг
К Сг>0 потенциала в положительную
![]()
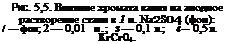
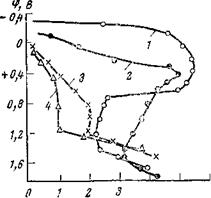 2 сторону и резкое уменьшение
2 сторону и резкое уменьшение
скорости коррозии. При защитной концентрации значение потенциала устанавливается на уровне +0,2-4-0,25 В.
Поскольку хроматы, как было выше показано, не восстанавливаются при потенциалах коррозии, сдвиг потенциала в положительную сторону может быть обусловлен лишь падением скорости анодной реакции, что и подтверждается экспериментально. Исследование процесса анодного растворения стали потенциостатиче — ским методом показало, что достаточно ввести в электролит (1 н. Na2S04) небольшие количества хромата калия (0,01 н.), чтобы скорость анодного процесса в области потенциалов, характерных для активного растворения, уменьшилась. Об этом свидетельствует значительное падение анодного тока в электролите с ингибитором по сравнению с электролитом без ингибитора. В области потенциалов, характерных для пассивного состояния (рис. 5,5), положение иное. Здесь скорость растворения стали в частично ингибированной среде намного выше, чем в неингибированной. Это объясняется тем, что в пассивной области электрод пассивируется лишь частично. Растворение носит локальный характер и сопровождается, очевидно, подкислением среды в питтингах.
По мере увеличения концентрации хромата потенциал стали все больше смещается в положительную сторону, а поляризуемость электрода возрастает. При концентрации хромата, равной половине концентрации агрессивного иона (0,5 н.), ток в области пассивного состояния электрода падает до ~ 10 мкА/см2, что примерно на порядок ниже тока пассивации в фоновом электролите. Все это указывает на то, что возникшая на поверхности стали защитная пленка отличается меньшей ионной проводимостью, чем пленка, возникающая в фоновом электролите. В ингибированных средах активация поверхности наступает при более отрицательных потенциалах, чем в фоновом электролите. Это, очевидно, связано с тем, что напряженность электрического поля на тех участках, где пленка по каким-либо причинам менее совершенна, достигает большого значения, вследствие чего наступает пробой.
Изучение импеданса электрода в ингибированных электролитах может дать ценную информацию о свойствах фаз, возникающих
 |
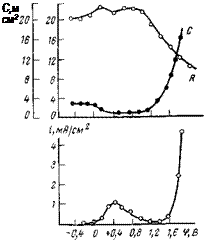 |
Рис. 5.7. Влияние хромата калия (0,1 н.) на скорость анодного растворения и им-
педанс стального электрода в 1 н. Na2S04.
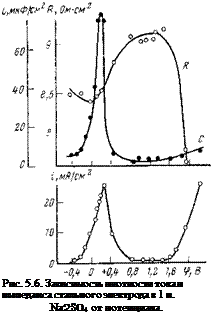
на поверхности металла. На рис. 5,6 и 5,7 представлены обычные потенциостатические кривые, полученные на железе в чистом сульфате и сульфате, содержащем хромат. Вверху каждого рисунка показано, как изменяется с потенциалом сопротивление R и емкость С электрода. Поскольку импеданс измерялся при высоких частотах (50 000 Гц), можно быть уверенным в том, что электрохимическая емкость и сопротивление реакции не промерялись и, следовательно, измеряемые параметры относятся к омическому сопротивлению и емкости пленки электрода. Когда электрод находится на границе активно-пассивного состояния, в отсутствие ингибитора сопротивление имеет минимум, а емкость — максимум (рис. 5,6). Оба экстремума на кривых С—R хорошо объясняются на основании современных представлений о дефектности структуры поверхностных окислов: в активно-пассивной области в поверхностных окисных слоях вследствие обогащения окисла ионами Fe2+ наблюдается максимальная концентрация дефектов нестехиометрии, в то время как в пассивной области она минимальна благодаря фазовому переходу и осаждению окисла Fe203. В присутствии ингибитора характерные экстремумы сопротивления и емкости сглаживаются, а их значения по абсолютной величине падают. В активно-пассивной и пассивной областях сопротивление увеличивается в 2,5—3 раза, а емкость падает в 2,5—5 раз (рис. 5,7).
Наиболее вероятный механизм действия ингибитора на окис-
ную пленку связан с его электроакцепторными свойствами. Поскольку Fe203 является полупроводником /г-типа, захват ингибитором электронов [это подтверждено квантовохимическими расчетами (см. стр. 70)] должен приводить к увеличению сопротивления пленки.
![]()
![]()
![]()
![]()
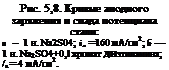
 Объяснение полученных результатов по зависимости С и R от ф, исходя из старых представлений о «залечивании» ингибитором механических дефектов пленки или увеличения ее толщины, встречает значительные трудности. Многочисленные эллипсометрические измерения. показали, что с изменением потенциала толщина пленки изменяется незначительно и монотонно. Анодный ток также изменяется не пропорционально импедансу (ток уменьшается в 26 раз, а сопротивление в 3 раза).
Объяснение полученных результатов по зависимости С и R от ф, исходя из старых представлений о «залечивании» ингибитором механических дефектов пленки или увеличения ее толщины, встречает значительные трудности. Многочисленные эллипсометрические измерения. показали, что с изменением потенциала толщина пленки изменяется незначительно и монотонно. Анодный ток также изменяется не пропорционально импедансу (ток уменьшается в 26 раз, а сопротивление в 3 раза).
На участие хромат-ионов в формировании защитного слоя указывают также осциллограммы, на которых представлены кривые спада потенциала после анодной поляризации. На рис. 5,8 представлены кривые анодного заряжения (/, 2) стали и спада потенциала (1 2Г) после выключения анодного тока. В чистом сульфате (рис. 5,8 а) после включения анодного тока потенциал стали быстро смещается в положительную сторону. Однако при ф=0,0 В сдвиг потенциала в положительную сторону замедляется, на кривых появляется площадка задержки потенциалов вследствие расхода тока на формирование пассивирующего окисла (плотности тока выбирались таким образом, чтобы они превышали токи пассивации). Формирование защитного слоя заканчивается через беи на это затрачивается ~ 1 Кл/см2 электричества. При достижении потенциала +0,4 В (конец формирования защитного слоя) наступает вторичный резкий спад потенциала до ~ + 1,8 В. При выключении анодного тока происходит разряд двойного слоя и потенциал быстро смещается в отрицательную сторону. При потенциале ~+0,5 В (значение, близкое к потенциалу полной пассивации стали) следует задержка падения потенциала, связанная с восстановлением пассивирующего окисла. После этого наблюдается резкий скачок потенциала в отрицательную сторону, указываю — щии на переход металла в активное состояние.
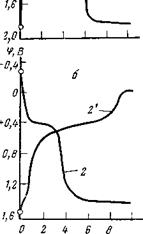
Большую роль в пассивации металлов хроматами играет конкурирующая адсорбция, о чем свидетельствуют экспериментальные результаты (рис. 5,9). Если к раствору сульфата (0,1 н.) добавить при перемешивании 0,1 н. хромат калия (момент добавления указан стрелкой), потенциал стали сместится в положительную сторону примерно на 0,2 В (кривая 1). Однако, если предварительно запассивировать электрод в 0,1 н. хромате калия, а затем добавить сульфат-ион, обратного эффекта, т. е. депассивации электрода, добиться уже нельзя (кривая 2). Не удается депасси — вировать электрод и при десятикратном увеличении концентрации активатора (кривая 4). В обоих случаях потенциал стали сохраняет положительное значение. Все это указывает на то, что в отсутствие активирующих ионов (SO?-) хромат-ионы легко адсорбируются на поверхности электрода, образуя, вероятно, прочную химическую связь, которую не удается разрушить агрессивным ионам при последующем добавлении их в электролит. Хромат-ионам, по — видимому, за счет большего химического средства со сталью, удается вытеснить сульфат-ионы с поверхности металла и этим самым затруднить реакцию ионизации металла.
 |
 |
Если же в электролите одновременно присутствуют пассиватор и активатор в одинаковых концентрациях, устанавливается такой
же потенциал, как в чистом пае — сиваторе (кривая 3). Смещение со временем потенциала в положительную сторону свидетельствует об упрочении связи хроматионов с поверхностью или о вытеснении сульфат-ионов. Иными словами, при такой конкурирующей адсорбции, когда концентрации активирующих и пассивирующих ионов одинаковы, преобладающее влияние остается за пассивирующими анионами, а активатор не в состоянии депассиви — ровать электрод.
 Конкурирующая адсорбция проявляется и в условиях анодного растворения; если стальной электрод сначала запассивиро — вать в 0,1 н. растворе хромата, потом добавить к электролиту 1 н. раствор сульфата натрия, выдержать электрод некоторое время в этой смеси и подвергнуть его анодному растворению, то получаются анодные потенциостатичеекие кривые, характерные для электрода, легко переходящего в пассивное состояние (сильная анодная поляризуемость, малые токи пассивации). Если же этот эксперимент поставить в иной последовательности, а именно: сначала опустить электрод в раствор сульфата, потом добавить такую же концентрацию хромата, выдержать электрод некоторое время в этой смеси и затем подвергнуть его анодному растворению, то получим иную поляризационную кривую. Несмотря на то что состав электролита не изменяется, анод легко переходит в активное состояние уже при небольшой анодной поляризации.
Конкурирующая адсорбция проявляется и в условиях анодного растворения; если стальной электрод сначала запассивиро — вать в 0,1 н. растворе хромата, потом добавить к электролиту 1 н. раствор сульфата натрия, выдержать электрод некоторое время в этой смеси и подвергнуть его анодному растворению, то получаются анодные потенциостатичеекие кривые, характерные для электрода, легко переходящего в пассивное состояние (сильная анодная поляризуемость, малые токи пассивации). Если же этот эксперимент поставить в иной последовательности, а именно: сначала опустить электрод в раствор сульфата, потом добавить такую же концентрацию хромата, выдержать электрод некоторое время в этой смеси и затем подвергнуть его анодному растворению, то получим иную поляризационную кривую. Несмотря на то что состав электролита не изменяется, анод легко переходит в активное состояние уже при небольшой анодной поляризации.
Отсюда следует, что не безразлично, какой анион (агрессивный или пассивирующий) раньше адсорбируется на поверхности металла. Предварительная адсорбция пассиватора сильно облегчает защиту. Не исключено, что хроматы в данном случае изменяют необратимо свойства окисных слоев, затрудняя ионный перенос по механизму, .рассмотренному в гл. 1.
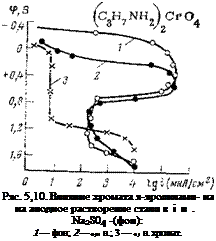
При использовании органических хроматов, имеется много доказательств в пользу того, что в защите принимает участие не только анион, но и органический катион. Для этого достаточно сравнить, например, влияние концентрации хроматов калия (см. рис. 5,5) и яшропиламина (рис. 5,10) на анодное растворение стали. При соотношении концентрации агрессивного иона к пассивирующему, равном 100:1, в пассивной области растворения хромат н-пропиламина не изменяет плотность тока пассивации, в то время как хромат калия увеличивает ее больше, чем на порядок. При соотношении 10:1 хромат и-про. пиламина переводит
сталь полностью в пассивное состояние, а при такой же концентрации хромата калия электрод находится еще в активном состоянии. Для того чтобы перевести сталь в пассивное состояние, требуется концентрацию хромата калия довести до 0,5 н. (см. рис. 5,5).
Роль других органических катионов выявляется четко при сопоставлении анодных потенциостатичеіских кривых для различных хромитов при одинаковой концентрации (0,01 «.), не переводящей еще сталь полностью в пассивное состояние (см. рис. 2.6); при одинаковых значениях потенциалов скорости анодного растворения в присутствии различных хроматов отличны: сильнее всего сталь пассивируется в присутствии хроматов дициклогексиламина и циклогексиламина, слабее в присутствии хроматов калия и гуанидина. Защитные свойства хромата изолропиламина приближаются к хромату циклогексиламина.
 28 августа, 2015
28 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 