Методы исследования адсорбции органических соединений подробно описаны Дамаскиным, Петрий и Батраковым [66]. Остановимся лишь вкратце на основных принципах этих методов с тем, чтобы облегчить читателю анализ экспериментального материала по адсорбции ингибиторов, который рассматривается в настоящей монографии.
Адсорбция органических соединений на металлах исследуется обычно двумя методами: измерением натяжения на границе фаз (пограничного) и измерением дифференциальной емкости двойного слоя. Для жидких электродов применимы оба метода. На твердых же электродах адсорбция исследуется в основном методом определения емкости двойного электрического слоя.
Давно было замечено, что псверхностно-активные вещества изменяют пограничное натяжение ртути, которое может быть определено с помощью капиллярного электрометра Липпмана. Последний представляет собой стеклянную трубку, оканчивающуюся коническим капилляром, погруженным в электролит (рис. 4,5). Пограничное натяжение ртутного электрода измеряется высотой столба ртути /г, который необходим для удержания ртутного мениска в определенном месте капилляра. В равновесных условиях, когда ртуть не выливается из капилляра, высота столба ртути h уравновешивается силами пограничного натяжения, давящими
вверх на мениск ртути в капилляре. Давление Р, оказываемое при этом на капельный мениск, равно
Р = 2а cos р/г (4,43)
где а — пограничное натяжение; р — краевой угол между стенкой капилляра и ртутью.
Давление ртутного столба Р’, уравновешивающего давление Р, равно
Р’ = hgp
где h — высота столба ртути; g — ускорение свободного падения, р — плотность ртути.
В равновесных условиях
2 ст cos Р//- = hgp (4,44)
о = hgpr/2 cos Р (4,45)
т. е. по высоте столба ртути можно определить значения пограничного натяжения.
Учитывая, что при поляризации изменяется поверхностное натяжение (максимальное значение наблюдается в точке нулевого заряда) и связанное с этим давление Р, можно по перемещению ртутного мениска в капилляре, которое определяется с помощью катетометра, найти зависимость поверхностного натяжения от потенциала и таким образом получить полную электрокапиллярную кривую. Сравнивая электрокапиллярные кривые для фона с электрокапиллярной кривой для электролита с поверхностно-активным веществом, т. е. с соединениями, адсорбирующимися на границе раздела фаз, можно по изменению поверхностного натяжения судить о том, адсорбируется ли это вещество и в какой области потенциалов оно наиболее сильно проявляет свои поверхностно-активные свойства.
На рис. 4,6 представлены электрокапиллярные кривые, полученные Гун на ртутном электроде для двух случаев: в первом к электролиту был добавлен катион [ЩСгНбЬ]2"1′, в другом анион I-. Как видно, в зависимости от заряда иона максимум электрокапиллярной кривой смещается к отрицательным или положительным значениям потенциал, а сами кривые смещаются вниз. Отклонение электрокапиллярной кривой от нормальной, имеющей обычно вид параболы, Гуи объяснил специфической адсорбцией, изменяющей строение двойного слоя.
Изучая электрокапиллярные кривые, Фрумкин и его сотр. значительно развили теорию адсорбции органических соединений на ртути. В частности, Каганович и Герович [71] показали, что при адсорбции на ртути нормальных кислот, спиртов и аминов жирного ряда из растворов поверхностно-инактивных ионов (1 и. H2SO4) соблюдается правило Траубе: в пределах одного гомологического ряда при одинаковой концентрации органического вещества в рас-
творе адсорбция возрастает по ■мере увеличения длины цени соединения.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
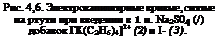
![]() Влияние поверхностно-активных ионов фона, изменяющих строение двойного электрического слоя, неоднозначно; например, в присутствии ионов иода, уменьшающих взаимное отталкивание между катионами [ЩСзНт)^4-, адсорбция последних увеличивается, в то время как при специфической адсорбции анионов брома и иода адсорбция на ртути этилового спирта, фенола и анионов салициловой кислоты уменьшается. Оказалось, что адсорбция органических молекул сдвигает потенциал нулевого заряда так же, как и органические катионы и анионы. Это, по Фрумкину, частично обусловлено наличием у них постоянного дипольного момента. Сопоставляя сдвиги потенциалов нулевого заряда, наблюдавшиеся при адсорбции на ртути различных органических соединений, с адсорбционными скачками потенциала на границе раствор — воздух, было показано, что при адсорбции алифатических кислородных соединений на обеих границах раздела фаз возникают одинаковые по знаку и близкие по значению скачки потенциала. Отсюда было сделано предположение, что при адсорбции органических веществ происходит замена диполей воды, ориентированных своим отрицательным концом в сторону ртути или воздуха, на молекулы органического вещества, которые ориентируются в сторону поверхности раздела своей углеродной цепью.
Влияние поверхностно-активных ионов фона, изменяющих строение двойного электрического слоя, неоднозначно; например, в присутствии ионов иода, уменьшающих взаимное отталкивание между катионами [ЩСзНт)^4-, адсорбция последних увеличивается, в то время как при специфической адсорбции анионов брома и иода адсорбция на ртути этилового спирта, фенола и анионов салициловой кислоты уменьшается. Оказалось, что адсорбция органических молекул сдвигает потенциал нулевого заряда так же, как и органические катионы и анионы. Это, по Фрумкину, частично обусловлено наличием у них постоянного дипольного момента. Сопоставляя сдвиги потенциалов нулевого заряда, наблюдавшиеся при адсорбции на ртути различных органических соединений, с адсорбционными скачками потенциала на границе раствор — воздух, было показано, что при адсорбции алифатических кислородных соединений на обеих границах раздела фаз возникают одинаковые по знаку и близкие по значению скачки потенциала. Отсюда было сделано предположение, что при адсорбции органических веществ происходит замена диполей воды, ориентированных своим отрицательным концом в сторону ртути или воздуха, на молекулы органического вещества, которые ориентируются в сторону поверхности раздела своей углеродной цепью.
Особо следует остановиться на адсорбции неполярных соединений, поскольку объяснить ее силами кулоновского взаимодействия нельзя. В работах Геровича [72] было показано, что бензол, нафталин, фенантрен и хризен хорошо адсорбируются на ртути и смещают несмотря на неполярный характер потенциал нулевого заряда в отрицательную сторону, как и анионоактивные вещества. Причем адсорбируемость этих соединений при ф>0 возрастает с увеличением числа бензольных колец в молекуле органического вещества. Поскольку эти результаты нельзя истолковать, исходя из электростатики, поведение ароматических соединений было объяснено особенностями строения бензольного кольца.
Адсорбция органических соединений с различным числом двойных связей при положительных потенциалах и вызываемое ею смещение фп. з в отрицательную сторону связано, по-видимому, с эффектом взаимодействия я-электронов ароматического ряда с положительным зарядом поверхности ртути. При переходе от ней
тральных электролитов к кислым, в которых некоторые органические соединения находятся в виде катионов, адсорбция последних при положительных потенциалах уменьшается.
Исследование адсорбции ароматических аминов (анилин, о-то — луидин, 2,3- и 2,6-диметиланилин, пиридин, хинолин) в 0,1 н. НС1, выполненное Бломгреном и Бокрисом [73], также показало, что адсорбция этих соединений, которые в кислом электролите находятся в виде катионов [RH3]+, при потенциалах, соответствующих положительной ветви электрокапиллярной кривой, определяется в основном я-электронным взаимодействием. Оно облегчается при плоском расположении частиц по поверхности электрода. При потенциалах, соответствующих отрицательной ветви электрокапиллярной кривой, адсорбция определяется кулоновскими силами взаимодействия. Из этого видно, что теория электростатического взаимодействия между поверхностью ртути и адсорбируемым веществом не в состоянии объяснить все экспериментальные данные.
При изменении состава вещества может измениться и я-элект — ронное взаимодействие. Так, Дамаскин с сотр. [66] отмечает, что замещение атомов водорода в органических соединениях атомами фтора приводит к я-электронному «истощению» ароматического ядра за счет большого сродства атомов фтора к электронам. В результате я-электронное взаимодействие практически не сказывается при адсорбции на ртути молекул пентафторанилина, пентафторбензойной кислоты и пентафторфенола.
Относительно влияния функциональных групп на адсорбцию органических молекул или ионов нет еще полной ясности. Исследование адсорбции функциональных производных бутила, фенила и нафтила (заместители: —ОН, —СНО, —СООН, —CN, —SN, > СО, —NH3, —SO3), проведенные Дамаскиным с сотр. [66], привели авторов к выводу, что функциональные группы влияют на адсорбцию органических молекул в основном вследствие изменения энергии растворения этих соединений. Основанием для такого вывода послужили рассчитанные энергии адсорбции Дбадс, которые характеризуют связь ртути с органическими радикалами. Они оказались не зависящими от природы заместителя.
Однако при адсорбции амиламина и бутиламина поверхностная активность этих соединений на границе со ртутью выше, чем на границе с воздухом. Отсюда был сделан вывод, что природа полярной группы оказывает все же некоторое влияние на изменение работы адсорбции.
По-видимому, по поверхностно-активным свойствам органических соединений, определяемым на ртути, нельзя однозначно судить об их ингибирующих свойствах по отношению к твердым электродам, но электрокапиллярные измерения все же позволяют определить природу соединения: является ли оно анионоактивным, катионоактивным или соединением молекулярного типа.
По теории электрокапиллярных явлений поверхностно-активные вещества, адсорбирующиеся на ртути, должны снижать по-
 |
верхностное натяжение пропорционально количеству адсорбирующегося вещества с учетом, конечно, природы адсорбирующейся частицы. Ингибиторы анионного типа адсорбируются сильнее при положительных потенциалах, а ингибиторы катионного типа — при отрицательных потенциалах. Ингибиторы молекулярного типа могут адсорбироваться как в области положительной, так и отрицательной ветви электрокапиллярной кривой. Таким образом, по изменению положения электрокапиллярной кривой можно судить о природе исследуемого вещества. Проиллюстрируем возможности этого метода е помощью кривых адсорбции некоторых соединений.
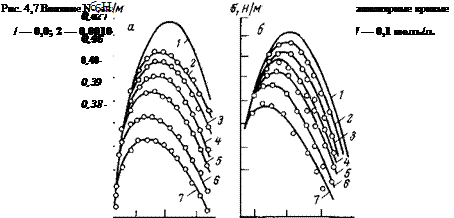
На рис. 4,7 представлены электрокапиллярные кривые для некоторых азотсодержащих соединений. Как видно, производные пиридина и анилина адсорбируются преимущественно на отрицательно заряженной поверхности, хотя снижение поверхностного натяжения наблюдается в широкой области потенциалов по обе стороны от потенциала нулевого заряда. Учитывая, что в присутствии этих соединений максимум электрокапиллярной кривой смещается в сторону более положительных значений потенциала, можно заключить: исследованные соединения являются поверхностно-активными веществами катионного типа. Этот вывод достаточно обоснован, поскольку производные анилина и пиридина имеют на атоме азота неподеленную пару электронов, вследствие чего способны в кислых средах присоединять протоны с образованием органического катиона (C6H5N+—СпНгп+г).
Что касается возможности адсорбции изученных соединений в области положительных потенциалов, то она в соответствии с работой Геровича объясняется я-электронным взаимодействием:
гетероциклических или ароматических колец этих соединений с положительными зарядами поверхности ртути.
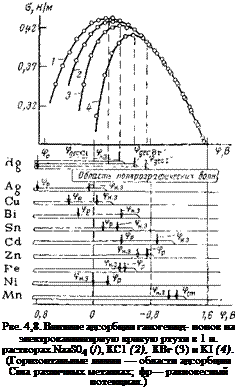 Влияние ингибиторов анионного типа на электрокапиллярную кривую показано на рис. 4,8 [74, с. 380].
Влияние ингибиторов анионного типа на электрокапиллярную кривую показано на рис. 4,8 [74, с. 380].
Г алогенид-ионы адсорбируются в области положительных значений потенциалов, когда электрод заряжен положительно. Область потенциалов, соответствующая образованию устойчивых адсорбционных слоев, заканчивается несколько правее нулевой точки для ртути (фнз=—0,2 В). Большая способность к адсорбции ионов С1_ и легкая поляризуемость их электронных оболочек приводит к непосредственному влиянию их на электрохимические реакции.
Адсорбция галогенид-ионов на металлах носит электростатический и отчасти специфический характер (связи, близкие к ковалентным) и является обратимой, поскольку энергия активации адсорбции из растворов у них невелика.
Полагая, что разность между потенциалом десорбции (фдес) и потенциалом нулевого заряда (<рн. 3) является для всех металлов величиной постоянной, авторы рассчитали области потенциалов, в которых ионы С1~ могут адсорбироваться на различных металлах (см. рис. 4,8).
В некоторых случаях наблюдается параллелизм между способностью органических соединений понижать пограничное натяжение на ртути и их способностью уменьшать коррозию металлов. Так, Гейтос [75], изучавший влияние аминов на положение отрицательной ветви электрокапиллярной кривой для ртути, обнаружил, что поверхностная активность аминов на ртути меняется в такой же степени, как и ингибирующее действие этих соединений при кислотной коррозии железа.
Если электронное строение твердого металла, а также строение его двойного электрического слоя аналогично таковым у ртути, можно, по мнению Антропова, переносить результаты, получаемые на ртути, на твердые металлы. Например, было обнаружено,
что у большинства пиридиновых и анилиновых производных наблюдается параллелизм между коэффициентом торможения коррозии у цинка и кадмия и их поверхностной активностью на ртути
lgy = const + lg Да (4,46)
В связи с этим предполагают, что ингибирующее действие по отношению к некоторым металлам веществ, содержащих в качестве единственной функциональной группы —NH2, =NH, =N или = NR+, NRt, можно определить по электрокапиллярным кривым, полученным на ртути.
В то же время для большинства серусодержащих органических веществ такого параллелизма между защитными свойствами соединений по отношению к железу и их поверхностной активностью на ртути не обнаружено. Объясняется это специфическим взаимодействием электронов атомов серы с электронами незаполненных rf-орбиталей железа, которое приводит к значительному упрочнению связи ингибиторов с металлом. В пользу этого утверждения свидетельствует необратимость адсорбции серусодержащих соединений на железе и увеличение адсорбции с ростом температуры. В отличие от адсорбции азотсодержащих соединений специфическая адсорбция серусодержащих соединений зависит не только от свойств адсорбированных частиц, но и от химической природы металла.
Таким образом, адсорбционные измерения на ртути являются, безусловно, полезными, но к использованию результатов этих измерений для твердых электродов нужно подходить с осторожностью. Разная адсорбция органических соединений на ртути и твердых электродах обусловлена целым рядом причин. Адсорбция на ртути обычно равновесная, в то время как на твердых металлах адсорбционное (равновесие в результате коррозии и обновления поверхности (унос адсорбируемого вещества) обычно не достигается.
Кроме того, адсорбция воды на некоторых твердых металлах (например, Fe) подчас выражена сильнее, чем на ртути, в результате чего концентрация органического вещества на поверхности железа может быть значительно меньшей, чем на ртути, даже при одинаковом значении потенциала по приведенной шкале с учетом <рн з (наиболее «гидрофобными» металлами являются Hg, Pb, Bi, Cd).
Следует также учесть, что ионы гидроксила, которые являются поверхноетно-йнактивными на ртути, сильно адсорбируются на железе и других твердых металлах, выступая, как было выше показано, в роли катализаторов коррозионного процесса. Это также нарушает адсорбционное равновесие и уменьшает концентрацию органического вещества на поверхности металла. Помимо этого поликристаллические тела имеют различные значения работы выхода электронов из отдельных граней кристалла, а следовательно, и разные значения потенциала нулевого заряда, и обладают оби
лием структурных дефектов (дислокаций, вакансий и т. д.), что сильно влияет на адсорбцию органических веществ.
О количестве адсорбированного на металле органического вещества можно для идеально поляризуемого электрода[9], каким является ртуть, судить по изменению натяжения на границе фаз. Основное уравнение электрокапиллярности, связывающее натяжение о с зарядом двойного слоя є, потенциалом электрода ср, адсорбцией Г и химическим потенциалом адсорбируемого вещества Pi, записывается по Фрумкину в следующем виде:
![]() da = — sd(p — У] Tjdpi
da = — sd(p — У] Tjdpi
Поскольку рг = /?Г1паі + &і, а для разбавленных растворов активность а* может быть приравнена к концентрации си получаем dXi= (RT/ci)dc и
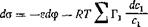 (4,48)
(4,48)
Когда концентрация других компонентов в растворе и потенциал электрода постоянны:
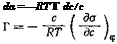 (4,49)
(4,49)
(4,50)
Отсюда видно, что адсорбция данного вещества может быть определена из наклона кривой зависимости поверхностного натяжения от концентрации этого вещества при постоянном потенциале. По изменению пограничного натяжения с изменением потенциала можно также рассчитать заряд и емкость двойного слоя
![]() є = — (да/д<р)с
є = — (да/д<р)с
С = дг/дці = — (32a/dcp2)c
Адсорбцию органических соединений, и в частности ингибиторов, можно изучать и методом исследования емкости двойного электрического слоя. Дифференциальная емкость является более чувствительной характеристикой адсорбции, чем изменение пограничного натяжения. Кроме того, емкостной метод может быть применен и к твердым электродам. Двойной слой можно с известным приближением рассматривать как плоский конденсатор, в котором емкость двойного слоя С и сопротивление раствора R соединены последовательно. Дифференциальная емкость электрода может быть непосредственно измерена с помощью переменного тока, впервые примененного Фрумкиным с сотр. для этих целей.
Сущность метода заключается в том, что при постоянной силе переменного тока А і измеряют падение напряжения в ячейке
|
Дфэт Дф* |
(Дфж) и на эталоне (Дфэт), а искомая емкость рассчитывается по уравнению
где Сэт — емкость эталона; Rx—Cx — последовательно соединенные омическая и емкостная составляющие общего импеданса ячейки (в отсутствие электрохимической реакции равны сопротивлению раствора и емкости двойного слоя); <о—круговая частота.
Этот метод может быть применен лишь при выполнении условия: /??С5ю2<С 1, т. е. при малом сопротивлении раствора и низкой круговой частоте переменного тока. Это ограничивает применение метода для электролитов с высоким сопротивлением (>• 10~4-т — — М0~5 н.).
В тех случаях, когда требуется исследовать емкость в разбавленных электролитах, лучше, по мнению Дамаскина, применять коммутаторный метод, разработанный Борисовой и Проскурниным [76]. В этом методе исследуемый электрод и эталонная емкость подключаются поочередно к заряженному конденсатору, а возникающая на них разность потенциалов фиксируется при помощи баллистического потенциометра. В момент измерения в цепи отсутствует ток, что позволяет исключить влияние омического сопротивления, которое в разбавленных электролитах значительно превосходит емкостное сопротивление и резко снижает точность измерений.
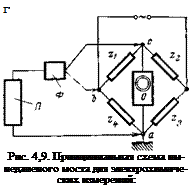
Наиболее точные данные по емкости двойного электрического’ слоя можно получить методом импедансного моста, впервые использованным Долиным и Эршлером [77], который позволяет учесть сопротивление раствора, а также сдвиг фаз между емкостью и сопротивлением. Принципиальная схема импедансного моста для электрохимических измерений представлена на рис. 4,9. Баланс моста, т. е. равенство потенциалов в точках а и с, имеет место при Zi-z3=Z2- Zk. Поскольку плечи моста Zi и z2 выбираются одинаковыми, баланс моста наблюдается при z3=z4. Когда мост сбалансирован, измеряемая емкость С и сопротивление R в точности равны емкости и сопротивлению магазинов, включенных последовательно в цепь.
На кривых зависимости дифференциальной емкости от потенциала, так же как и на кривых зависимости пограничного натяжения от потенциала, обнаруживаются при наличии в электролите поверхностно-активных веществ характерные изменения. Вследствие адсорбции органических веществ емкость двойного электрического слоя снижается, а в определенной области потенциалов на кривых С—ф появляется минимум емкости (4—5 мкФ/см2). При определенных потенциалах регистрируются пики, обусловленные десорбцией органического вещества с поверхности электрода. Таким образом, по форме кривой можно судить, в какой области
потенциалов адсорбируются или десорбируются поверхностно-активное вещества.
 Методом измерения дифференциальной емкости можно иногда обнаружить протекающие на электроде процессы, которые другими методами не выявляются. Так, Фрумкин с сотр. получил кривые дифференциальной емкости в 0,1 н. H2SO4, насыщенной метилметакрилатом. На кривых обнаруживается сильное падение емкости при отрицательных потенциалах. Анализ показал, что оно не связано с десорбцией, а объясняется реакцией полимеризации, которая была инициирована электрохимически.
Методом измерения дифференциальной емкости можно иногда обнаружить протекающие на электроде процессы, которые другими методами не выявляются. Так, Фрумкин с сотр. получил кривые дифференциальной емкости в 0,1 н. H2SO4, насыщенной метилметакрилатом. На кривых обнаруживается сильное падение емкости при отрицательных потенциалах. Анализ показал, что оно не связано с десорбцией, а объясняется реакцией полимеризации, которая была инициирована электрохимически.
Кривые дифференциальной емкости позволяют также иногда определить, как ориентируется адсорбционная молекула на поверхности. В работе [66] было показано, что в отличие от алифатических соединений, для которых оба максимума на кривых С—<р связаны с процессами адсорбции, для ароматических или гетероциклических соединений, например анилина, этим процессам отвечают только катодные максимумы. Анодные же связаны с процессом переориентации молекул анилина на поверхности ртути; вертикальное расположение молекул, характерное для отрицательно заряженной поверхности, сменяется плоским расположением, при котором л-злектроны бензольного кольца вступают во взаимодействие с положительными зарядами поверхности ртути.
По изменению емкости можно определить количество адсорбированного на электроде вещества и степень покрытия электрода. Для этой цели предложено много методов расчета. Наиболее надежным является, очевидно, метод Дамаскина. Автор считает, что при потенциале максимальной адсорбции (минимум емкости на кривых ф—С) степень заполнения поверхности в первом приближении можно определить по уравнению:
е = (С0-С)/(С,— С) (4,54)
где С0 — емкость двойного слоя в растворе фона; С — емкость <в растворе с добавкой органического вещества; С’ —емкость двойного слоя при предельном заполнении поверхности электрода органическим веществом.
Значение С’ определяется обычно с достаточной точностью экс- трансляцией кривой зависимости Vc от 7<р при ф=фМакс к 7с = 0. Хотя уравнение (4,54) ограничено областью потенциалов максимальной адсорбции, где на кривых дифференциальной емкости
имеется минимум, оно, по мнению Дама-скина, очень удобно для определения изотерм адсорбции.
Степень заполнения поверхности ингибирующим веществом рассчитывают и по кинетическим данным. При этом исходят из того, что адсорбированные органические вещества, так же как и неорганические ингибиторы, рассмотренные в гл. 2, полностью выводят из сферы анодной реакции ту часть поверхности, которая занята ингибитором (считают, что скорость анодной реакции на ней практически снижается до нуля). При этом допущении для определения 0 используют уравнение
0=1— /До (4,55)
где і и іо — плотности тока при заданном потенциале в ингибированном и неингибированном электролитах соответственно.
Часто эти же соображения используют, рассчитывая степень заполнения при саморастворении (коррозии). При этом пользуются данными о скорости растворения в ингибированном ^инг И НЄИНГИ — бированном ко электролитах:
0=1 — ^инг/^о (4,56)
Следует заметить, что эти расчеты не всегда являются корректными, поскольку изменение коррозионного тока может зависеть не только от степени покрытия поверхности, но и от изменения скорости процесса на открытой поверхности; как будет показано ниже, адсорбция органических веществ часто изменяет константу скорости реакции k, адсорбционный потенциал фщ а через него заряд поверхности, что совершенно не учитывается в уравнениях для расчета степени заполнения поверхности. Это приводит к расхождению результатов, получаемых разными методами. Однако в некоторых случаях различия в степенях заполнения поверхности органическими веществами, рассчитанные из кинетических характеристик и по данным прямых измерений количества адсорбированного вещества, например радиоактивными индикаторами, совпадают. Такие случаи наблюдал Багоцкий с сотр. [78] при исследовании адсорбции высших алифатических спиртов и спиртов изо-строения на гладком платиновом электроде. При строгих количественных расчетах необходимо учитывать изменение со степенью заполнения как константы скорости реакций k, так и фі-по — тенциалы. В первом приближении можно считать, что в области средних заполнений
я|)1==фї —Дф^е (4,57)
где грі —значение адсорбционного потенциала при 0=0.
В зависимости от того, как изменяется фі-потенциал, можно ожидать при адсорбции органических соединений как усиления коррозии, так и ее замедления. В тех случаях, когда в результате адсорбции возникает положительный адсорбционный потенциал, эффект экранирования поверхности 0 суммируется с эффектом из
менения фі (вспомним, что положительный адсорбционный скачок потенциала затрудняет реакцию разрядов ионов гидроксония). В тех же случаях, когда возникает отрицательный адсорбционный скачок потенциала, увеличение скорости реакции может перекрыть блокирующий эффект, возникающий за счет адсорбции.
Кроме этого, следует учесть, что при адсорбции ингибиторов может измениться и энергия активации электрохимической реакции. Как было показано в работе [79], зависимость констант скоростей катодной и анодной реакций от степени заполнения поверхности ингибитором описывается уравнением
* = *е=о (1-в) + *е=і-0 (4<58>
где k — эффективное значение констант скоростей электродных реакций, отнесенное ко всей (поверхности электрода; &е=о и &0==1 — константы скоростей электродных реакций при 0 = 0 и 0=1.
Как видно, при анализе механизма действия органических ингибиторов и еще в большей степени при количественных расчетах требуется учитывать ряд факторов, влияющих к тому же друг на друга.
Располагая данными о степени заполнения поверхности ингибитором, можно определить изотерму адсорбции, характер которой позволяет получить ценную информацию о свойствах адсорбированного вещества. Предложено много уравнений, описывающих изотерму адсорбции. Экспериментальные данные чаще всего, по Дамаскину, хорошо описываются изотермами Ленгмюра, Фрумкина и Темкина:
Вс = 0/(1 — 9) (4,59)
0
Вс = j _ 0 exp (—2а0) (4,60)
ГДе В —константа адсорбционного равновесия; с — концентрация вещества в растворе, моль/л; 0— степень заполнения поверхности; а—аттракционная постоянная.
В работе [66] по результатам измерения дифференциальной емкости было установлено, что в растворах 1 н. KI с различными концентрациями [(СДККШ] изотерма адсорбции имеет s-образную форму, свидетельствующую о сильном аттракционном взаимодействии между адсорбированными частицами. Изотерма адсорбции описывалась уравнением Фрумкина. Лоренц с сотр. [80], исследуя таким же методом адсорбцию различных органических соединений, показал, что при адсорбции спиртов и аминов преобладают силы притяжения (получаются s-образные изотермы), а при адсорбции органических катионов [(СНз)М]+ и [(СНз)зНЫ]+ преобладают силы отталкивания (изотермы адсорбции лежат ниже изотермы Ленгмюра).
Константа адсорбционного равновесия В определяется из свободной энергии адсорбции:
В = ехр (—Дa/RT) (4,62)
которую можно рассчитать по степени заполнения поверхности, если это заполнение происходит по изотерме Ленгмюра:
Таким образом, метод дифференциальной емкости дает возможность проводить количественные расчеты степени заполнения поверхности, свободной энергии адсорбции, а также определять характер адсорбции. К сожалению, строгие расчеты могут пока проводиться лишь для ртутного электрода. Количественные расчеты по результатам измерения емкости двойного электрического слоя на твердых электродах сопряжены с рядом трудностей и являются поэтому менее строгими.
Основная трудность заключается в том, что твердые металлы не являются идеально поляризуемыми электродами, вследствие чего приходится учитывать и ток, расходуемый на электрохимическую реакцию, даже в том случае, когда измерения импеданса производятся при переменном токе. В этих условиях эквивалентную схему ячейки нельзя уже представить в виде последовательного соединения емкости двойного слоя и сопротивления раствора.
В простейших случаях емкость и сопротивление, измеренные при последовательной схеме соединений, можно пересчитать на параллельную схему соединения по следующим формулам:
С. = <*/(!+«*1*!) (4,64)
Яі = Яі{1+[1/®*С! ЯЮ]} (4.65)
где Сі и R — емкость и сопротивление, измеренные при последовательном включении; С2 и Ri — емкость и сопротивление при параллельном включении; <о — круговая частота (со = 2яу, где у—частота переменного тока).
Сопротивление Rz в этом случае имеет уже иной физический смысл и представляет собой поляризационное сопротивление.
Критерием необходимости пересчета результатов измерений С и R при последовательной схеме на параллельную служит значение тока, расходуемого на электрохимическую реакцию. По Да — маскину, для твердых электродов, характеризующихся высоким перенапряжением водорода, измерения в области катодных потенциалов не отличаются от измерений на ртути, т. е. пересчет не требуется. В условиях же саморастворения, как показал расчет, при і^ІО-5 A/ем2 наблюдаются искажения кривой емкости С = = Дф) уже при небольших отклонениях потенциала металла от стационарного. В этих случаях необходим пересчет данных, полученных при последовательной схеме, на параллельную.
Несмотря на трудности, встречающиеся при измерении емкости на твердых электродах, и не всегда однозначную трактовку резуль
татов, измерения емкости при переменном токе на твердых электродах дали ценную информацию и позволили выяснить многие вопросы ингибирования. В качестве примера приведем данные, полученные Лосевым [61] по эффекту синергизма (рис. 4,10). Как видно, добавки ионов тетрабутиламмония к серной кислоте практически не изменяют емкость электрода, что свидетельствует об отсутствии адсорбции. Однако стоит добавить небольшое количество KI (0,005 н.), чтобы емкость резко упала. Это указывает на то,
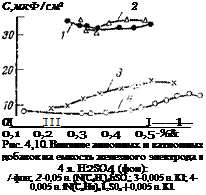
![]()
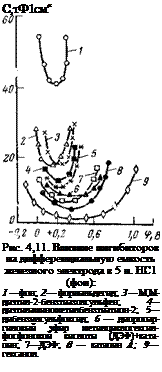 поверхности железа изменяет заряд поверхности таким образом, что становится возможной адсорбция органических катионов. Подобаев с сотр. [81] применил емкостной метод для изучения адсорбции альдегидов, непредельных спиртов, фосфор-, серу — и азотсодержащих соединений (рис. 4,11). Было установлено, что указанные соединения сильно снижают емкость железного электрода и расширяют область потенциалов, в которой емкость сохраняется на низком уровне. Особенно это характерно для гексинола и дипропаргилового эфира метилциклогексилфосфиновой кислоты (ДЭФ). Смесь катапина с ДЭФ более эффективна, чем отдельные компоненты. Область потенциалов, при которых эта смесь адсорбируется, расширяется в связи с тем, что ацетиленовые соединения образуют полимерные пленки. Для большинства изученных ингибиторов обнаружена прямая связь между снижением емкости и изменением скорости коррозии. Выяснены различия в ингибирующих свойствах отдельных классов соединений: ацетиленовые соединения обладают большим защитным эффектом, сильно снижают емкость и смещают минимум кривой емкости в сторону отрицательных значе-
поверхности железа изменяет заряд поверхности таким образом, что становится возможной адсорбция органических катионов. Подобаев с сотр. [81] применил емкостной метод для изучения адсорбции альдегидов, непредельных спиртов, фосфор-, серу — и азотсодержащих соединений (рис. 4,11). Было установлено, что указанные соединения сильно снижают емкость железного электрода и расширяют область потенциалов, в которой емкость сохраняется на низком уровне. Особенно это характерно для гексинола и дипропаргилового эфира метилциклогексилфосфиновой кислоты (ДЭФ). Смесь катапина с ДЭФ более эффективна, чем отдельные компоненты. Область потенциалов, при которых эта смесь адсорбируется, расширяется в связи с тем, что ацетиленовые соединения образуют полимерные пленки. Для большинства изученных ингибиторов обнаружена прямая связь между снижением емкости и изменением скорости коррозии. Выяснены различия в ингибирующих свойствах отдельных классов соединений: ацетиленовые соединения обладают большим защитным эффектом, сильно снижают емкость и смещают минимум кривой емкости в сторону отрицательных значе-
ний потенциала. Они, таким образом, действуют как катионоактивные органические вещества; серусодержащие соединения не смещают минимума кривой емкости и действуют подобно ингибиторам молекулярного типа; альдегиды (формальдегиды) сдвигают минимум кривой емкости в сторону положительных значений потенциала, проявляя свойства анионоактивных веществ.
Импедансные измерения на твердых электродах неоднократно успешно использовались Иофа, Батраковым и другими для раскрытия механизма действия ингибиторов коррозии.
 28 августа, 2015
28 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 