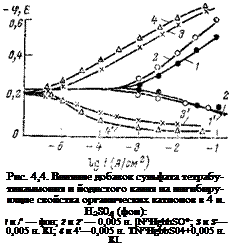
Органические катионы не всегда изменяют кинетику электродных реакций. Если введение солей органических оснований в 1 н. НС1 приводит к значительному изменению скорости восстановления водорода, а также реакции ионизации железа (см. рис. 4,2), то в 1 н. H2SO4 эти же органические катионы оказывают слабое влияние. Объясняется это тем, что органические катионы слабо адсорбируются на поверхности железа; считают, что поверхность железа в серной кислоте заряжена положительно, и поэтому одноименно заряженные ионы слабо адсорбируются. Однако, если ввести в раствор галогенид-ионы, картина резко меняется. Так, Иофа с сотр. показал [60], что введением в электролит наряду с органическими катионами ионов иода, брома и хлора можно резко повысить ингибирующее действие органических соединений. Если добавка одной сернокислой тетраизоамиламмониевой соли в серную кислоту слабо влияла на кинетику электродных реакций выделения водорода и ионизации железа, то дополнительное введение в электролит всего лишь 0,001 н. КІ приводит к сильному замедлению катодной и анодной реакций. Аналогичные результаты получил [63] Лосев (рис. 4,4).
Подобно тому, как было выведено уравнение для реакции разряда ионов гидроксония, можно вывести уравнение, связывающее зависимость скорости анодного процесса (растворения металла) от потенциала. В окончательном виде оно принимает следующее выражение:
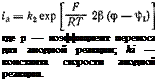 (4,37)
(4,37)
В полулогарифмических координатах зависимость скорости анодной реакции ta от потенциала ср должна выражаться прямой
с определенным наклоном ha.
 Используя кинетические зависимости для катодной и анодной реакций, Штерн и Жири [61] вывели уравнение, которое позволяет по наклону поляризационных кривых и поляризационному сопротивлению рассчитать скорость коррозии и влияние, оказываемое ингибиторами:
Используя кинетические зависимости для катодной и анодной реакций, Штерн и Жири [61] вывели уравнение, которое позволяет по наклону поляризационных кривых и поляризационному сопротивлению рассчитать скорость коррозии и влияние, оказываемое ингибиторами:
Дф/Дг = ЬаЬк/[2,3*/корр (Ьа -]- Ьк)
(4,38)
где Ьа и 6К — тафелевские постоянные для анодного и катодного процессов; /корр — ток коррозии.
Это уравнение справедливо лишь при небольших поляризациях, когда имеется линейная зависимость потенциала от плотности тока. Трабанелли с сотр. [62], используя это уравнение для расчетов, показал по поляризационной диаграмме, что дибензилсульфоксид сильно увеличивает поляризационное сопротивление на никеле вблизи стационарного потенциала; это является причиной уменьшения коррозии.
Лосев [63], изучая емкость железного электрода в присутствии поверхностно-активных добавок, показал, что галогенид-ионы увеличивают адсорбцию органических катионов. Добавка одного тетрабутиламмония к серной кислоте практически не меняла емкость электрода. Это свидетельствует в пользу того, что органический катион слабо адсорбируется иа железном электроде. В присутствии же ионов иода емкость железного электрода снижалась. Еще более сильное снижение емкости было зарегистрировано при совместном присутствии ионов тетрабутиламмония я иода. При этом было отмечено сильное торможение электродных реакций.
Из этого следует, что галогенид-ионы изменяют свойства поверхности таким образом, что на ней становится возможной адсорбция органических катионов. Это в свою очередь приводит к значительным кинетическим эффектам, способствующим тому, что совместное действие неорганических анионов и органических катионов оказывается значительно более эффективным, чем ингибирующее действие каждой добавки в отдельности.
Увеличение ингибирующего эффекта органических соединений в присутствии галогенид-ионов наблюдалось также Бесковым при исследовании процесса растворения стали в серной кислоте.
При исследовании [59] влияния на коррозию органических катионов, в частности производных пиридина и анилина, также было
установлено, что их защитные свойства резко повышаются при введении в электролит галогенид-ионов (С1~, Вг~, I-). Учитывая, что сами по себе эти ионы являются слабыми ингибиторами коррозии, обнаруженный эффект, видимо, нельзя считать результатом суммарного действия двух добавок. Ясно, что здесь наблюдается взаимное изменение защитных свойств обоих веществ. Это явление получило название «эффект синергизма». Оно характерно не только для галогенид-ионов, но и для ионов HS~, CNS~, органических анионов и др. В этом можно убедиться при рассмотрении рис. 4,3.
Если сульфосалициловая кислота снижает перенапряжение водорода и усиливает коррозию в серной кислоте, то совместная адсорбция сульфосалициловой кислоты и катионов тетрабутиламмония заметно повышает перенапряжение электродных реакций и уменьшает на несколько порядков коррозию [58]. Емкостными измерениями было также показано, что бензолсульфокислота увеличивает адсорбцию трибензиламина; трибензиламин мало изменяет емкость железного электрода, но при добавке к раствору бензолсульфокислоты емкость снижается сильно.
Адсорбция органических соединений ониевого типа (аммониевых, оксониевых, сульфониевых) также увеличивается при наличии в растворе галогенид-ионов (Cl-, Br~, I-). Так, в работе [52] методом измерения дифференциальной емкости двойного электрического слоя на железе было показано, что адсорбция хинолина и диметиланилина увеличивается при наличии в электролите ионов хлора. Объясняется это тем, что в кислых электролитах эти соединения присоединяют протоны, в результате чего в растворе появляются катионы.
Способность галогенид-ионов увеличивать адсорбцию органических веществ является, очевидно, универсальной для соединений, которые находятся в электролите в виде катионов. К таким веществам относятся кроме указанных выше амины, сульфооксиды, сульфамиды и др.
Эффект синергизма проявляется и при использовании более сложных соединений, которые в результате диссоциации в водной среде образуют органические катионы и анионы. В частности, значительная адсорбция бромида и иодида тетраалкиламмония и этилхинолинийиодида также связана с адсорбцией органических катионов и неорганических анионов. Высокие защитные свойства таких ингибиторов, как катапин (алкилбензилпиридинийхлорид), несомненно обусловлены этим же эффектом.
Иофа с сотр. [64] исследовал влияние трех н-алкилбензилпи-
ридинийхлоридов [R(CH2)„CH2<Q>CH2n£^]+C1- (где R—-
СН3, С2Н5 и изс-С3Н7 соответственно). Сами по себе органические катионы катапина, так же как и тетраалкиламмоний, слабо адсорбируются на железе, поскольку его поверхность в серной кислоте заряжена положительно. Но ионы хлора, получающиеся в ре
зультате диссоциации катапина, адсорбируются на поверхности и уменьшают положительный заряд железа, облегчая адсорбцию органических катионов. Благодаря этому катапины и проявляют свои ингибирующие свойства (табл. 4,1). Еще больше можно повысить ингибиторный эффект, если ввести в кислоту дополнительно ани — онактивные вещества, например Na2S, сульфосалициловую кислоту (ССК) и йодистый калий, которые при адсорбции создают отрицательный адсорбционный потенциал, облегчающий адсорбцию органических катионов.
Заметим, кстати, что эти анионоактивные вещества сами по себе стимулируют коррозию из-за возникновения отрицательного адсорбционного потенциала (для 0,001 н. Na2S в 1 и. H2SOi у=0,2; для 0,01 М ССК у=0>08).
Наибольший ингибирующий эффект в присутствии метил катапина достигается введением Na2S (у=290) и KI (у=210). Без добавок анионоактивных веществ защитный эффект метилкатапи — на (0,25 г/л) составляет у=19.
Исследование дифференциальной емкости электрода показало, что при введении в серную кислоту нзопропилкатапина емкость падает и сохраняется на низком уровне в широкой области потенциалов. Это свидетельствует о том, что адсорбция не носит электростатический характер. Далее, учитывая, что ничтожные добавки Na2S (10~3 н.), СКК (Ю-3 М), KI (2-Ю-4 М) приводит к колоссальным эффектам, надо полагать, что механизм их действия не сводится лишь к изменению степени покрытия.
Синергетический эффект может быть наглядно продемонстрирован [65] и на примере совместного действия технических ингибиторов и галогенидов (табл. 4,2).
Эффект синергизма проявляется и на титане. В присутствии катапина и других катионоактивных веществ Брынза изучил следующие анионоактивные добавки: хлорид, бромид, иодид и роданид калия, тиокарбамид и калиевую соль бензосульфокислоты. Анионоактивные добавки сами слабо ингибируют коррозию титана в серной кислоте. В связи с возникновением отрицательного ад-
|
Таблица 4,1. Защитный эффект* у катапинов (2,5 г/л) по отношению к железу в присутствии анионоактивных добавок
* Выражается через отношенме рости коррозии с ингибитором. скорости коррозии без ингибитора к ско- |
![]()
сорбционного потенциала они ускоряют разряд ионов гидроксония и этим ослабляют эффект, возникающий из-за покрытия электрода анионами (эффект блокировки). Однако в присутствии органических катионов, в частности катапина, анионоактивные добавки усиливают защитные свойства катионов. По своей активности, т. е. способности вызывать максимальную защиту при минимальной концентрации, изученные анионоактивные вещества располагаются
|
Таблица 4,2. Скорость коррозии k0 стали 40Х в 6 н. H2S04 в присутствии ингибиторов и галогенидов
|
в следующий ряд: KCNS>KI> (NH2)2CS>C6H5S03K>KBr> ЖС1. Механизм действия анионоактивных веществ связывают с тем, что адсорбированные анионоактивные вещества создают соединительные мостики. между атомами металла и органическими катионами.
Механизм действия тиокарбамида в качестве ингибитора также связывают с эффектом синергизма, поскольку при восстановлении тиокарбамида или разложении его производных (фенилтио — карбамида, дифенилтиокарбамида, аллилтиокарбамида) в электролите образуются сульфид-ионы, облегчающие адсорбцию органических катионов:
C, H5NCSNH2 + 8Н + 2Н+ ——- > CeH5NHs + СН4 + H2S + NH+ (4,39)
(NH2)2CS + 6е“ + 8Н+ —— v H2S + CH3NH3 +NH+ (4,40)
(RNH)2CS + V,0, + 2e“ ——— ► (RNH)2CO + S2" (4,41)
Но как показал Каваларо, йодистый калий не усиливает за
щитные свойства замещенных тиокарбамида, на основании чего был сделан вывод, что эти соединения действуют по молекулярному механизму.
Иногда адсорбцию ингибитора могут облегчить и сами металлы, а также некоторые компоненты, содержащиеся в коррозионной среде. Давно замечено, что органические катионы лучше адсорбируются на стали и никеле, чем на чистом железе. Объясняется это тем, что в стали содержится сера, а также ряд сульфидных соединений, которые при коррозии в кислом электролите поставляют сульфид-ионы, облегчающие адсорбцию органических катионов. Поэтому ингибиторами защитить от коррозии сталь, являющуюся, в принципе, менее коррозионностойкой, легче, чем чистое железо.
К сожалению, еще очень мало известно о природе химической связи ингибитор — металл, поэтому среди исследователей нет единой точки зрения на механизм синергетического эффекта. Иофа [64] считает, что многие органические ингибиторы в кислых электролитах протонизируются, превращаясь в катионы по схеме:
|
R2As + Н+ ——- ^ |
[R2AsH]+ |
|
R3P+H+ —>. |
[R3PH]+ |
|
R3N + Н+ ——- v |
[R3NH]+ |
|
R2S=0+ Н+ — ► |
[R2SOH]+ |
|
RNH |
Г RNH |
|
^c=s + Н+———— >- |
|
|
RNH |
LRNH |
|
+ |
Адсорбция этих катионов облегчается в присутствии галогенид- ионов, создающих промежуточные мостики, которые своими отрицательными концами диполя галоген — металл обращены в сторону раствора. Другие авторы объясняют синергетический эффект изменением потенциала нулевого заряда. Диполи образующегося поверхностного соединения ориентируются своим отрицательным концом в сторону раствора и создают тем самым дополнительную разность потенциалов между металлом и раствором. Это является причиной сдвига потенциала нулевого заряда в положительную сторону. Это смещение делает заряд поверхности металла более отрицательным и облегчает адсорбцию положительно заряженных органических катионов.
Гипотезы об образовании промежуточных мостиков, изменениях адсорбционного потенциала и точки нулевого заряда строятся на том, что ингибиторы адсорбируются в ионной форме. Однако некоторые авторы придерживаются другой точки зрения и считают, что ингибиторы действуют по молекулярному механизму. Возникающие в результате реакции протонизации органические катионы, по их мнению, существуют лишь в растворе. На электроде они разряжаются, например, по схеме
R—NH+ — f — е~ —— > R—NHa + 1/2Н2 (органические вещества)
^NH+ + ё~ ——— >- — f 1/2Н2 (гетероциклы)
Получающиеся молекулы хемосорбируются за счет неспаренного электрона гетероатома. Эффект синергизма при этом объясняют образованием ковалентной связи между деионизированной молекулой ингибитора и адсорбированным галогеном.
И, наконец, можно объяснить эффект синергизма с учетом адсорбционных явлений. Известно, что при больших степенях заполнения поверхности адсорбатом могут проявляться между адсорбированными катионами кулоновские силы отталкивания. При адсорбции катионов и анионов, по-видимому, возникают электростатические силы притяжения между разноименными ионами, которые уплотняют пленку. Антропов [59] увеличение степени адсорбции органических катионов, в частности пиридиновых производных, в присутствии галогенид-ионов объясняет именно этим эффектом, т. е. изменением характера взаимодействия между адсорбированными частицами ингибиторов. Изотермы адсорбции при совместной адсорбции катионов и анионоз приобретают s-образную форму, что, по мнению автора, указывает на преобладание сил Ван-дер-Ваальса и кулоновского притяжений над силами кулоновского отталкивания.
 27 августа, 2015
27 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 