Рассмотрим влияние на кинетику электродных процессов ингибиторов коррозии, введенных в электролит, и последствия, к которым это может привести. Прежде всего поясним некоторые термины, которыми в дальнейшем будем пользоваться. Условимся под скоростью общей коррозии понимать потерю массы с единицы по
верхности в единицу времени, рассчитанную на всю поверхность корродирующего образца; интенсивностью коррозии назовем скорость коррозионного процесса, рассчитанную на единицу поверхности, подвергшейся коррозионным разрушениям. Для простоты расчета воспользуемся упрощенной поляризационной диаграммой, согласно которой потенциалы электрода изменяют свои значения в зависимости от силы тока по линейному закону (см. рис. 3,1).
Уравнение кривой катодной поляризации для этого случая имеет вид
Фк = фк —Ki UJFK) (3,9)
а уравнение кривой для анодной поляризации
Фа = фа ~Ь 0/Ра) (3,Ю)
где К и Кг— константы поляризуемости катода и анода при плотности тока, равной единице; FK и F& — площади пассивной (катод) и активной части электрода (анод).
Сила коррозионного тока системы определяется уравнением
В зависимости от того, на какой электродный процесс оказывает влияние ингибитор, и учитывая характер контроля скорости коррозионного процесса, можно представить девять возможных случаев проявления действия ингибиторов.
A. Ингибитор тормозит исключительно анодную реакцию:
1) ингибитор анодный — контроль анодный; 2) ингибитор анодный — контроль смешанный; 3) ингибитор анодный — контроль катодный.
Б. Ингибитор тормозит исключительно катодную реакцию:
1) ингибитор катодный — контроль анодный; 2) ингибитор катодный— контроль смешанный; 3) ингибитор катодный — контроль катодный.
B. Ингибитор тормозит обе электродные реакции: 1) ингибитор смешанный — контроль анодный, 2) ингибитор смешанный — контроль смешанный, 3) ингибитор смешанный — контроль катодный.
Графически все перечисленные выше случаи изображены на рис. 3,2. Простое рассмотрение диаграмм коррозионного процесса показывает, что метод исследования электродных потенциалов металла дает возможность качественно классифицировать ингибиторы по механизму их действия.
Анодный ингибитор, введенный в электролит, в случае, когда процесс коррозии контролируется исключительно анодной реакцией, не изменяет потенциал металла. В двух других случаях смешанного и преимущественно катодного контроля электродный потенциал металла смещается в положительную сторону.
Катодный ингибитор во всех случаях, кроме того, когда скорость процесса контролируется нацело катодной реакцией и элек-
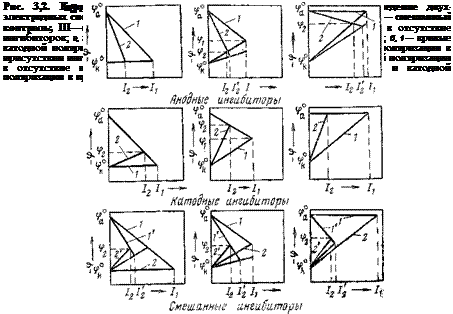 |
тродный потенциал металла равен благодаря этому потенциалу анодных участков, приводит к смещению потенциала в отрицательную сторону.
Значительно труднее определить механизм действия ингибитора по значению электродного потенциала, когда ингибитор вмешивается в обе электродные реакции, т. е. когда он является смешанным. Однако, как нетрудно видеть, и в этом случае при анодном контроле скорости коррозии потенциал металла становится более отрицательным, а в случае катодного контроля — более положительным.
При смешанном контроле, в зависимости от того, какую реакцию сильнее тормозит ингибитор, электродный потенциал металла может изменять свое значение в положительную или отрицательную сторону и при равном торможении электродных реакций остаться таким же, как в исходном электролите. Когда ингибитор увеличивает лишь эффективность катодного процесса, а металл остается в частично запассивированном состоянии, потенциал ме
талла сдвигается в положительную сторону, а коррозионный ток растет.
Рассмотрим подробнее поведение отдельных классов ингибиторов.
 24 августа, 2015
24 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 