Большинство эффективных ингибиторов проявляют в нейтральных электролитах защитные свойства благодаря пассивированию металлов. Следует подчеркнуть, что в вопросе пассивирования металлов ингибиторами, как и во взглядах на само явление пассивации, среди исследователей нет еще единой точки зрения. Однако, когда мы имеем дело с ингибиторами, окислительные свойства которых проявляются івполне отчетливо, удается найти однозначное объяснение механизму пассивации.
Восстанавливаясь с достаточной скоростью в любых электролитах, такие ингибиторы за счет внутренней анодной поляризации смещают потенциал к значениям, достаточным для осаждения на поверхности металла пассивирующего окисла фазового или адсорбционного характера. И в этом случае не обходится без трудностей, так как высокая скорость восстановления не всегда обеспечивает пассивацию. Например, перманганат калия легко восстанавливается почти на всех технически важных металлах, но, тем не менее, он является слабым ингибитором. Важное значение здесь имеет способность ионов или нейтральных молекул к адсорбции, которая облегчает пассивацию.
Если ингибитор не способен восстанавливаться или восстанавливается с незначительной скоростью, то сразу возникает вопрос: какая катодная реакция обеспечивает осаждение пассивирующего окисла и поддержание его в устойчивом состоянии? Здесь предлагаются два механизма. Согласно одному из них уже небольшая скорость восстановления ингибитора достаточна для того, чтобы поддерживать металл в пассивном состоянии, поскольку восстановленная форма ингибитора, например СГ2О3, входит в состав пассивирующего окисла, который приобретает благодаря этому более высокие защитные свойства. Согласно другому, пассивация при малых катодных токах возможна из-за того, что большинство эффективных ингибиторов относится к хорошо адсорбируемым соединениям, в силу чего большинство активных центров на поверхности защищаемого металла оказываются химически или физически связанными с ингибитором. В таких условиях уже незначительные катодные плотности тока (в расчете на всю геометрическую поверхность) достаточны для того, чтобы сместить потенциал к значениям, при которых осаждается пассивирующий окисел.
Исходя из этих рассуждений, рассмотрим механизм пассивации металлов ингибиторами, разбив их на три класса: 1) ингибиторы, отличающиеся высокими окислительными свойствами; 2) ингибиторы, не обладающие окислительными свойствами, но образующие труднорастворимые соединения; 3) ингибиторы с анионом типа МОЇ", отличающиеся слабыми окислительными свойствами.
Как показано выше, чтобы перевести железо или сталь в пассивное состояние, требуется в нейтральном электролите сместить его потенциал до +0,3-:—1-0,5 В, на что при внешней анодной поляризации в зависимости от скорости изменения потенциала требуется от 50 до 250 мА/см2. Если стоять на чисто электрохимических позициях и не приписывать ингибитору какого-либо специфического влияния, то полной защиты, например, стали в сульфатном растворе (0,1-М,0 н.) можно добиться лишь в случае, когда внутренний ток окислительно-восстановительной реакции превысит ток пассивации.
Подобных ингибиторов, которые восстанавливались бы с такой большой скоростью в нейтральных электролитах, не существует, поэтому запассивировать металл лишь за счет внутреннего тока катодной реакции не удавалось. Более того, такие ингибиторы, смещая потенциал в положительную сторону, но не выводя его за пределы потенциала пассивации, увеличивали лишь скорость коррозии, т. е. фактически не являлись ингибиторами.
Тем не менее такой принцип защиты был за последние годы реализован благодаря сочетанию в одном соединении легко восстанавливающегося аниона и хорошо адсорбирующегося катиона [38]. В условиях, когда значительная часть поверхности занята прочно адсорбированными катионами или молекулами ингибитора,
можно запассивировать металл и при меньших плотностях тока ~5—10 мА/см2. Неорганические ингибиторы обеспечить такие плотности тока, естественно, не могут.
Типичными представителями ингибиторов, действующих по указанному механизму, являются нитробензоаты и динитробензоаты аминов. С их помощью удается успешно защитить от коррозии большое число технически важных металлов. В водной среде нит — робензоатный ион подвергается протонизации с превращением в активный комплекс, который легко восстанавливается до гидроксиламинного производного
Ж)2 Ж>2Н+
Как видно, продукты восстановления ингибитора не могут войти в состав защитного слоя, возникающего на поверхности стали. Не могут они и окислить первоначально образующуюся в активной области потенциалов пленку Fe304 до окисла более высокой валентности Fe203. Поэтому остается допустить, что при достижении определенного потенциала в роли пассиватора выступает не ингибитор, а другой пассивирующий агент. Источником кислорода, который необходим для возникновения на поверхности стали пассивирующего окисла более высокой валентности, является кислород воды
2Fe304 + Н20 — 2е~ ———- ^ 3y-Fe203 + 2Н+ (2,18)
Ингибитор же выступает в основном в роли акцептора электронов, т. е. движущей силы анодной реакции, хотя, как уже указывалось, адсорбция катионов или молекул ингибитора облегчает защиту. Электронографическими исследованиями поверхности стали после воздействия нитробензоатов аминов не обнаружено никаких элементорганических соединений, а зафиксировано лишь наличие на поверхности окисла железа более высокой валентности.
Пассивирование с помощью нитробензоатов аминов является, таким образом, типичным примером пассивирования металла за счет ускорения катодной реакции восстановления ингибитора, которая сообщает электроду необходимый потенциал. Каким же образом достигается пассивация при использовании ингибиторов, не обладающих окислительными свойствами или обладающих таковым!!, но восстанавливающихся с большим перенапряжением? На этот вопрос можно частично получить ответ, используя метод химической пассивации, а также другие физико-химические методы исследования ингибиторов.
Метод изучения химической пассивации заключается в исследовании зависимости скорости растворения металла от потенциала, который задается электроду не с помощью внешней анодной поляризации, а введением в электролит химических соединений. Этот метод позволяет, судя по результатам, которые будут изложены ниже, получать ценную информацию о механизме действия ингибиторов вблизи стационарных потенциалов, чего не позволяет метод внешней анодной поляризации, сильно сдвигающий потенциал в положительную сторону.
При внешней анодной поляризации трудно отделить пассиваци — онные эффекты, возникающие за счет адсорбции кислорода, от пассивационных эффектов, возникающих за счет адсорбции ингибиторов. Объясняется это тем, что упомянутые эффекты не аддитивны; чаще всего внешняя анодная поляризация облегчает адсорбцию ингибирующих анионов и делает прочнее их химическую связь с металлом. Поскольку в реальных условиях применения ингибиторов внешней анодной поляризации чаще всего не бывает, результаты, получаемые при внешней анодной поляризации, следует дополнять или перепроверять методами химической пассивации.
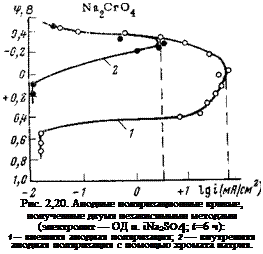
Метод химической пассивации позволяет получать для металлов, склонных переходить в пассивное состояние, такие же поляризационные диаграммы, которые получаются при внешней анодной поляризации. Эти диаграммы имеют участки, характерные для активного растворения, активно-пассивного состояния и пассивного состояния. На рис. 2,18 представлены кривые зависимости скорости коррозии стали от потенциала, который задавался электроду с помощью различных концентраций едкого натра, силиката, фосфата и пербората натрия. Как видно, закономерность получается такая же, как и при внешней анодной поляризации. В начале диаграммы имеется активная область растворения, в которой смещение потенциала в положительную сторону приводит к увеличению скорости растворения. После достижения определенного потенциала, который назовем потенциалом частичной пассивации, скорость растворения начинает падать. Полная пассивация наступает в присутствии этих ингибиторов практически при одинаковых значениях потенциала (+0,2ч-+0,25 В).
Интересна поляризационная кривая, полученная для щелочи. На ней потенциал частичной пассивации совпадает с потенциалом полной пассивации. Как только потенциал электрода достигает •—Ь0,2 В, начинается быстрая пассивация электрода: скорость растворения падает, а потенциал остается постоянным.
Поляризационные кривые, полученные для других ингибиторов, имеют разный наклон и в области активного растворения, и в области активно-пассивного состояния. Поскольку рассматриваемые
|
Рис. 2,18. Зависимость плотности тока коррозии стали от потенциала, который задается электроду ингибиторами неокислительного типа (фон — 0,1 н. Na2S04; t= 10 сут; внизу справа — кривые изменения площади активной части электрода в заівисимости от концентрации ингибитора). |
ингибиторы не способны участвовать непосредственно в катодном процессе, неясно, каким образом они могут в активной области растворения увеличивать скорость анодной реакции и какая катодная реакция обеспечивает осаждение пассивирующего окисла.
Анализ показывает, что устанавливающиеся на электроде значения потенциалов в активной области не могут быть обусловлены изменением кинетики анодной реакции. Если бы это смещение потенциала в положительную сторону явилось результатом замедления анодной реакции, то оно сопровождалось бы уменьшением коррозионного тока.
В отсутствие внешней поляризации без изменения эффективности катодного процесса нельзя себе представить, каким образом увеличивается плотность коррозионного тока при одновременном смещении потенциала в положительную сторону. Поскольку эти ингибиторы не могут принимать участия в катодной реакции, приходится искать другие возможности изменения эффективности катодного процесса.
Наблюдения за поведением электрода показывают, что по мере увеличения концентрации ингибиторов в растворе происходит частичное пассивирование электрода и анодная реакция протекает лишь на части поверхности. Значительная часть электрода выводится из сферы анодной реакции. С помощью микроскопа с рисовальным аппаратом или более простыми методами можно с достаточной точностью определить величину поверхности электрода, на которой происходит активное растворение, и рассчитать истинную плотность анодного тока. По характеру изменения активной части электрода щелочи отличаются от бората и фосфата (ом. рис. 2,18).
Если для щелочи и силиката характерно непрерывное уменьшение с ростом концентрации ингибитора активной части поверхности, то для бората и фосфата активная часть поверхности меняется лишь в активной области потенциалов. Когда металл находится на границе активно-пассивного состояния, активная часть поверхности остается постоянной и лишь при приближении к потенциалу полной пассивации она начинает вновь сокращаться до тех пор, пока металл не перейдет полностью в пассивное состояние.
Все это наводит на мысль, что гидроксильные ионы играют особую роль в процессе пассивации. Их пассивирующие свойства проявляются, однако, лишь при достижении определенного потенциала, который более положителен, чем у других исследованных анионов. Гидроксильные ионы сами по себе не замедляют кинетику анодной реакции на активной части электрода, пока потенциал не достигнет +0,2 В, чем и отличаются от других ингибиторов этого класса, которые уже при потенциалах —0,300-4—0,400 мВ начинают резко замедлять скорость растворения (см. рис. 2,18). Ионы гидроксила при потенциалах более отрицательных, чем +0,2 В, ускоряют анодную реакцию, а при потенциалах более положительных, чем +0,2 В, пассивируют металл. Это объясняется тем, что они, как было выше показано, принимают непосредственное участие в элементарном акте растворения, образуя промежуточный комплекс, который в зависимости от потенциала может либо перейти в раствор, либо остаться на поверхности металла.
Поскольку ингибиторы, образующие труднорастворимые соединения, выводят значительную часть поверхности электрода из сферы анодной реакции, то это, естественно, должно уменьшить общий коррозионный ток. Однако прямой зависимости между этими двумя параметрами не наблюдается (табл. 2,1). Коррозионный ток уменьшается не пропорционально доли запассивированной части поверхности; степень покрытия 0 поверхности труднорастворимым соединением или пассивирующим окислом всегда опережает степень изменения суммарного коррозионного тока /, что и приводит к увеличению скорости растворения (плотности тока і) на той части электрода, которая осталась в активном состоянии.
Механизм этого явления можно объяснить тем, что благодаря пассивации значительной части поверхности увеличивается катодный ток восстановления кислорода и благодаря внутренней анодной поляризации ускоряется анодная реакция на активной части электрода. Можно считать, что при потенциале частичной пасси — вацни изученные ингибиторы увеличивают скорость растворения на активной части электрода в среднем в 10 раз.
Аналогичная закономерность должна наблюдаться, исходя из общих представлений электрохимической кинетики, и в отсутствие строгой локализации электрохимических реакций по поверхности. Любой ингибитор, который благодаря адсорбции или осаждению труднорастворимых соединений смещает потенциал металла в положительную сторону, оставляя металл в активном состоянии, должен увеличивать скорость анодной реакции. При этом чем меньше анодная поляризуемость системы, тем сильнее при одинаковом приращении потенциала будет изменяться анодный ток.
Здесь уместно заметить, что со смещением потенциала в положительную сторону должна уменьшаться скорость катодной реакции, а поскольку эти реакции сопряжены, то это должно уменьшать коррозию. Однако если учесть, что большинство коррозионных процессов с кислородной деполяризацией протекают с катодным ограничением, т. е. с большой поляризуемостью катодной реакции, то при одном и том же сдвиге потенциала в положительную сторону скорость катодной реакции изменится в меньшей степени, нежели скорость анодной реакции. В результате этого частичная пассивация электрода, вне зависимости от того, наблюдается ли локализация электрохимических реакций по понерхности или нет, должна приводить к увеличению скорости растворения металла.
Исследование соединений, способных частично пассивировать металл, показывает, таким образом, что при малых концентрациях они могут привести к увеличению скорости анодной реакции и в условиях, когда ингибитор непосредственного участия в катодной реакции не принимает.
На основании изложенного механизм действия ингибиторов неокислительного типа можно представить следующим образом: затормозив анодную реакцию ионизации металла благодаря образованию труднорастворимых соединений или непосредственного электрохимического окисления металла, эти ингибиторы смещают потенциал металла к таким значениям, при которых становится возможным окисление металла кислородом воды. При покрытии значительной части электрода труднорастворимым соединением
|
Таблица 2,1. Сравнительные данные об изменении ингибиторами 0, / и і при потенциале частичной пассивации
|
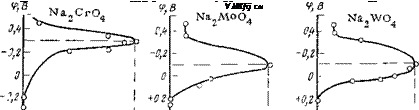 |
Рис. 2,19. Зависимость плотности тока коррозии стали от потенциала, который задается электроду ингибиторами с общим анионом типа МОЇ" (фон — 0,1 н.
Na2S04; /=10 сут).
уменьшаются токи пассивации, поэтому те плотности тока, которые возникают за счет обычной реакции восстановления кислорода, достаточны, чтобы поддержать потенциал на уровне, необходимом для пассивации. Здесь проявляется своеобразный внутренний синергетический эффект, заключающийся в том, что ингибитор облегчает пассивацию металла кислородом воды, хотя сам он в катодном процессе не участвует.
Итак, мы рассмотрели два класса ингибиторов, отличающихся прямо противоположными свойствами; одни относятся к сильным окислителям, действующим преимущественно как стимуляторы катодного процесса и косвенно замедляющим анодный, другие, не обладая окислительными свойствами, оказывают благодаря частичной пассивации электрода косвенное влияние на катодную реакцию, увеличивая ее скорость, и непосредственно влияют на анодную реакцию, замедляя ее.
Осталось рассмотреть третий класс ингибиторов, который можно отнести к соединениям, отличающимся слабыми окислительными свойствами и имеющим общий анион типа МОЇ^. На рис. 2,19 представлена зависимость скорости коррозии стали от потенциала, который задавался электроду с помощью указанных ингибиторов. Как видно, вначале адсорбция некоторого количества пассивирующего агента приводит к смещению потенциала в положительную сторону и увеличению скорости растворения. Получается типичный участок анодной поляризационной кривой, характерный для активного растворения. Поскольку эти ингибиторы относятся к соединениям окислительного типа, можно было бы предположить, что смещение потенциала в положительную сторону, сопровождающееся увеличением скорости растворения, обусловлено, как и в случае рассмотренных выше нитробензоатов аминов, увеличением эффективности катодного процесса вследствие восстановления этих ингибиторов. Однако это не так. Метод внутренней поляризации с помощью ингибиторов или других химических соедине-
«ий позволяет получить и катодные поляризационные кривые для реального коррозионного процесса. Располагая данными о скорости растворения при каждом потенциале и о величине пассивной части поверхности и полагая, что катодная реакция протекает на пассивной части электрода, можно рассчитать истинную плотность тока при каждом потенциале и таким образом получить реальные катодные поляризационные кривые.
 Исследование кинетики катодной реакции на стальном электроде в интервале потенциалов, характерных для пассивного ( + 0,2 В) и активного (—0,4 В) состояний, показало, что эффективность катодного процесса в присутствии рассматриваемых ингибиторов не увеличивается, а остается такой же, как в электролите, «е содержащем ингибиторов (£к= 154-20 мкА/см2). Отсюда можно сделать вывод, что указанные ингибиторы не принимают участия в катодном процессе.
Исследование кинетики катодной реакции на стальном электроде в интервале потенциалов, характерных для пассивного ( + 0,2 В) и активного (—0,4 В) состояний, показало, что эффективность катодного процесса в присутствии рассматриваемых ингибиторов не увеличивается, а остается такой же, как в электролите, «е содержащем ингибиторов (£к= 154-20 мкА/см2). Отсюда можно сделать вывод, что указанные ингибиторы не принимают участия в катодном процессе.
Изучение возможности восстановления этих же ингибиторов в более широкой области потенциалов на платине показало, что ни один из них не восстанавливается при потенциалах коррозии. Более того, реакция восстановления кислорода, растворенного в электролите, в присутствии, например, хромата даже замедляется. Иногда в продуктах коррозии, а также на поверхности электрода обнаруживаются соединения трехвалентного хрома. Однако их происхождение является, очевидно, результатом окисления двухвалентных ионов железа, перешедших в раствор. В тех же случаях, когда достигается полная защита, соединения трехвалентного хрома не обнаруживаются на электроде. Это свидетельствует о том, что хромат-ионы адсорбируются поверхностью и не претерпевают химических превращений. Отсюда напрашивается вывод, что реакция восстановления ингибиторов с общим анионом типа МО£ не может быть ответственной ни за увеличение скорости растворения стали, находящейся частично в активном состоянии, ни за образование пассивирующего слоя, переводящего металл в пассивное состояние.
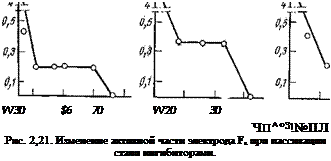
Исследование зависимости скорости растворения стали от потенциала двумя независимыми методами — внешней анодной поляризацией и внутренней с помощью ингибиторов (рис. 2,20) по-
 |
|
казало, что при потенциалах, характерных для активного растворения (—0,5-:—0,3 В), хромат-ионы не изменяют скорости анодной реакции (экспериментальные точки ложатся на одну кривую). Ингибитор лишь сдвигает потенциал пассивации в отрицательную сторону и уменьшает более чем на порядок ток пассивации. Если скорость диодной реакции не меняется, а ингибитор не участвует в катодном процессе, тогда за счет чего же смещается потенциал в положительную сторону и увеличивается скорость растворения? Изучение поверхности электрода в ингибированных и неингибированных электролитах позволило обосновать механизм растворения и пассивации без непосредственного участия ингибиторов в катодном процессе. Оказалось, что, так же как и в случае рассмотренных выше ингибиторов неокислительного типа, при введении в электролит ингибиторов с общим анионом типа МО"’ происходит частичная пассивация электрода и значительная его часть выводится из сферы анодной реакции. При этом важно обратить внимание на то, что такая частичная пассивация происходит лишь в области активного растворения и заканчивается при потенциале частичной пассивации. В активно-пассивной области степень покрытия электрода пассивирующим окислом или кислородом не меняется в широкой области потенциалов и лишь при приближении к потенциалу полной пассивации поверхность электрода начинает вновь покрываться защитным слоем (рис. 2,21).
Подобная закономерность в изменении соотношения между активной и пассивной частями поверхности сложного электрода позволяет объяснить весь ход поляризационных кривых. Поскольку в активной области степень запассивированности поверхности непрерывно растет, это должно привести к увеличению эффективности обычного катодного процесса восстановления растворенного в электролите кислорода, который протекает на пассивной части электрода. Такая дифференциация электрохимических реакций по поверхности частично запассивированного электрода приводит к
внутренней анодной поляризации активной части электрода, смещающей потенциал в положительную сторону и увеличивающей скорость растворения. Это можно проиллюстрировать экспериментальными данными, представленными в табл. 2,2. Так же, как и ингибиторы, образующие труднорастворимые соединения, ингибиторы, содержащие общий анион типа МО!", в значительно большей степени пассивируют поверхность, нежели уменьшают общую коррозию. Вследствие этого плотность тока возрастает на той части поверхности, которая осталась в активном состоянии. Характерно, что хотя эти ингибиторы обладают некоторыми окислительными свойствами, плотность тока в их присутствии увеличивается на активной части электрода в меньшей степени, чем у ингибиторов, не обладающих окислительными свойствами (табл. 2,2). Это также свидетельствует в пользу того, что они не восстанавливаются.
При потенциалах более положительных потенциала частичной пассивации механизм процесса меняется, его скорость перестает зависеть от скорости катодной реакции и определяется уже скоростью анодной реакции. Поскольку при потенциалах, характерных для активно-пассивного состояния электрода, соотношение между пассивной и активной частями поверхности не меняется и, следовательно, об увеличении эффективности катодного процесса говорить не приходится, уменьшение скорости растворения при дальнейшем смещении потенциала в положительную сторону можно объяснить лишь тем, что ингибитор начинает оказывать непосредственное влияние на анодную реакцию, замедляя ее. Как видно, имеется принципиальное различие в механизме действия изученных ингибиторов в случаях, когда электрод находится в активном и активно-пассивном состояниях; в первом случае ингибиторы увеличивают эффективность катодного процесса, не вмешиваясь в анодный, во втором — уменьшают скорость анодного процесса, не вмешиваясь в катодный.
Заслуживает также внимания тот факт, что если в области активного растворения, а также на границе активно-пассивного состояния изученные ингибиторы оказывают косвенное или прямое влияние на скорость электродных реакций, проявляя специфические свойства (различные скорости растворения при одном и том
|
Таблица 2,2. Сравнительные данные об изменении 0, / и і ингибиторами с общим анионом МО"~ при потенциале частичной пассивации
|
же потенциале), то при переходе металла в пассивное состояние индивидуальные свойства ингибиторов как бы исчезают — полное пассивное состояние в присутствии всех изученных ингибиторов наступает примерно при одинаковых значениях потенциала (+0,24-+0,25 В). По-видимому, вблизи потенциала полной пассивации функции пассивирующего агента берет на себя другой пассиватор, вероятно, кислород воды, переводящий Fe304 в окисел более высокой валентности y-Fe203 по реакции (1,24). Этот окисел, как полагают, отличается более высокими пассивирующими свойствами. Стандартный потенциал этой реакции, по Феттеру [13, с. 831], равен +0,63 В (АН=—7942 Дж/моль). С учетом pH для нейтральных электролитов получаем ~+0,2 В, что указывает на возможность протекания этой реакции при регистрируемых потенциалах.
Учитывая рассмотренные выше закономерности, можно полагать, что при внутренней анодной поляризации стали ингибиторами с общим анионом типа М01~ природа пассивирующих слоев остается такой же, как и при внешней анодной поляризации. Специфическое действие ингибиторов проявляется в том, что, адсорбируясь на поверхности металла, они понижают общую свободную энергию системы и повышают стабильность пассивных пленок. В зависимости от природы адсорбированных частиц, их концентрации на поверхности и прочности связи меняется скорость растворения, поляризуемость и плотность тока, необходимая для пассивации, а также потенциал пассивации. В таких условиях пассивация может наступить и без большого внутреннего тока окислительновосстановительной реакции ингибитора лишь за счет небольших плотностей тока реакции восстановления кислорода, растворенного в электролите.
Другой важный вывод, вытекающий из изложенного, заключается в том, что при химической пассивации потенциал не всегда однозначно определяет скорость растворения. В тех случаях, когда значение потенциала, устанавливающееся на электроде, обусловлено изменением скорости обеих электродных реакций, внешняя анодная поляризация уже не тождественна внутренней анодной поляризации, как это отмечалось в работе [41], где скорость анодной реакции при введении окислителя не менялась. В наших условиях в зависимости от природы адсорбирующегося иона и характера его связи с металлической поверхностью можно при одном и том же потенциале наблюдать самые разнообразные скорости растворения.
Следует заметить, что не все кислородсодержащие ингибиторы обнаруживают такую же зависимость скорости растворения от потенциала, которая была выше рассмотрена. Строение молекул ингибиторов оказывает большое влияние на механизм защиты. В этом отношении показательно поведение метаванадата и орто — ванадата натрия. Оба эти соединения являются хорошими ингибиторами, однако действуют они по-разному, несмотря на то, что
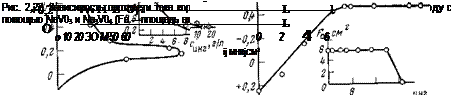 |
валентность ванадия в этих соединениях одинакова. В присутствии метаванадата NaV03 не наблюдается активной ветви на поляризационной кривой; с увеличением концентрации этого ингибитора в электролите потенциал электрода не меняется, а скорость коррозии падает (рис. 2,22). Иными словами, скорость растворения не зависит от потенциала.
Такое поведение электрода объясняется тем, что метаванадат не изменяет активную часть электрода вплоть до потенциала пассивации (см. рис. 2,22). Поскольку металл частично не пассивируется, то не изменяется и эффективность катодного процесса, которая, как было выше показано, ответственна за увеличение скорости растворения. Лишь при приближении к потенциалу полной пассивации электрод полностью пассивируется, а до этого он находится в активном состоянии.
Ортованадат Na3VC>4 изменяет скорость анодной реакции по- другому: малые концентрации ингибитора (до 2 г/л) не изменяют активную часть поверхности; потенциал при этом также слабо меняется, в результате чего скорость коррозии не претерпевает существенных изменений. Начиная с определенной концентрации ингибитора, наблюдается непрерывное уменьшение активной части поверхности, т. е. происходит частичная пассивация электрода. В результате увеличивается эффективность катодного процесса и потенциал электрода смещается в положительную сторону. Когда потенциал электрода достигает примерно —0,175 В, начинается активное воздействие ингибитора на анодную реакцию и скорость растворения падает. При потенциале ~ +0,2 В электрод переходит в пассивное состояние. Таким образом, механизм защиты и поведение электрода при неполной _защите определяются различиями в строении анионов VOf~ и УОз. При этом метаванадат натрия является единственным известным анодным ингибитором, который не способен усиливать коррозию при неполной защите. Его подоб
но катодным ингибиторам можно отнести к безопасным ингибиторам. Это его свойство обусловлено тем, что он уменьшает скорость анодной реакции, не пассивируя частично электрод, а оставляя его до потенциала полной пассивации в активном или активно-пассивном состояниях. В -0,1 связи с этим интенсивность коррозии не возрастает, а скорость непрерывно падает.
![]()
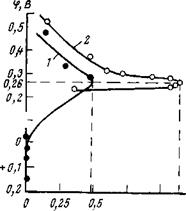 В заключение необходимо рассмотреть роль сжисных пленок, образующихся на сталях на воздухе. Как показали исследования, эта пленка облегчает :пасси-Рис — 2>23- Влияние ошсной пленки на пяттмтп ртяпи пассивацию стали в 0,1 н. Na2S04 м-нит-
В заключение необходимо рассмотреть роль сжисных пленок, образующихся на сталях на воздухе. Как показали исследования, эта пленка облегчает :пасси-Рис — 2>23- Влияние ошсной пленки на пяттмтп ртяпи пассивацию стали в 0,1 н. Na2S04 м-нит-
ващш стали ингибиторами, для робензоатом гексаметиленамина:
ПОЛНОЙ пассивации предваритель-^^з предварительного травления электро — НО ТравлеНОГО электрода требует — да; 2 —с предварительным травлением, ся примерно в 8—10 раз более
 |
высокая концентрация ингибитора. Потенциал — пассивации как для травленого, так и нетравленого электрода один и тот же, что указывает на одинаковую природу пассивирующего слоя. Плотность же тока, при которой металл переходит в пассивное состояние, для травленого электрода в несколько раз выше, чем для нетравленого
 21 августа, 2015
21 августа, 2015  admin
admin 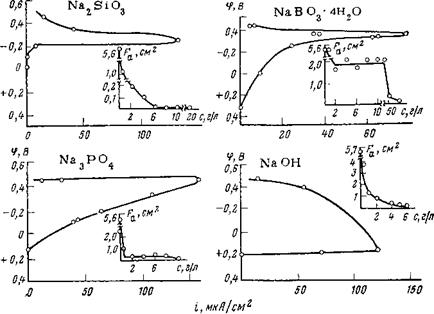
 Опубликовано в рубрике
Опубликовано в рубрике 