Рассмотрим случай, когда скорость коррозии замедляется благодаря введению в электролит ингибиторов, способных замедлять скорость катодной реакции. Последнее может быть достигнуто несколькими путями: 1) при использовании продуктов катодной реакции для ее же замедления; 2) при создании адсорбционных или
фазовых пленок ингибитора на поверхности металла, затрудняющих доступ деполяризатора к поверхности электрода; 3) при введении в электролит таких соединений, которые химически связывают деполяризатор.
Как известно, конечным продуктом катодной реакции для процессов коррозии с кислородной деполяризацией являются ионы гидроксила, образующиеся по схеме: первая стадия
02 + 2Н20 + 2ё~ ——- >• Н202 + 20Н~
вторая стадия
Н202 + 2е~——— > 20Н~
суммарная реакция
02 — f 2Н20 + 4<Г—— >• 40Н“
В связи с тем, что имеется относительно большая группа металлов, способных образовывать труднорастворимые гидраты, становится возможным использовать продукты катодной реакции, т. е. ионы гидроксила, для торможения катодного же процесса. Если ввести соль с подобным катионом в электролит, то в результате накопления щелочи в приэлектродном слое довольно быстро достигается предел растворимости и на электроде осаждается труднорастворимый гидрат. Осадок, экранируя электрод, затрудняет доступ кислорода и замедляет катодный процесс. Типичными представителями этого класса ингибиторов являются соли цинка и кальция.
На этом принципе основана защита бикарбонатом кальция стальных трубопроводов, нашедшая широкое применение в промышленности. Благодаря защелачиванию воды у поверхности металла, возникающему в результате катодной реакции, жесткая вода, содержащая бикарбонат кальция, способствует отложению на поверхности металла пленки из карбоната кальция и замедлению коррозии. При этом следует иметь в виду, что эффективность защиты зависит от температуры воды, поскольку растворимость карбоната кальция с температурой увеличивается и сформированная пленка может начать растворяться. По этому же принципу действуют и соли цинка.
Практика, однако, показывает, что за счет торможения одного катодного процесса, если только не удается его полностью приостановить, прекратить коррозию трудно. Катодные ингибиторы оказываются, как правило, менее эффективными, нежели анодные или смешанные ингибиторы, которые тормозят ту и другую реакции. Тем не менее катодные ингибиторы применяются на практике как самостоятельно, так и в смеси с анодными ингибиторами, поскольку они не имеют того недостатка, который свойствен анодным ингибиторам,—способности локализовать анодный процесс и увеличивать его скорость при неполной защите.
Учитывая механизм действия ингибиторов, образующих труднорастворимые гидраты, был предложен и реализован на практике
комбинированный метод защиты, заключающийся в применении протекторной защиты в комбинации с ингибиторной [46]. При этом исходили из того, что катодная поляризация железа приведет к более сильному защелачиванию электролита в приэлектродном слое, чем в условиях саморастворения, и непрерывному отложению гидрата цинка. Как и предполагалось, защита получилась превосходной.
 Применяя только ингибиторы [ZnS04, Са(Ж)3Ь]. Добиться защиты сварных и клепаных конструкций не удалось. Неэффективными в отсутствие ингибиторов оказались и цинковые протекторы, поскольку они довольно быстро подвергались заметной анодной пассивации. Совместное же применение цинковых протекторов с сернокислым цинком обеспечивало полную защиту.
Применяя только ингибиторы [ZnS04, Са(Ж)3Ь]. Добиться защиты сварных и клепаных конструкций не удалось. Неэффективными в отсутствие ингибиторов оказались и цинковые протекторы, поскольку они довольно быстро подвергались заметной анодной пассивации. Совместное же применение цинковых протекторов с сернокислым цинком обеспечивало полную защиту.
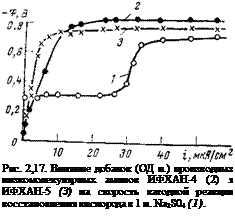
Другими соединениями, способными сильно тормозить катодную реакцию восстановления кислорода, являются ингибиторы типа ИФХАН. Они представляют собой производные низкомолекулярных аминов и действительно сильно тормозят катодную реакцию (рис. 2,17). Это могло явиться следствием либо уменьшения концентрации деполяризатора из-за взаимодействия с ним ингибитора, либо затруднения доступа деполяризатора к поверхности электрода. Исследование катодной реакции на вращающемся дисковом электроде показало, что по мере увеличения числа оборотов электрода тормозящий эффект ингибитора ослабевает и в пределе при «=5000 об/мин он полностью исчезает. Это указывает на то, что производные низкомолекулярных аминов не удаляют деполяризатор (Ог) из электролита, а действуют благодаря образованию на поверхности металла полимолекулярных слоев, затрудняющих диффузию кислорода к электроду. Ингибиторы типа ИФХАН имеют преимущества перед чисто катодными ингибиторами, поскольку они сильно замедляют и анодную реакцию, благодаря чему обеспечивают более надежную защиту.
Относительно механизма торможения анодной реакции можно сказать следующее. Как показали масс-спектрометрические исследования, ингибиторы типа ИФХАН содержат два активных гетероатома N и О (в масс-спектре исследованных соединений было обнаружено два пика, один из которых связан с локализацией заряда на атоме азота, а другой — на атоме кислорода). Эти гетероатомы образуют донорно-акцепторную связь с металлом.
Адсорбция этих соединений изменяет энергетическое состояние атомов металла на поверхности, о чем свидетельствует уменьшение работы выхода электрона. Увеличение контактной разности потенциалов более чем на 0,3 В указывает на возникновение прочной связи, в которой ингибитор является донором, а металл — акцептором (подробно см. ниже).
И, наконец, остается рассмотреть последний, т. е. пятый, путь уменьшения реакционной способности металлов посредством снижения окислительно-восстановительного потенциала системы. Следует сразу же оговориться, что хотя этот путь и приводит к падению скорости катодной реакции, он отличен от рассмотренного до этого случая торможения катодной реакции. В предыдущем случае скорость катодной реакции, как было показано, замедляется благодаря созданию на поверхности металла пленок, представляющих диффузионный барьер для кислорода или другого деполяризатора. Уменьшение же окислительно-восстановительного потенциала системы связано, как правило, с уменьшением концентрации деполяризатора. На этом принципе, в частности, основаны методы борьбы с коррозией энергетических установок, заключающиеся в химических или термических способах удаления из воды кислорода. Уменьшая окислительный потенциал системы, смещают потенциал металла к значению равновесного потенциала реакции в данной среде, при котором скорости прямой (ионизации металла) и обратной (осаждения металла) реакций практически равны, т. е. К условиям, когда коррозии ПО существу нет (фах на рис. 1,1). Технология осуществления подобной защиты изложена ниже (см. стр. 251).
 21 августа, 2015
21 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 