Кроме ингибиторов окислительного типа защитить металлы от коррозии могут и такие соединения, как NaOH, Na3PC>4, Na2HPC>4, Na2C03, NaB03, Na2B407, не являющиеся окислителями. При гид-
ролизе этих соединений, представляющих собой соли слабой кислоты и сильного основания, возникают ионы гидроксила, способствующие образованию пассивирующего окисла. Применяя их, можно полностью приостановить коррозию железа и его сплавов. Это наглядно иллюстрируется кривыми, представленными на рис. 2,12. Добавление к сульфату натрия (0,1 н.
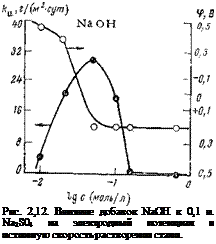 Na2S04) небольших концентраций щелочи сильно сдвигает потенциал в положительную сторону. При отношении [Na2S04] : [NaOH] =
Na2S04) небольших концентраций щелочи сильно сдвигает потенциал в положительную сторону. При отношении [Na2S04] : [NaOH] =
= 1 разница в потенциалах стали в электролите без ингибитора и с ним достигает 0,7 В. Все это указывает на сильные пассивирующие свойства гидроксильных ионов. Начиная с определенной концентрации щелочи, потенциал стали перестает меняться, несмотря на то, что концентрация щелочи в электролите увеличивается. Истинная скорость растворения стали в зависимости от концентрации щелочи меняется по следующему закону: вначале при добавлении щелочи к сульфату истинная скорость коррозии растет, достигает максимального значения, после чего начинает падать.
При достаточной концентрации ионов гидроксила в электролите становится возможным образование пассивирующего окисла за счет кислорода гидроксила по реакции Fe+20H_—2ег—>-FeO+ +Н20 без внешней анодной поляризации. Ионы водорода из гидроксила соединяются с другим гидроксилом, образуя воду, как указано ниже [1]:
|
@ |
оГн L |
он] |
|
|
@ |
оГн |
он] |
|
|
@ |
оГн L. |
ОНІ ‘ J |
Соли слабой кислоты и сильного основания имеют преимущества перед обыкновенной щелочью, поскольку ионы гидроксила, расходуемые на образование пассивирующего окисла, автомате
тически пополняются за счет гидролиза.
![]()
![]()
![]()
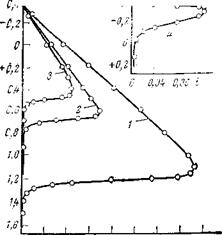 Следует иметь в виду, что действие рассматриваемых ингибиторов заключается не только в увеличении ‘концентрации гидроксил-ионов, необходимых,^/Щля образования пассивирующих слоев. Здесь проявляется гще и специфическое действие :амих анионов. На это, например, указывает зависимость потенциалов пассивации и тонов пассивации от природы аниона, а также то, что защитные концентрации ингибиторов при одинаковом значении pH различны. Изменение состава защитных пленок также свидетельствует о специфическом Рис. 2,13. Влияние концентрации водород-влиянии самих анионов. Майн иых ионов (pH) на анодную пассивациюи Ментор Г421 в частности
Следует иметь в виду, что действие рассматриваемых ингибиторов заключается не только в увеличении ‘концентрации гидроксил-ионов, необходимых,^/Щля образования пассивирующих слоев. Здесь проявляется гще и специфическое действие :амих анионов. На это, например, указывает зависимость потенциалов пассивации и тонов пассивации от природы аниона, а также то, что защитные концентрации ингибиторов при одинаковом значении pH различны. Изменение состава защитных пленок также свидетельствует о специфическом Рис. 2,13. Влияние концентрации водород-влиянии самих анионов. Майн иых ионов (pH) на анодную пассивациюи Ментор Г421 в частности
С! Г о! о4;ін5у(іиЙ + 0М S:04CH3c6oh tпоказали, что окисная пленка,’ + NaOH: возникающая на железе в 0,1 н.
/-рН = 2; 2-рН = 4,2; 3-рН = 5,2; 4 — рН = 7. Na2HP04, состоит из y-Fe203
с внедренньши в -нее частицами FeP04-2H20.
Специфическое влияние анионов может найти отражение в способности к адсорбции или образованию труднорастворимых соединений. Высокая коррозионная стойкость железа в фосфатах, серебра в хлоридах, свинца в сульфатах и магния во фторидах, несомненно, обусловлена образованием труднорастворимых солей и иллюстрирует специфическое влияние анионов.
Для того чтобы изучить непосредственное влияние гидроксильных ионов без изменения концентрации анионов электролита, брали фосфатно-боратный буфер и изменяли pH с помощью NaOH. На рис. 2,13 представлены потенциодинамические анодные поляризационные кривые (К=40 мВ/мин), полученные Даниловым и Оранской в буферном электролите с различными значениями pH. Поскольку в этом буфере (0,04 н. Н3Р04+0,04 н. Н3В03-|-0,04 н. СН3СООН+ +NaOH) pH электролита изменяется лишь за счет концентрации гидроксильных ионов, ход поляризационных кривых отображает влияние pH. Как видно, по мере увеличения pH потенциал пассивации смещается в отрицательную сторону, а ток пассивации падает. Наблюдается линейная зависимость потенциала пассивации от pH (рис. 2,14).
Наклон прямых зависит от наличия в электролите активирующих или пассивирующих ионов. Сульфаты затрудняют пассива
цию, смещая потенциал пассивации к более положительным значениям. Нитрит-ионы, наоборот, облегчают пассивацию, смещая потенциал пассивации к отрицательным значениям. Прямолинейная зависимость потенциала пассивации от pH, наблюдающаяся и в присутствии нитрита натрия, свидетельствует, однако, о том, что пассивация остается по своей природе окисной; ее вызывают ионы гидроксила или кислород воды, а ингибитор лишь облегчает этот процесс.
![]()
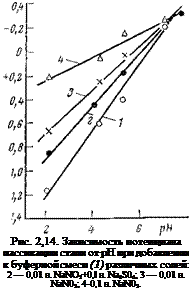 Нитрит-ион оказывает сильное влияние на потенциал пассивации лишь в кислых и слабокислых электролитах; по мере приближения к нейтральным (pH ~8) потенциал пассивации во всех электролитах один и тот же. Это также свидетельствует в пользу того, что пассивация во всех рассмотренных нами электролитах является по своей природе окисной. Адсорбция ионов ОН — по мере увеличения pH возрастает, а других анионов — падает.
Нитрит-ион оказывает сильное влияние на потенциал пассивации лишь в кислых и слабокислых электролитах; по мере приближения к нейтральным (pH ~8) потенциал пассивации во всех электролитах один и тот же. Это также свидетельствует в пользу того, что пассивация во всех рассмотренных нами электролитах является по своей природе окисной. Адсорбция ионов ОН — по мере увеличения pH возрастает, а других анионов — падает.
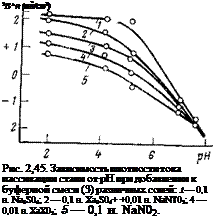 Смещение сульфат-ионами потенциала пассивации к отрицательным значениям объясняется тем, что они затрудняют адсорбцию на поверхности стали нитрит — и гидроксил-ионов и тем самым пассивацию стали. Сульфатионы облегчают также анодное растворение :в области активного растворения благодаря непосредственному участию в элементарном акте растворения.
Смещение сульфат-ионами потенциала пассивации к отрицательным значениям объясняется тем, что они затрудняют адсорбцию на поверхности стали нитрит — и гидроксил-ионов и тем самым пассивацию стали. Сульфатионы облегчают также анодное растворение :в области активного растворения благодаря непосредственному участию в элементарном акте растворения.
На это указывают значения поляризуемости электрода dtp/ді в сульфатных и фосфатборат — ных электролитах при одинаковом значении pH (~5,2), равные соответственно 100 и 14 мВ/мА.
Интересно проследить за изменением тока пассивации (рис. 2,15). Для всех изученных электролитов обнаруживаются две области pH, в которых из
менение pH по-разному влияет на ток пассивации: до рН = = 4-^5 наблюдается слабое изменение тока пассивации, а после этого значения изменение pH начинает сильно влиять на ток пассивации. При pH «5 токи пассивации выравниваются, что свидетельствует о преобладающем влиянии на пассивацию ионов гидроксила или воды. Перелом на кривых совпадает с теми значениями pH, при которых обычно наблюдается для стали резкое изменение скорости коррозии. При наличии сульфата в растворе токи пассивации слабо меняются с изменением pH, что, как уже указывалось, связано с вытеснением с поверхности ионов гидроксила.
Механизм растворения железа в слабокислых сульфатных растворах (pH=4,0-^5,3) изучался также авторами работы [43]. Авторы на основании кинетических данных о реакции анодного
|
растворения предполагают следующие реакции: Fe + НаО (FeOH)aAC + Н+ + е — (2,10) (FeOH)aAC 5=s FeOH+ + <Г (2,11) FeOH+ + Н+ ч=* Feg+ + НаО (2,12) (FeOH)aAC + Н,0 ч==*= [Fe(OH)2]aflc + Н+ + е~ (2,13) [Ре(ОН)2]адс + Н+ FeOH+ + Н20 (2,14) а в присутствии анионов [Fe(OH)2]aAC + 2А — ч=± FeA2 + 20Н" (2,15) FeA2 + пН20 Fe*+ + 2А — (2,16) |
Возможность параллельного течения реакций (2,11) и (2,12) зависит от степени покрытия 0 электрода комплексом (FeOH)aAc, которая растет с увеличением pH и анодного перенапряжения. При низких значениях pH и малых анодных перенапряжениях реализуется обычный последовательный механизм, описываемый реакциями (2,10) — (2,12). При pH>5,5 степень покрытия электрода комплексом (ТеОН)адс сильно возрастает. При высоких значениях pH и (или) более высоком анодном перенапряжении увеличивается и скорость образования промежуточного комплекса по уравнению (2,13). Этот промежуточный комплекс, по мнению авторов, может препятствовать течению реакции (2,11), создавая пограничный слой. По мере возрастания степени покрытия электрода комплексом [Fe (ОН) г] аде растворение комплекса (РеОН)адс
практически прекращается. При наличии агрессивных анионов промежуточный комплекс [Fe (ОН) 2] аде, согласно (2,15) и (2,16), разрушается.
Влияние pH и состава электролита на пассивацию железа и стали подробно изучено многими исследователями [33, 44, 45]. В большинстве работ было установлено, что потенциал пассивации линейно изменяется с pH. Однако в работе [45] было показано, что если в нитратных, ацетатных и боратных растворах потенциал пассивации сильно снижается с ростом pH, то в сульфат
ных и перхлоратіньїх растворах потенциал пассиваций не зависит от pH и определяется природой и концентрацией аниона.
![]()
 Зависимость потенциала пассивации от активности солей а укладывается на прямую, описываемую уравнением: фп =
Зависимость потенциала пассивации от активности солей а укладывается на прямую, описываемую уравнением: фп =
= 0,51—0,03 lg а.
В связи с этим авторы предполагают два различных тип а п ассив а ции; п ассив ация первого типа, зависящая от pH, связана с образованием фазового окисла или кислородного слоя, возникающего в результате взаимодействия железа с водой. Этот вид пассивации затрудняют прочно адсорбированные ионы. Пассивация же второго типа, не зависящая от pH, связана с непосредственным участием анионов в процессе формирования пассивирующего слоя. При этом допускается, что анионы SOI — и СЮ могут ускорять реакцию образования пассивирующего слоя посредством, например, передачи кислорода от молекулы воды к металлу. Этот механизм не совсем ясен.
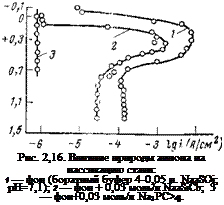
Для того чтобы выявить специфическое влияние анионов, входящих в состав ингибиторов, защищающих металл благодаря образованию труднорастворимых соединений, изучали в их присутствии анодное поведение стали в буферном электролите при постоянном значении pH. Таким образом исключалось возможное влияние pH при введении этих щелочных ингибиторов в коррозионную среду (рис. 2,16). Как нетрудно заметить, при одинаковом значении pH и одинаковой мольной концентрации фосфата и силиката их влияние на анодное растворение стали различно; фосфат переводит сталь в пассивное состояние, а в присутствии силиката сталь остается в широкой области потенциалов в активном состоянии. Эти результаты иллюстрируют специфическое влияние анионов и указывают на то, что действие ингибиторов щелочного характера обусловлено не только изменением pH.
 21 августа, 2015
21 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 