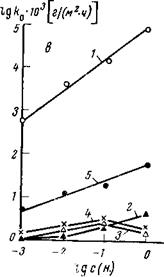
Коррозионное поведение металлов, а следовательно, и процессы ингибирования сильно зависят от анионного состава электролита. В этом можно убедиться, если рассмотреть данные о зависимости скорости коррозии стали, алюминия и свинца от природы и концентрации анионов, полученные автором книги совместно с Лысой и Луневым. Для стали (рис. 1,8 а) агрессивными анионами являются хлорид, нитрат и сульфат. В пределах изученных концентраций (до 1 н.) для хлорида наблюдается непрерывное увеличение скорости коррозии с ростом концентрации соли. Для нитрата и сульфата коррозия растет лишь до определенной концентрации, после чего начинает падать. Обычно это связывают с падением концентрации кислорода в электролите. Пассивирующие свойства по отношению к стали проявляют карбонат и бикарбонат натрия.
Для свинца картина несколько иная (рис. 1,8 6): карбонат
натрия непрерывно увеличивает с ростом концентрации скорость коррозии, нитрат натрия и хлористый натрий — лишь до определенных концентраций, после чего скорость коррозии начинает уменьшаться. По отношению к свинцу пассивирующие свойства проявляют сульфат и бикарбонат, а по отношению к алюминию — сульфат и нитрат (рис. 1,8в). В карбонате и хлориде наблюдается непрерывное увеличение скорости коррозии с концентрацией соли. В разбавленных растворах бикарбоната натрия скорость коррозии
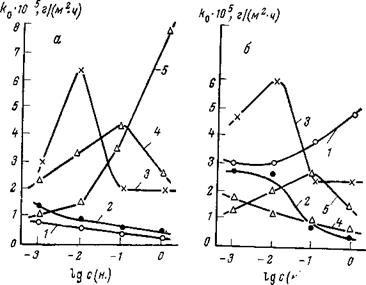 |
Рис. 1,8. Зависимость скорости общей
коррозии стали (а), свинца (б) и алю-
миния (в) от концентрации (нормаль-
ности) натриевых солей:
1 — Na2C03; 2 — NaHC03; 3- NaN03;
4 — Na2S04; 5 — NaCl.
алюминия ниже, чем в аналогичных по концентрации растворах сульфата и нитрата. Лишь при больших концентрациях бикарбоната (1 н.) скорость коррозии алюминия выше, чем в нитрате и сульфате, однако она примерно на шесть порядков ниже, чем в карбонате. Агрессивные свойства по отношению ко всем трем изученным металлам обнаруживает в той или иной степени и хлорид.
Как видно, влияние различных анионов специфично по отношению к каждому металлу, что надо учитывать при подборе ингибиторов. Пассивирующие свойства некоторых анионов, содержащихся в природных водах, как будет ниже показано, можно использовать для защиты.
На ранних стадиях развития науки о коррозии предполагали, что активирующее действие агрессивных ионов, и в частности ионов хлора, связано с разрушением окисных пленок. Однако оказалось, что механизм действия этих ионов является более сложным. Активирующее влияние агрессивных ионов можно наблюдать и в тех случаях, когда поверхность металла освобождена практически от фазовой пленки. Наиболее вероятным является непосредственное участие анионов в элементарном акте ионизации металла. Эта идея развивается в работах Колотыркина с сотр. [5].
Интересные результаты в этом плане были за последнее время получены Лосевым с сотр. [35]. При исследовании анодного растворения амальгамы индия было установлено, что скорость процесса пропорциональна концентрации аниона в степени т (для I — т = 1, для Вг~ т=2 и для С1_ т=3). В ранних работах Эршлера также указывалось, что скорость растворения платины пропорциональна концентрации ионов хлора в электролите. Все это навело на мысль, что анодному растворению металла в растворе должна предшествовать предварительная адсорбция аниона, т. е. процесс не сводится к переходу в раствор простых ионов металла.
Согласно современным представлениям, компоненты агрессивной среды принимают непосредственное участие в элементарных актах растворения металлов, образуя промежуточные комплексы металла с анионами:
Мпе~ + т/Г МА^-п)~ + пе~ (1,28)
Такой промежуточный комплекс облегчает переход ион-атомов металла из решетки в раствор вследствие ослабления их связи между собой.
Следует также иметь в виду, что активирующее действие анионов сильно зависит от потенциала, и подобно тому как ионы гидроксила при отрицательных потенциалах облегчают растворение железа, а при положительных пассивируют его, анионы, в частности сульфат — и хлорид-ионы, могут при определенных потенциалах выступать в качестве ингибиторов. Подобные явления, как и эффект синергизма, также связанный с двойственной ролью анионов, будут рассмотрены ниже.
 19 августа, 2015
19 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 