§ 1. АНОДНАЯ ПАССИВАЦИЯ
Защита металлов от коррозии в нейтральных электролитах может быть осуществлена как ингибиторами, так и пассиваторами. При этом под ингибиторами следует понимать любое соединение, которое подавляет коррозию, вне зависимости от того, на какую электрохимическую реакцию оно влияет. К пассиваторам будем относить лишь те соединения, которые уменьшают скорость коррозии благодаря преимущественному торможению анодной реакции. В согласии с этими определениями ингибитор может и не являться пассиватором, но любой пассиватор будет ингибитором.
Когда ингибирование коррозионных сред осуществляется с помощью соединений, изменяющих преимущественно кинетику анодной реакции, а этот механизм является в нейтральных электролитах наиболее эффективным, то ингибирование тесно связано с пассивацией. Оба эти процесса зависят от природы пассивирующих слоев, возникающих на поверхности металла, а также характера и кинетики катодного процесса, обеспечивающего перевод металла в пассивное состояние.
Рассмотрим сначала основные закономерности анодного растворения в неингибированных электролитах, чтобы потом проследить за изменениями, которые вносят в этот процесс ингибиторы.
На рис. 1,1 представлена схематично анодная потенциостатиче — ская кривая, характеризующая зависимость скорости анодного растворения (плотности тока га) металлов от потенциала <р. На ней имеются следующие обозначения: ф°а — равновесный потенциал анодной реакции в данном электролите; фСт — стационарный потенциал металла в данной среде (потенциал коррозии); фп — потенциал пассивации; фп. п — потенциал полной пассивации; фпит — потенциал питтингообразования; фщюб — потенциал пробоя; фпер — потенциал перепассивации; іп — плотность тока пассивации; t’n. n — плотность тока полной пассивации.
Имеется достаточно оснований считать, что к процессу анодного растворения металлов применима теория замедленного разряда. Поэтому, если принять, что лимитирующей стадией в процессе растворения является ионизация металла, то скорость анодного про-
цесса ia должна находиться в экспоненциальной зависимости от потенциала:
ia = k exp (an^F/RT) (1,3)
где k — константа скорости анодной реакции; а—коэффициент переноса; фа — потенциал анода; п—число электронов, освобождающихся при переходе ион-атом а металла в раствор; R, Т, F — обычно принятые обозначения.
Из этого уравнения следует, что по мере смещения потенциала в сторону положительных значений скорость растворения должна расти.
Если прологарифмировать это уравнение и подставить значение равновесного потенциала для анодного процесса, то можно получить довольно простое выражение для перенапряжения анодного процесса (г)а):
rja = a + b 1п/а (1,4)
где а и b — константы; І& —плотность анодного тока.
Как видно, зависимость скорости анодного растворения от потенциала описывается обычной тафелевской прямой. Действительно, если отложить экспериментальные результаты, полученные при анодном растворении металлов, например железа, в полулогарифмических координатах, то получим требуемую теорией прямую с тем или иным наклоном. Однако вблизи потенциала пассивации фп анодное растворение перестает подчиняться тафелевской зависимости: скорость реакции начинает резко падать, достигая нич-
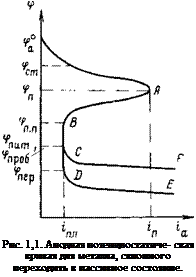 тожно малых значении при потенциале полной пассивации (фп. п)- При этом потенциале металл становится полностью пассивным, т. е. переходит в состояние, которое, по Томашову [2, с. 13], определяется как состояние повышенной коррозионной устойчивости металла, вызванное торможением анодного процесса.
тожно малых значении при потенциале полной пассивации (фп. п)- При этом потенциале металл становится полностью пассивным, т. е. переходит в состояние, которое, по Томашову [2, с. 13], определяется как состояние повышенной коррозионной устойчивости металла, вызванное торможением анодного процесса.
Аномальное поведение железного электрода по сравнению с тем, которое можно было ожидать исходя из уравнения (1,4), в принципе может быть обусловлено прямым или косвенным влиянием концентрационной поляризации или изменениями химических свойств поверхности, затрудняющими переход катионов в раствор на границе металл—электролит.
Ю
Расчет концентрационной поляризации для катодного процесса разряда ионов и анодного процесса ионизации тех же ионов приводит к двум уравнениям:
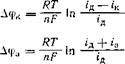 (1.5)
(1.5)
(1.6)
Сравнив их, легко заметить, что одна и та же плотность тока вызывает гораздо более сильную катодную поляризацию, нежели анодную. В самом деле, когда плотность катодного тока ік приближается к предельной плотности диффузионного тока /д, потенциал катода сдвигается сильно в отрицательную сторону, стремясь в пределе к минус бесконечности при ік=і’д. Потенциал же анода при га == г"д изменяется всегда на величину, равную (RTjnF)n 2. Отсюда следует, что сама по себе концентрационная поляризация (о косвенном ее влиянии см. ниже) не может привести к существенным изменениям потенциала электрода и, стало быть, не может обусловить аномальное поведение электрода. Поэтому резкое изменение скорости анодного растворения после достижения определенного потенциала связывают с накоплением на поверхности электрода адсорбированного кислорода или химически связанных с металлом кислородных соединений.
Следует, однако, иметь в виду, что изменение концентрации продуктов анодной реакции в растворе может косвенно оказывать влияние на пассивирование электрода. Поскольку растворимость солей ограничена, чрезмерное накопление ионов металла в при — электродном слое приводит к выделению солей на электроде, экранированию значительной части поверхности и резкому возрастанию тока на свободной части поверхности. Благодаря этому пассивирование облегчается. Такой вид пассивности называют солевой.
Термодинамический расчет показывает, что железо должно относительно легко окисляться электрохимически ионами гидроксила или кислородом воды
![]() Fe + 20Н" r^= FeO + Н20 + 2е~
Fe + 20Н" r^= FeO + Н20 + 2е~
A F° = AFPсо + AFh2o — 2AF0h — AFa = -244 112 + (—236 964) + 2 (157 147) = —166 782 Дж
откуда
Фрн-М. б** п-96485 2-96 485 — 0,8658
С учетом зависимости этой реакции от pH для нейтральных электролитов получаем
<РрН=7 = Ф°рн.14,5 + °-059 <14-5 — 7-°> = -0,422В
И
Возможно образование окислов другого состава, при этом будут следующие значения потенциалов:
![]() 3Fe + 80Н" Fe304 + 4Н20 + 8е“
3Fe + 80Н" Fe304 + 4Н20 + 8е“
ФрН-7—— 0,473В
2Fe + 60Н“ Fe203 + ЗН20 + 6<Г
ФрН=7 = —0,431В
При окислении железа кислородом воды
Fe + H20 <—>- FeO + 2Н+ + 2е~
AF° = AFFeo — AFh2o = -244 112 + 236 964 = —7148 Дж
С учетом зависимости этой реакции от pH для нейтрального электролита имеем
Ф°н=7 = ф°н=0 + 0,059 (0 — 7) = —0,037—0,059.7 = —0,450В
При образовании окисла Fe304 за счет реакции окисления водой 3Fe + 4Н20 <—* Fe304 + 8Н+ + 8е~ (1,12)
ФрН-7 = —0,421В
а для окисла Fe203 также с учетом pH
![]() 2Fe + ЗН20 <—>- Fe2Os + 6Н+ + 6е~
2Fe + ЗН20 <—>- Fe2Os + 6Н+ + 6е~
ФрН=7 — —0,463В
Как видно, потенциалы образования окислов железа довольно близки и имеют отрицательные значения. Будут ли эти окислы образовываться на поверхности металла или нет, зависит, естественно, от значения потенциала, устанавливающегося на поверхности электрода: если оно более положительно, чем значение потенциала образования окислов, на электроде будет протекать реакция окисления, если оно более отрицательно — реакция восстановления окислов (с учетом, конечно, некоторого перенапряжения) .
Сравнение значений стационарных потенциалов железа (потенциалов коррозии) в нейтральных электролитах (—0,3-1—0,4 В) со значениями потенциалов образования окислов железа приводит к выводу, что уже при незначительном смещении потенциала железа или стали в положительную сторону от стационарного параллельно процессу ионизации металла на электроде должна протекать реакция окисления, приводящая к возникновению на поверхности окисных слоев. Эта реакция, поскольку она является электрохимической, должна при анодной поляризации, так же как и
реакция ионизации металла, ускоряться. Поэтому по мере смещения потенциала в положительную сторону степень покрытия электрода кислородом все больше и больше увеличивается. При достижении определенного потенциала фп электрод оказывается почти полностью покрытым окисным слоем. Миграция (диффузия) катионов из металлической решетки в раствор через такой окисный слой затрудняется, и скорость анодного процесса начинает падать. Этот потенциал в отечественной литературе называется потенциалом пассивации. Иногда его называют Фладе-потенциалом по имени ученого, впервые наблюдавшего это явление.
Начиная с некоторого потенциала фд. п, получившего название потенциала полной пассивации, скорость анодного процесса достигает ничтожно малых величин и практически перестает зависеть от потенциала.
По мнению Хора [3, с. 284], в этой области потенциалов меняется характер анодного процесса; реакция ионизации металла прекращается и ток расходуется лишь на анодное образование пассивирующего окисла. Ионы металла попадают в раствор лишь за счет обычной химической реакции растворения окисла, которая, естественно, не должна зависеть от потенциала. Однако Новаков — ский и Лихачев [4], изучавшие процесс анодного растворения пассивного железа методом радиоактивных индикаторов (59Fe), показали, что в области пассивного состояния скорость перехода катионов в раствор чувствительна к изменению потенциала и что значительная часть внешнего анодного тока при переходе из одного стационарного состояния в другое приходится на скорость растворения железа.
Если допустить, что на электроде в пассивном состоянии продолжают параллельно протекать две электрохимические реакции, а именно анодное растворение металла через окисную пленку и электрохимическое окисление электрода кислородом, то независимость или слабую зависимость скорости анодного процесса от потенциала можно объяснить следующим образом. По мере смещения потенциала в положительную сторону увеличивается напряженность электрического поля в окисле, что должно увеличить скорость движения катионов через пленку (анодный ток). Однако одновременно ускоряется и реакция электрохимического окисления металла кислорода, а значит, и толщина пленки. Это затрудняет выход катионов металла из решетки в раствор. В результате этих двух противоположно действующих факторов анодный ток остается постоянным или слабо меняется с изменением потенциала.
Возможность реализации рассмотренного механизма пассивации железа за счет кислородных соединений становится еще более вероятной, если принять механизм анодного растворения, предложенный Колотыркиным, Кабановым, Бонгоффером, Бокрисом, Лоренцем, Хойслером [5—10] и заключающийся в непосредственном участии компонентов агрессивной среды в элементарных актах анодного растворения металлов.
По мнению этих исследователей, первой стадией растворения железа является равновесная адсорбция на нем ионов ОН-, которая описывается следующими уравнениями:
Fe + ОН" <=>: Fe(OH)aAC + е“ (1,14)
Fe + Н20 =5=* Fe(OH)aflc + Н+ + е — (1,15)
нентов раствора и металла:
Fe(OH)aAC —— ► FeOH+ + е~ (1,16)
Fe(OH)aflc + ОН” ——- ► (FeO)a«c + Н20 + е~ (1,17)
Fe(OH)MC + Fe Fe(FeOH)№ (1,18)
Fe(FeOH)aflc + OH" ——- »- FeOH+ + Ре(ОН)адс + 2e~ (1,19)
Перейдет ли адсорбированный кислородный комплекс в раствор или останется на поверхности металла, будет зависеть от потенциала электрода; при смещении потенциала в положительную сторону увеличивается вероятность перехода комплекса в кислородное соединение, остающееся на поверхности и обладающее высокими защитными свойствами.
Таким образом, идея о конкуренции процессов растворения металла с возникновением и разрушением пассивирующего окисла позволяет с единых позиций объяснить и активное растворение, и пассивацию металла [5].
При наличии в электролите активирующих агентов, например хлорид-ионов, при определенном значении потенциала српит пассивное состояние нарушается, процесс анодного растворения ускоряется. Объясняется это тем, что по мере смещения потенциала в положительную сторону усиливается адсорбция хлорид-ионов. Поскольку степень покрытия поверхности кислородом неодинакова, в местах, где имеются дефекты в структуре окисной пленки, начинают преимущественно адсорбироваться хлорид-ионы, и вместо пассивирующего окисла образуется галогенид, обладающий хорошей растворимостью. Начинается питтинговая коррозия. Этому виду коррозии особенно подвержены нержавеющие стали и другие пассивирующиеся сплавы: алюминий, титан, цирконий.
Как показали наши исследования [11], питтинговая коррозия может быть подавлена с помощью анионов, способных предотвращать адсорбцию галогенид-ионов или вытеснять их с поверхности металла. Для этого необходимо, чтобы в растворе было определенное соотношение пассивирующего П и активирующего иона А. Для стали 1Х18Н10Т в 0,1 н. NaCl получены следующие отношения а=П/А:
![]() sol — сю!- no; СЮ4 сю;
sol — сю!- no; СЮ4 сю;
10 7 0,4 2 0,5
Если расположить исследованные анионы в порядке возрастания их эффективности, то получится следующий ряд:
Шз > СЮз > СЮГ > СгО|- > sot
Как видно, эффективность не связана с окислительной способностью анионов и, следовательно, о «залечивании» анионами дефектов в окисной пленке, как это ранее предполагали, речи быть не может. Против этого механизма говорит и сложная зависимость a=[SOr ]/[С1“] от pH:
pH………………….. 2 7 12
а…………………….. 2 10 2
Оказалось, что в кислых электролитах, в которых устойчивость фазовых пленок низка, требуется гораздо меньше сульфат-ионов, чтобы предотвратить коррозию стали, чем в нейтральных, в которых фазовые пленки более устойчивы. В щелочных средах значение а оказалось таким же, как в кислых. Напрашивается вывод, что здесь определенную роль играет конкурирующая адсорбция ионов. Удалось получить непосредственные экспериментальные доказательства в пользу адсорбционной природы активирующего и пассивирующего действия анионов.
Изучая изменение радиоактивности раствора, содержащего изотоп 36С1, удалось определить количество ионов С1“, адсорбирующихся на поверхности металла. Из рис. 1,2 видно, насколько сильно уменьшается количество адсорбированного С1” при введении в электролит ИОНОВ SO4" и ОН~ При более высоких концентрациях пассивирующих ионов можно полностью исключить адсорбцию активирующихионов. Это наглядно можно иллюстрировать кривыми анодного заряжения.
Осциллографическая запись анодных кривых заряжения показывает, что в чистом растворе хлорида электрод находится в активно-пассивном состоянии (рис. 1,3); наблюдающиеся осцилляции потенциала связаны с тем, что на электроде протекают два конкурирующих процесса — активация и пассивация. Если в электролит добавить нитрат — или сульфатионы, потенциал электрода стабилизируется, осцилляции прекращаются. Такой электрод можно заполяризовать без активации до высоких положительных потен-
![]() 1 — фон; 2 — 0,01 н. Na2S04; 3 — 0,002 н.
1 — фон; 2 — 0,01 н. Na2S04; 3 — 0,002 н.
NaOH; 4- 0,1 н. Na2S04.
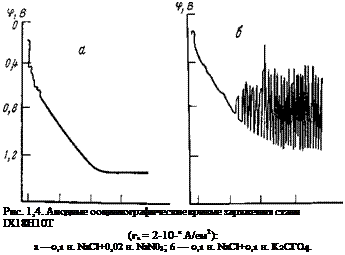
Адсорбционная природа пассивирующего действия анионов доказывается также тем, что эффективность ингибиторов определяется значением потенциала (рис. 1,4). Ион NO3 вытесняет С1_ в широкой области потенциалов; слабые осцилляции потенциала наблюдаются лишь вблизи потенциала питтингообразования. Ион СгОГ, наоборот, вытесняет С1~ с поверхности металла и пассивирует сталь при малых положительных потенциалах. При более положительных значениях потенциала адсорбция С1_ усиливается в большей степени, чем адсорбция СгО|’, и между ними начинается конкуренция: электрод переходит в нестабильное состояние и начинается периодическая активация и пассивация его. Пассивирование ингибиторами нержавеющих сталей облегчается по мере увеличения концентрации хрома в сплавах, поскольку этот элемент легко пассивируется кислородом.
Таким образом, конкурирующая адсорбция, обусловливающая пассивное состояние металла, ’ зависит от отношения количеств активирующих и пассивирующих ионов, их заряда, потенциала электрода и состава сплава.
В некоторых случаях нарушение пассивного состояния металла, сопровождающееся увеличением скорости анодной реакции, может наступить и в отсутствие галогенид-ионов, в результате «пробоя» окисной пленки. Такие явления наблюдаются и в сульфатных электролитах. Объясняется это, очевидно, тем, что в результате неравномерного покрытия поверхности металла кислородом в от-
|
Рис. 1,3. Анодные осциллографические кривые заряжения стали IX18H10T (i’a = 2- 10~в А/см2): 1 — 0,1 н. NaCl; 2 — 0,1 н. NaCl+0,04 н. NaN03. |
о го ko во t, мин о го ьо во і, шн
 |
дельных точках, где пленка очень тонка, напряженность электрического ПОЛЯ при определенном потенциале фпроб становится чрезмерно большой и в этих местах начинается усиленное растворение металла.
Для железа, хрома, а также нержавеющих сталей возможна и другая причина усиленного растворения, за счет так называемого явления перепассивации [12]. Обусловлено оно тем, что вместо труднорастворимых окислов низшей валентности, возникающих при более отрицательных потенциалах (РегОз, СггОз) и обладающих пассивирующими свойствами, при достижении определенного положительного значения потенциала начинают образовываться легкорастворимые окислы (Сг024 , FeO Г), не обладающие защитными свойствами; это и приводит к нарушению пассивного состояния. Потенциал, при котором это явление наблюдается, называется потенциалом перепассивации фпер.
На потенциостатической анодной поляризационной кривой (см. рис. 1,1) имеется, таким образом, несколько потенциалов, характеризующих состояние электрода, природу анодного процесса и его скорость.
 18 августа, 2015
18 августа, 2015  admin
admin 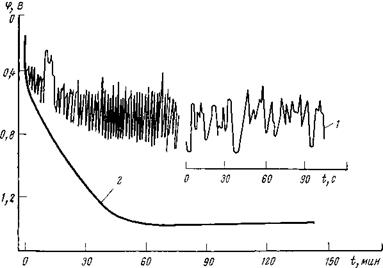
 Опубликовано в рубрике
Опубликовано в рубрике 