Взаимодействие полимеров с растворителем имеет большое значение при переработке полимеров, их применении, в биологических процессах и др. Например, белки и полисахариды в живых организмах и растениях находятся в набухшем состоянии. Многие синтетические волокна и пленки получают из растворов полимеров. Растворами полимеров являются лаки и клеи. Определение свойств макромолекул, в том числе молекулярных масс, проводят, как правило, в растворах. Пластификация полимеров, осуществляемая в производстве изделий, основана на набухании полимеров в растворителях — пластификаторах. Вместе с тем для практического применения полимеров^ важным свойством является устойчивость их в растворителях. Для решения вопросов о возможном набухании, растворении: полимера в данном растворителе или об его устойчивости по — отношению к этим процессам необходимо знать закономерности взаимодействия полимеров с растворителями.
Взаимодействие полимеров с растворителями обычно начинается с набухания. Процесс набухания состоит в поглощении растворителя веществом, объем и масса которого при этом Увеличиваются. Набухание наиболее характерно ДЛЯ высокомоЛекулярных соединений. В результате набухания их объем и
|
P/Ps Рис. VI.9. Изотермы ограниченного (/) и неограниченного (2) набухания- Р и Ps — давление насыщенного пара растаорнтеля соответственно над набухшим полимером и над чистым растворителем Рис. VI.10. Кинетические кривые ограниченного (/) и неограниченного (2) набухания |
Масса могут увеличиваться в 10—15 раз. Неорганические материалы, обладающие жесткой структурой, мало «способны к набуханию. Они могут удерживать жидкости в порах в основном вследствие адсорбции и капиллярных явлений; при этом их структура, а следовательно, и объем не изменяются.
Масса жидкости, поглощенная единицей массы вещества прис данной температуре, называется степенью набухания:
О = (га2— гаї) /ті (VI.58);*
Где тх и тг — масса вещества до и после набухания соответствеиио.
Характеристики набухания аналогичны характеристикам сорбции. Основной из них является изотерма набухания, которая показывает зависимость степени набухания от термодинамической активности растворителя (от давления его пара) при: данной температуре. Типичные изотермы набухания представлены на рис. VI.9. Как видно, с ростом давления пара растворителя степень набухания увеличивается. Изотерма процесса набухания, переходящего в растворение (неограниченное набухание), круто поднимается вверх вплоть до активности растворителя, равной единице (P=ps)■ Степень набухания может достигать определенного предельного значения и далее с ростом давления пара растворителя не увеличиваться (ограниченное набухание). При ограниченном набухании система переходит в состояние геля (гели ВМС называют студнями).
В состоянии ограниченного набухания система состоит из двух фаз, находящихся в равновесии: насыщенный раствор растворителя в веществе (ВМС), т. е. гель, и насыщенный раствор вещества (ВМС) в растворителе, как правило, небольшой концентрации. Такое двухфазное равновесие аналогично равновесию при ограниченном растворении низкомолекулярных веществ. Неограниченное набухание характерно для линейных полимеров. Сшитые полимеры набухают в растворителях, но не растворяются. При изменении условий ограниченное набухание может перейти в неограниченное. Например, при повышении температуры такой переход наблюдается при набухании желатины и агара в воде.
Набухание — осмотический процесс, при котором происходит диффузия молекул растворителя в высокомолекулярное вещество. Такой односторонний процесс объясняется тем, что макромолекулы ВМС очень большие и разветвленные, благодаря чему они переплетены между собой и слабо подвержены действию теплового движения. В противоположность молекулам ВМС небольшие молекулы растворителя очень подвижны, они легко проникают в высокомолекулярное соединение, увеличивая его объем.
Различают межструктурное и внутриструктурное набухание. При межструктурном набухании молекулы растворителя, диффундируя в аморфный полимер, занимают свободное пространство прежде всего между элементами надмолекулярных структур. Если полимер и растворитель близки по природе, молекулы растворителя проникают также внутрь надмолекулярных образований, раздвигая сначала отдельные участки макромолекул, а затем и целиком длинные полимерные цепи (внутриструктурное набухание). Внутриструктурное набухание сопровождается значительным увеличением объема полимера. При этом расстояние между макромолекулами увеличивается, связи между ними ослабляются, и если эти связи становятся меньше осмотических сил, то макромолекулы будут диффундировать в растворитель, т. е. набухание перейдет в растворение.
Типичные кинетические кривые набухания, характеризующие зависимость степени набухания от времени при данной активности растворителя (давлении пара), представлены на рис. VI.10. При неограниченном набухании в определенный момент времени растворение приводит к уменьшению массы образца. Кинетические кривые для ограниченного набухания часто представляют аналитически в виде следующего дифференциального уравнения:
Da/dx=K tap — cst) (VI.59)
Где K — константа скорости набухания; ар и а% — степень набухания при достижении равновесия и ко времени т соответственно.
В результате интегрирования в пределах от а=0 до а=ат сполучим уравнение кинетики набухания, подобное уравнению для кинетики ленгмюровской адсорбции (III.51):
C6t=c6P(l — (VI.60)
Скорость набухания в данный момент времени определяется тангенсом угла наклона касательной к кинетической кривой набухания в соответствующей точке. Она уменьшается с ростом «степени набухания.
Важными характеристиками ограниченного набухания являются максимальная степень набухания (предельное набухание) Амакс и время ее ДОСТИЖЄНИЯ Тмакс, ОПрЄДЄЛЯЮЩИЄ СПОСОбнОСТЬ полимера поглощать низкомолекулярную жидкость при данной температуре. Чем больше молекулярная масса полимера, тем медленнее происходит процесс набухания.
Набухание всегда сопровождается возникновением давления набухания, которое Может достигать очень больших значений (десятков и даже сотен1 мегапаскалей). Давление набухания эквивалентно внешнему давлению, которое нужно приложить, чтобы остановить процесс увеличения объема набухающего вещества. Оно аналогично осмотическому давлению [см. уравнение (IV.45)]:
^ RT RT О
Nt=-TTlnai==-F7lni — — (VI-6,)
Где VM — парциальный мольный объем растворителя; а — активность растворителя; р и р, — давление насыщенного пара растворителя соответственно над набухшим полимером и чистым растворителем.
Уравнение (VI.61) позволяет по давлению пара растворителя рассчитать давление набухания. Давление набухания сильно понижается с ростом давления пара растворителя или, что то — же самое, с ростом степени набухания. С повышением концентрации набухающего вещества в геле (величины, обратной степени набухания) давление набухания увеличивается. Фрейндлих и Поздняк установили следующую эмпирическую зависимость между давлением набухания и концентрацией сухого ВМС в набухшем геле:
Я=ксп или 1п я= In fe+ra In с (VI.62)
Тде кип — константы, значение которых определяется только природой набухающего вещества и растворителя.
Указанная зависимость соблюдается довольно часто.
Давление набухания зависит от степени поперечной связанности полимера (степени сшивки), что заметно проявляется лишь при достаточно большой степени набухания. Для полностью набухших ВМС (при предельном набухании) давление набухания почти линейно зависит от степени сшивки.
Смешение полимера с низкомолекулярным растворителем (набухание и растворение)—самопроизвольный процесс и поэтому протекает с уменьшением энергии Гиббса системы (VI.23):
DG =dH — TdS < О
Отсюда следует, что процессу смешения благоприятствуют уменьшение энтальпии системы dH<0 и увеличение энтропии DS> 0.
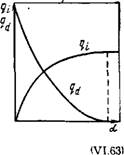
Рис. VI.11. Зависимость интегральной qt и диффе реициальной qd теплот набухания от степени на бухания
Важными термодинамическими характе ристиками набухания являются дифферен циальная работа, интегральная и диффе ренциальная теплоты набухания. Диффе ренциальная работа набухания определя ется по уравнению
Ги=ЯТ In (р,/р)
Она уменьшается с ростом степени набухания. Часто процесс набухания сопровождается выделением теплоты. Интегральная и дифференциальная теплоты набухания определяются аналогично соответствующим теплотам в сорбционных процессах. Различие состоит в том, что вместо степени заполнения поверхности при набухании используют степень набухания. Абсолютное значение интегральной теплоты набухания увеличивается с ростом степени набухания. Дифференциальную теплоту набухания получают дифференцированием интегральной теплоты по степени набухания. На рис. VI. 11 представлены зависимости интегральной и дифференциальной теплот набухания от степени набухания. Из них следует, что дифференциальная теплота (ее абсолютное значение), как и дифференциальная работа набухания, уменьшается с ростом степени набухания и становится равной нулю при предельном набухании. Следует отметить, что если дифференциальная работа набухания снижается относительно плавно вплоть до предельного набухания, то дифференциальная теплота резко уменьшается уже при малых значениях степени набухания. Характер изменения интегральной теплоты набухания аналогичен изменению теплоты адсорбции. Было установлено, что зависимость интегральной теплоты набухания от степени набухания следует эмпирическому уравнению
Qi=aa/(b+a) <VI.64)
Где а и b — константы, зависящие от природы набухающего, вещества и Растворителя.
Для дифференциальной теплоты уравнение (VI.64) переходит в следующее соотношение:
Qa=dq-i/da=ab/(b + a)2 (VI.65)
Из соотношения (VI.65) следует, что дифференциальная теплота при сзс—*-0 имеет максимальное значение, равное
А/Ь (VI.66!
|
|
В качестве примеров приведем для некоторых веществ максимальные дифференциальные теплоты набухания в воде
{в кДж/кг): желатина — 960, казеин—1150, целлюлоза— 1670, мука — 1840, глина — 1100, гумусовая почва — 2600.
Теплоты набухания по закономерностям изменения мало чем отличаются от тепловых эффектов растворения. Эта аналогия дает основание рассматривать набухание как растворение растворителя в ВМС. ї
Если при набухании объем вещества увеличивается, то общий объем системы (вещество и растворитель) уменьшается. Уменьшение объема системы при набухании вещества в растворителе называется контракцией. Зависимость контракции от степени набухания подобна аналогичной зависимости для интегральной теплоты набухания:
AV=a’a/Cb‘+a) (VI.67)
Где а’ и Ь’ — коистаиты, зависящие от природы набухающего вещества и растворителя.
Контракция объясняется взаимодействием (сольватацией) вещества с растворителем, при котором происходит уплотнение системы. В начальный момент набухания молекулы воды, проникая в ВМС, образуют первичные гидратные слои. Эту гидрат — ную воду часто называют «связанной» водой в отличие от «свободной», которая поглощается после формирования первичных гидратных слоев. В результате при малых степенях набухания наблюдается наибольшее изменение объема системы, как и теплоты набухания. Связь контракции с теплотой набухания подтверждается практически постоянным отношением:
Д17<?ї=const (VI.68)
Чтобы определить, чем обусловлено дальнейшее набухание, обратимся к объединенному уравнению первого и второго начал термодинамики, записанному в следующей форме:
TdS—dU+pdV (VI.69)
При набухании увеличивается давление, относительно которого уравнение (VI.69) принимает вид (при 7’=const):
P=T(dS/dV)r— (dU/dV)T (VI.70)
Член dU/dV характеризует процесс набухания, происходящий вследствие взаимодействия растворителя с веществом. При этом выделяется теплота (уменьшается внутренняя энергия). Именно таким взаимодействием (сольватацией) определяется первая стадия набухания; на этой стадии энтропия системы почти не изменяется.
Вторая стадия набухания протекает практически без изменения интегральной теплоты набухания (внутренняя энергия остается постоянной) и контракции системы. Эта стадия обычно отличается от первой существенно большим поглощением жидкости. Например, желатина поглощает гидратной («связанной») воды около 50% (первая стадия), а общее количество воды она может поглотить до 2000% (от сухой массы). Из уравнения (VI.70) следует, что вторая стадия набухания характеризуется энтропийным эффектом (первый член этого уравнения). Энтропия растет вследствие набухания отдельных макромолекул, ослабления связей между ними и увеличения числа их возможных конформаций.
Очевидно, энтропийной составляющей, главным образом, обусловлен и переход набухания в растворение. Дифференциальная теплота растворения хотя и бывает небольшой, нулевое значение принимает только при бесконечном разбавлении раствора. При этом снижается до нуля и дифференциальная работа растворения. Для характеристики растворов полимеров используют те же термодинамические параметры, что и для растворов низкомолекулярных веществ.
Для растворов ВМС реальная энтропия смешения-значительно превышает идеальную. Например, идеальная энтропия смешения 1 г полиизобутилена с относительной молекулярной массой 320 000 в 0,2 г изооктана равна 52,0 Дж/(моль-К); экспериментальное значение составляет 2200 Дж/(моль-К). Такое различие объясняется тем, что при растворении ВМС возрастает возможность движения в растворе звеньев (сегментов) гибких макромолекул.
Так как растворение полимеров обусловлено, главным образом, ростом энтропии, то и устойчивость этих коллоидных систем объясняется в основном энтропийным фактором. Кроме обычной рассеивающей энтропии большая роль в расталкивании макромолекул принадлежит энтропии, обусловливающей упругие свойства их статистических клубков. Клубки макромолекул в данных условиях имеют определенные размеры. При ■ столкновении макромолекул клубки деформируются. Так как при деформации макромолекулы переходят из статистически наиболее вероятного состояния в статистически менее вероятное, то их клубки отталкиваются как упругие тела. Таким образом, силы отталкивания между макромолекулами в растворах полимеров обусловлены изменением энтропии вследствие отклонения статистического распределения звеньев цепи от наиболее вероятного. Подобное энтропийное расталкивание присуще только полимерам.
Описанный процесс «расталкивания» макромолекул прояв-‘ ляется в очень разбавленных системах. При повышении концентрации цепные макромолекулы распрямляются вследствие их взаимодействия, происходит образование ассоциатов. Наименьшая концентрация, при которой молекулы полимера приходят в контакт между собой, названа Штаудингером критической концентрацией. Эта концентрация увеличивается с уменьшением молекулярной массы, ухудшением качества растворителя (образование более плотных клубков) и повышением температуры. Дальнейший рост концентрации раствора полимера приводит к образованию пространственной сетки в результате взаимного переплетения цепей макромолекул, т. е. к образованию студня.
Таким образом, из линейных полимеров студни могут получаться как в результате набухания, так и при увеличении концентрации полимера в растворителе (т. е. процесс образования студня может протекать с разных сторон).
Рассмотрим факторы, влияющие на набухание и растворение полимеров. Температура и давление влияют на эти процессы в соответствии с принципом Ле Шателье. Если набухание (растворение) сопровождается выделением теплоты, то с повышением температуры степень набухания (растворимость) уменьшается. Однако скорость набухания (растворения) растет в соответствии с увеличением скорости диффузии. Так как объем системы при набухании уменьшается, то с ростом давления степень набухания повышается.
Для хорошего набухания и растворения полимера необходима его близость по природе (или полярности) к растворителю. Если они сильно различаются по этим параметрам, то набухания и растворения не происходит. Например, неполярные полимеры алифатического ряда хорошо смешиваются с неполярными предельными углеводородами (бензином) и не взаимодействуют с сильнополярными жидкостями (вода, спирты). Полярные полимеры (целлюлоза, поливиниловый спирт) не взаимодействуют с углеводородами и хорошо набухают и растворяются в воде. Ароматический полистирол не растворяется в воде, слабо набухает в бензине, но хорошо растворяется в ароматических растворителях (толуол, ксилол, бензол и др.). Полихлоропрен хорошо взаимодействует с дихлорэтаном.
Растворимость и степень набухания в значительной степени зависят от гибкости цепи полимера. Наибольшей гибкостью обладают углеводородные цепи без полярных групп, и в неполярных жидкостях они растворяются практически неограниченно. Гибкость цепей уменьшается при введении в нее полярных групп. Полимеры с большим числом полярных групп могут хорошо набухать в полярных растворителях, но, как правило, слабо растворяются в них. Здесь значительно возрастает роль взаимодействия между полимером и растворителем, так как увеличение жесткости цепей снижает энтропийный фактор при смешении.
С увеличением кристалличности полимера взаимодействие с растворителем уменьшается, что объясняется большим межмолекулярным взаимодействием в полимере. Кристаллические полимеры не растворяются даже в жидкостях, близких по полярности.
Вследствие аддитивности дисперсионного взаимодействия с ростом молекулярной массы полимера увеличивается притяжение между цепями в молекулах и между молекулами. Увеличением затрат энергии на расталкивание макромолекул с возрастанием их молекулярной массы объясняется уменьшение способности к набуханию и растворению в одном и том же растворителе полимеров одного полимергомологического ряда. Например, целлюлоза содержит большое число гидроксильных групп, но в воде не растворяется, а только набухает вследствие очень большой молекулярной массы и жесткости цепей. Различная растворимость полимергомологов используется для разделения их на фракции.
Диссоциация функциональных групп способствует растворению, так как в результате диссоциации рост частиц в системе приводит к еще большему возрастанию энтропии, что XapaKfep— Но для растворения полиэлектролитов. У амфотерных полиэлектролитов (полиамфолитов) степень набухания и растворимость зависят от рН раствора. Наименьшее набухание и растворимость отвечают изоэлектрической точке (значение рН, при котором средний суммарный заряд макромолекул полиамфолита равен нулю). Выше и ниже этой точки степень набухания и растворимость увеличиваются; заряжение макромолекул приводит к расталкиванию одноименно заряженных частиц, что способствует набуханию полимера.
Значительное влияние на набухание полимера оказывает присутствие неорганических электролитов (нейтральных солей). Диффузия молекул растворителя и ионов электролита в набухший полимер аналогична их диффузии через полупроницаемую мембрану. Действие электролитов можно объяснить, исходя из теории мембранного равновесия Доннана (IV.58). Если уменьшение набухания полимеров— неэлектролитов — при добавлении в растворитель неорганических электролитов связано только со снижением активности растворителя («связывание» растворителя), то на набухание полиэлектролитов влияние оказывает еще и противоион (влияние одноименного «она), с повышением концентрации которого увеличивается активность полиэлектролита (его «эффективная» концентрация), происходит как бы его высаливание. Таким образом, неорганические электролиты значительно сильнее снижают степень набухания полиэлектролитов, чем полимеров — неэлектролитов.
 2 ноября, 2012
2 ноября, 2012  admin
admin 
 Опубликовано в рубрике
Опубликовано в рубрике 