Красную окись железа можно получить двумя методами: прокаливанием сернокислого железа (железного купороса) или различных железосодержащих отходов при 700—800° и прокаливанием осажденного гидрата окиси железа или осажденной закись-окиси железа при 600—700°.
Получение красной окиси железа по первому методу основано на способности железного купороса разлагаться при температурах
выше 650° на окись железа и газообразные окислы серы:
2FeS04 —> Ре203 + S02 + S03
На рис. 132 приведена температурная кривая обезвоживания и разложения железного купороса.
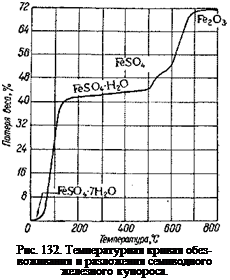 В действительности процессы, происходящие при прокаливании железного купороса, более сложны, так как при этом имеет место также окисление соли закиси железа в основную и среднюю соли окиси железа, в результате чего разложению подвергается не только’ закисная соль FeSC>4, но и окисная Fe2(S04)3-
В действительности процессы, происходящие при прокаливании железного купороса, более сложны, так как при этом имеет место также окисление соли закиси железа в основную и среднюю соли окиси железа, в результате чего разложению подвергается не только’ закисная соль FeSC>4, но и окисная Fe2(S04)3-
Образование основной соли окиси железа происходит при сравнительно низких температурах (—100°) за счет окисления моногидрата FeSChrHsO:
6FeS<V Н20 + 30 —»
—v 6Fe (S04) (ОН) + 3H20
Начиная с 425°, идет, постепенно ускоряясь, окисление безводной СОЛИ FeSC>4 в соль окиси железа:
6FeS04 + ЗО —» 2Fe2 (S04)3 + Fe203
На этот процесс при 500° накладывается реакция дегидратации основной соли:
6Fe (S04) (ОН) —►
—v 2Fe2 (S04)3 — f Fe203 + 3H20
В практических условиях температура разложения железного купороса составляет 680—700°. При более низких температурах* например 500““600°, разложение идет не до конца (примерно на 30—60%), причем получаются продукты, окрашенные в коричневокрасный цвет и содержащие значительные количества основных сернокислых солей типа Fe203 * mS03 • яН20. Эти соединения в результате гидролиза выделяют серную кислоту и поэтому сильна ухудшают антикоррозионные свойства пигмента.
По данным Качалова [67], при нагревании железного купороса до 200° его кристаллическая решетка не изменяется; при более высокой температуре в решетке происходят небольшие изменения* При 450° на рентгенограмме появляются новые линии, а при 600° образуется решетка гематита; частицы гематита очень мелки и содержат остатки основных сернокислых солей. При 700° происходит полная диссоциация железного купороса и получается красная окись железа очень хорошего и яркого цвета, но процесс разложения
протекает медленно. При повышении температуры до 800—900° скорость разложения сильно возрастает (при 900° в три раза по сравнению со скоростью разложения при 700°), цвет окиси же — леза заметно ухудшается, приобретая грязновато-синеватый оттенок.
![]()
![]()
 По данным Рискина, Нерославской и Пугачевой [68], цвет окиси железа становится менее чувствительным к действию высоких температур в присутствии небольшого количества (около 5%) окиси алюминия. Таким образом, окись железа постоянного светлого оттенка можно приготовить, добавляя к железному купоросу небольшое количество сернокислого алюминия и прокаливая смесь при 800°,
По данным Рискина, Нерославской и Пугачевой [68], цвет окиси железа становится менее чувствительным к действию высоких температур в присутствии небольшого количества (около 5%) окиси алюминия. Таким образом, окись железа постоянного светлого оттенка можно приготовить, добавляя к железному купоросу небольшое количество сернокислого алюминия и прокаливая смесь при 800°,
Иногда для получения красной окиси железа более постоянного оттенка сокращают продолжительность или понижают температуру прокаливания железного купороса. В этих условиях значительное количество железного купороса не разлагается и теряется при промывке, но образующийся пигмент обладает более светлым и чистым оттенком.
При получении красной окиси железа прокаливанием кристаллического железного купороса FeSC>4 * 7Н20 обычно получается пигмент, содержащий большое количество крупных спекшихся частиц. Наличие таких частиц объясняется растворением FeS04*7H20 при нагревании в кристаллизационной воде, которая быстро испаряется при высокой температуре, оставляя железный купорос в виде твердой спекшейся массы, Последняя и служит причиной появления в пигменте спекшихся частиц. Предупредить их образование можно предварительным обезвоживанием железного купороса, которое может происходить даже при комнатной температуре, хотя и очень медленно. Повышение температуры сильно ускоряет процесс: при 60° скорость обезвоживания становится достаточно заметной, а при 100° шесть молекул воды удаляются очень быстро. Последняя молекула удаляется с большим трудом и только при нагревании примерно до 450—550°. Практически обезвоживание железного купороса следует ограничивать получением моногидрата FeSC^-F^O, содержащего 10,6% Н20 (рис. 133).
Для получения красной окиси железа применяют также сернокислую соль окиси железа, которую получают обработкой богатых железных руд серной кислотой с последующим высушиванием и
прокаливанием [69]. Сернокислая соль окиси железа Fe2(S04b* •9НгО при 100° теряет половинное количество воды, при 180а* полностью обезвоживается, а при 780—800° разлагается:
Fe2 (S04)3 —> Pe203 + 3S03
Получение окиси железа прокаливанием осажденного гидрата окиси железа основано на способности его легко диссоциировать при повышенной температуре:
Ре203 • яН20 —> Fe203 ф* яН20
Гидрат окиси железа диссоциирует почти полностью при 300°, но образующаяся при этой температуре окись железа не обладает нужными пигментными свойствами. Она приобретает эти свойства только в результате прокаливания гидрата окиси железа при 600—700°.
-Красную окись железа удовлетворительного цвета можно получить также прокаливанием углекислого железа без перевода его в гидрат окиси железа.
Красная окись железа образуется, кроме того, при прокаливании закись-окиси железа Fe3C>4 или FeO * Fe203. Окисление закись — окиси железа в окись железа происходит при сравнительно низких температурах (275—300°) и протекает по реакции:
2 (FeO ■ Fe203) ф 0,5О2 —> 3Fe203
Однако в этом случае, так же как и при прокаливании гидрата окиси железа, пигмент хорошего цвета получается в результате прокаливания осадка только при температуре выше 500° (при 600—700°).
Черная окись железа (закись-окись) образуется в больших количествах в качестве побочного продукта при производстве анилина, поэтому применение ее для получения красной окиси железа представляет практический интерес.
По литературным данным, красную окись железа можно получить также прокаливанием смеси сухого железного купороса с содой. Для получения такой смеси железный купорос смешивают с содой в шаровых мельницах или на бегунах и полученную окись прокаливают при 600—700°. После прокаливания массу промывают для удаления водорастворимых солей, фильтруют и сушат.
Оттенок красной окиси железа зависит преимущественно от температуры прокаливания, но определенное влияние оказывает также и исходное соединение железа. Так, в результате прокаливания при одинаковой температуре железного купороса, гидрата окиси железа и закись-окиси железа получаются пигменты различного оттенка [68]. Оттенок обычных сортов красной окиси железа колеблется от желтовато-красного до синевато-красного. Для получения пигментов фиолетового оттенка необходимо вести прокаливание при температуре около 900° и добавлять к железному купоросу перед прокаливанием небольшое количество (2—4%) поваренной соли. Полученный в этих условиях пигмент обычно называют фиолетовой окисью железа. В концентрированной соляной кислоте он растворяется даже при длительном кипячении только частично; нерастворимый остаток составляет обычно около 30%,
Красная окись железа обладает очень высокой укрывистостью, доходящей до 4—5 г/ж2, но ее можно получать и в виде лессирующего пигмента, известного под названием красный марс.
Красный марс обладает глубоким бархатисто-красным цветом, невысокой укрывистостью (25—30 г/м2) и сильной лессирующей способностью в тонком слое. Его получают прокаливанием при 300—400° желтого марса, приготовленного взаимодействием хлористого железа с мелом (стр. 437). Температура прокаливания свыше 400° приводит к образованию красной окиси железа. Цвет красного марса зависит от цвета исходного желтого марса и от температуры прокаливания. Чем светлее и чище цвет желтого марса, тем ярче и чище цвет красного марса; чем ниже температура прокаливания (300—400°), тем его оттенок ближе к желтому. Красный марс может быть получен прокаливанием не только желтого марса, но и другого гидрата окиси железа, обладающего свойствами желтого марса, т. е. большой дисперсностью и сильно развитой поверхностью частиц. Кристаллическая структура окиси железа в красном марсе точно такая же, как и в красной окиси железа, т. е. гематитовая.
 29 августа, 2015
29 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 