Литопон получают взаимодействием растворов ZnS04 и BaS:
BaS + ZnS04 ■—► BaS04 ZnS + 24 икал Литопон
Так как исходные растворы, применяемые для производства литопона, содержат, кроме основных веществ, еще и продукты неизбежных побочных реакций, то при получении литопона наряду с основной реакцией протекают побочные реакции, в результате которых литопон всегда содержит некоторое количество ZnO. В растворе BaS такие примеси, вызывающие побочные реакции, появляются в результате гидролиза BaS.
Гидролиз BaS протекает в две стадии. Сначала вода присоединяется к BaS и образуется промежуточный продукт — основной сульфгидрат бария [50]
BaS + 6Н20 —* ВаХ • 5НгО хОН
а затем основной. сульфгидрат бария распадается на сульфгидрат бария и гидрат окиси бария:
$н
28а/ • 5НаО —► Ва (OH)s + Ва (SH), + 10 НйО
хОН
В результате взаимодействия этих продуктов гидролиза BaS с цинковым купоросом в литопоне образуются побочные продукты;
/SH ySH
Ва< + ZnS04 —► BaS04 + Z<
ХОН ХОН
Ва (SH), + ZnS04 —> BaS04 + Zn (SH)a
Ва (OH)2 + ZnS04 —► BaS04 — f Zn (OH)2
При последующем прокаливании литопона сульфгидрат цинка выделяет сероводород и превращается в сернистый цинк;
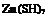 ZnS — f HsS
ZnS — f HsS
Основной сульфгидрат цинка может превратиться либо в сернистый цинк, либо в окись цинка
|
,SH Zn( — хж |
-> ZnS + H20 |
|
,SH Zn( — чон |
ZnO — f H2S |
а гидрат окиси цинка выделяет воду и превращается в окись цинка:
Zn (ОН)2 —> ZnO + HaO
Так как в концентрированных растворах сернистого бария гидролизу подвергается только небольшое количество BaS, то в осажденном литопоне обычно содержится ZnO не больше 1%. В таких концентрированных растворах BaS сульфгидрат и гидрат окиси бария должны находиться в отношении:
В a (SH)2 203 , 1П
Ва(ОН)а “ 171 " US
где 203 — мол, вес Ba(SH)2, а 171 — мол. вес Ва(ОН)2.
Практически же это отношение для крепких растворов не превышает 1,10—1,13, так как часть сульфгидрата бария окисляется воздухом в полисульфиды и гипосульфит бария. В слабых растворах гидролизуется большее количество BaS и окисляется большее количество Ba(SH)2, и поэтому в слабых растворах отношение Ba(SH)2: Ва(ОН)2 падает даже ниже 1,0. При применении таких растворов для производства литопона количество ZnO в осажденном литопоне повышается до 2—3%. Чем отношение Ba{SH)2: :Ва{ОН)2 меньше, тем количество ZnO в осажденном литопоне больше.
Содержание ZnO в литопоне зависит также от наличия в растворе ZnS04 основных сернокислых солей цинка. Основные сернокислые соли появляются в растворе ZnS04 в тех случаях, когда для получения сернокислого цинка применяют избыточные количества цинкового сырья. Образующиеся при этом основные соли при последующем взаимодействии с BaS образуют литопон, содержащий окись цинка. Точный состав этих основных сернокислых солей неизвестен, но если изобразить их состав формулой mZnS04 * пZnO, то при получении литопона наряду с основной реакцией будет протекать реакция
mZnS04 • «ZnO ~f~ mBaS •—> m (BaS04 — f — ZnS) — f — «ZnO
t. e. будет осаждаться литопон, содержащий ZnO. Чем больше в растворе цинкового купороса содержится основных солей, тем выше содержание окиси цинка в получаемом литопоне.
Раствор цинкового купороса, полученный по методу так называемого хлорирующего обжига {см. ниже), содержит наряду с ZnS04 также ZnCl2 и небольшие количества Na2S04. Вследствие. присутствия в растворе этих компонентов наряду с основной реакцией получения литопона протекает также побочная реакция;
BaS ZnCi2 ■—> BaCf2 f ZnS+15,6 ккал
Эта побочная реакция, протекая одновременно с основной реакцией осаждения литопона, вызывает изменение его состава:
BaS + ZnS04 —> BaS04 ZnS + 24 ккал BaS + ZnCl2 —>■ BaCI2 + ZnS ~|~ 15,6 ккал 2BaS — f ZnS04 -f ZnCl2 —► 2ZnS ~f BaS04 — f BaCl2 + 39,6 ккал
Из суммарной реакций следует, что в результате содержания в растворе цинкового купороса некоторого количества ZnCl2 получается литопон другого состава. В таком литопоне на одну молекулу BaS04 приходится не одна молекула ZnS, а больше (в приведенном примере две). Сернистого цинка в таком литопоне содержится тем больше, чем больше ZnCl2 в растворе цинкового купороса:
3BaS + Zn$04 + 2ZnC!2 —* 3ZnS — f BaS04 + 2BaCl2
Литопон с молекулярным отношением BaS04: ZnS = 1:1 содержит {как было указано на стр. І96) 29,4% ZnS; при отношении 1 :2 содержание ZnS возрастает до 45,5%, а при отношении 1:3 — до 55,7% и т. д.
Часть образующегося в этом случае ВаС12 реагирует с небольшим количеством Na2S04, содержащимся в растворе цинкового купороса, в результате чего выпадает Ва$04:
BaCI2 + Na2S04 —> BaS04-f 2NaCl
В результате этой реакции содержание ZnS в литопоне несколько понижается, но все же остается выше нормального, т. е. выше 29,4%.
Изменяя количество ZnCl2 в растворе цинкового купороса, можно получать литопоны с любым повышенным содержанием ZnS. Если необходим литопон нормального состава ZnS + BaS04 с содержанием ZnS 29,4% или еще ниже, к литопону с повышенным содержанием ZnS добавляют рассчитанное количество отбеленного тонко измолотого минерала барита {тяжелого шпата), состоящего почти исключительно из BaS04.
Различным сортам литопона присвоены следующие обозначения в зависимости от содержания ZnS {в %):
|
Желтая марка. . . . . |
…………………. 15 |
|
Красная « . . . . . |
………….. 29 |
|
Лиловая « . . . . |
………….. 35 |
|
Зеленая « , . . , |
…………… 40 |
|
Бронзовая « . . . ‘ |
‘ 50 |
|
Серебряная « . . . , |
………….. 60 |
Производство литопона распадается на три стадии: производство сернистого бария, производство цинкового купороса и производство литопона из полуфабрикатов.
 21 августа, 2015
21 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 