
|
7ТЮ250з TiOS04 Ti(S30)* 2Ti02S03 |
|
Рис. 46. Система ТіОй—S03—Н20: |
|
В табл. 18 приведена упругость паров безводного титанил — сульфата при разных температурах. Метод получения титанилсульфата основан на его способности выделяться из раствора Ті в 50—60%-ной H2S04. Приготовляют раствор сернокислого титана, содержащий 10—12% титана, считая |
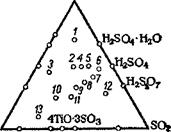
на ТЮ2, добавляют серную кислоту из расчета получения 50— 60% раствора (учитывая также H2S04, связанную с титанилсуль — фатом) и кипятят раствор до выделения почти всего титана в осадок в виде титанилсульфата. таблица is Наилучшие результаты получаются при избыточном количестве кислоты: 3—
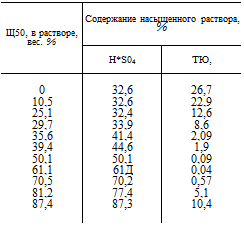 6 вес. ч. H2S04 на 1 вес. ч. титана, считая на ТЮ2.
6 вес. ч. H2S04 на 1 вес. ч. титана, считая на ТЮ2.
|
ТАБЛИЦА 16
|
Выделение титанилсульфата в осадок происходит при длительном кипячении раствора в течение’6—8 час. Выделение может быть
 значительно ускорено (до 1 часа) добавлением к раствору небольшого количества (1—3%) сухого титанилсульфата, играющего роль зародыша. Выделяющиеся кристаллы титанилсульфата фильтруют, промывают на фильтре 40 % — ной H2S04, спиртом и эфиром. Титанилсульфат выделяется в
значительно ускорено (до 1 часа) добавлением к раствору небольшого количества (1—3%) сухого титанилсульфата, играющего роль зародыша. Выделяющиеся кристаллы титанилсульфата фильтруют, промывают на фильтре 40 % — ной H2S04, спиртом и эфиром. Титанилсульфат выделяется в
виде крупных кристаллов и при осаждении не абсорбирует примеси, в связи с чем его можно получать в чистом состоянии даже из технических растворов сернокислого титана.
Титанилсульфат широко применяется в лабораторной практике [14—16].
Существует также пентагидрат титанилсульфата TiOS04 • 5Н20, который получается в виде белого аморфного вещества из раствора двуокиси титана в смеси спирта с серной кислотой. Описана также одноводная соль TiOS04 * Н20.
Обычно считают, .что безводной средней соли сульфата четырехвалентного титана Ti(S04)2 не существует. Недавно Гейек и Энгёль — рехт [17] описали способ получения этой соли путем обработки раствора четыреххлористого титана в сульфурилхлориде {502С12) жидким серным ангидридом (S03). Образование сульфата происходит по реакции;
TiCi4+6S03 —► Ті (S04)2 + 2S205C12
Серный ангидрид добавляется в раствор ТІСІ4 медленно, по каплям, при этом происходит сильный разогрев массы и выделение желтого осадка, который следует рассматривать как смесь разных соединений. При длительном нагревании суспензии (~ 12 час.) осадок становится белым, после чего его фильтруют, промывают сульфурилхлоридом и сушат под вакуумом для удаления S02C12. Получаемая соль очень гигроскопична, легко растворяется в воде и при нагревании разлагается на ТЮ2 и S03; часть $03 выделяется при 150°, остальное количество — при температуре красного каления (700—800°).
Описана также [18] водная соль этого сульфата Ti{S04)2-3H20, которая получается в виде желтой смолообразной массы окислением сульфата трехвалентного титана азотной кислотой и выпариванием полученного раствора.
Сульфаты титана проявляют склонность к образованию двойных солей с сульфатами щелочных и щелочноземельных металлов [19, 20]. Присутствие сильных катионов значительно повышает устойчивость сульфатов титана. Так, двойные соли нормального четырехвалентного титана Ti(S04)2 с сульфатами щелочных и щелочноземельных металлов являются прочными соединениями, например: Ti(S04)2 * Na2S04 *ЗН20; Ті(S04)2*K2S04• 3H20; Ti(S04)2. K2S04; Ti{S04)2*CaS04; Ti(S04)2*SrS04 и др.
Известны также двойные соли титанилсульфата с сульфатами щелочных и щелочноземельных металлов, как, например; TiOSOj • Na2S04; TiOS04 • K2SO4 * 3H20; TiOS04 • (NH4) 2S04. H20 и некоторые другие.
Двойные соли сульфата титана и щелочных металлов образуются или путем сплавления ТЮ2 с бисульфатами щелочных металлов, или путем добавления концентрированного раствора сернокислой соли щелочного металла к раствору сернокислого титана. В большинстве случаев они слабо растворяются в воде и в неконцентрированных растворах серной кислоты, в связи с чем образование двойных солей часто рекомендуется как метод выделения титана из раствора в осадок.
Так, например, Деменев, Шарова и Полякова [21] получили трудно растворимый в холодной воде двойной сульфат состава 2Ti0S04*2K2S04‘5H20 путем добавления сухого сернокислого калия (K2S04) к нагретому раствору сернокислого титана, содержащему ‘-‘-•’50 г/л Ті02 и 250 г/л H2S04. После растворения K2S04
нагревание прекращают и дают раствору остыть; при этом почти весь титан осаждается-в виде двойной соли.
Аналогичным путем может быть получена двойная аммониевая соль TiOS04 ■ (NH4)2S04 * Н20.
В горячей воде двойные соли сульфата титана и щелочных металлов разлагаются с выделением метатитановой кислоты.
При производстве двуокиси титана применяют не чистые растворы сернокислого титана, получаемые, например, растворением титанилсульфата в воде, а технические растворы, образуемые при
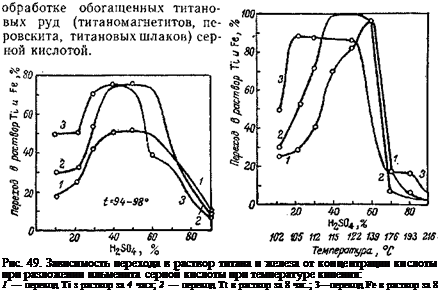 Рис. 48. Переход железа и титана в
Рис. 48. Переход железа и титана в
раствор в зависимости от концен-
трации серной кислоты:
1 — переход Ті в раствор за 4 часа; 2 — пере-
ход Ті в раствор за 8 час.; <?— переход Ге
в раствор за 8 час.
Скорость и полнота разложения титановых концентратов серной кислотой зависит от степени их измельчения, концентрации кислоты, ее избытка и температуры обработки.
Количество кислоты, необходимое для разложения, могло бы быть определено, исходя из следующих уравнений реакции:
FeTlOg + 3H2S04 —KTi (S04)2 + 3H20 + FeS04 (1)
FeTi03 + 2H2S04 —* TiOS04 + 2H20 + FeS04 (2)
По реакции (1) на 1 вес. ч. минерала необходимо 1,93 вес. ч. H2S04, а по реакции (2) — 1,29 вес. ч. H2SO4. Однако какая реакция протекает в действительности, неизвестно, — первая, вторая
или обе одновременно. Возможно также, что вначале проходит реакция (1), а затем протекает гидролиз по уравнению
Ті (S04)a + 2НаО —* Ti0S04 + H3S04
с освобождением части кислоты, которая вновь вступает в реакцию.
![]()
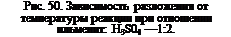
 В связи с тем, что неизвестен состав образующейся сернокислой соли титана, т. е. представляет ли она среднюю соль Ti{S04)2 или титанилсульфат TiOS04, а также вследствие содержания в концентратах значительного количества примесей — Fe203, А120з, MgO и других растворимых в кис — щ лоте окислов — количество кислоты, необходимое для разложения, не может быть рассчитано и устанавливается опытным путем. Многочисленными работами, а также практикой установлено, что для почти полного разложения иль — менитовых концентратов необходимо количество кислоты в 1,4—1,6 вес. ч. H2S04 на 1 вес. ч. концентрата.
В связи с тем, что неизвестен состав образующейся сернокислой соли титана, т. е. представляет ли она среднюю соль Ti{S04)2 или титанилсульфат TiOS04, а также вследствие содержания в концентратах значительного количества примесей — Fe203, А120з, MgO и других растворимых в кис — щ лоте окислов — количество кислоты, необходимое для разложения, не может быть рассчитано и устанавливается опытным путем. Многочисленными работами, а также практикой установлено, что для почти полного разложения иль — менитовых концентратов необходимо количество кислоты в 1,4—1,6 вес. ч. H2S04 на 1 вес. ч. концентрата.
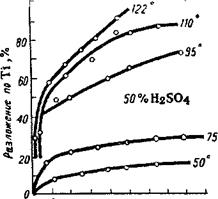
Влияние концентрации кислоты изучалось рядом исследователей. Богоявленский и Богуславская [22] показали, что разложение ильменита (и других титансодержащих материалов) происходит даже при
действии слабых кислот, как это видно из кривых, приведенных на рис. 48, 49, 50; количество кислоты в опытах рис. 50—двукратное по отношению к ильмениту, т. е. близкое к нормальному, а в опытах рис. 48 и 49—15,5-кратное, т. е. избыточное.
На рис. 50 показано также влияние температуры. Из хода кривых видно, что с повышением концентрации кислоты и температуры обработки скорость реакции быстро возрастает. Падение кривых в области концентрации выше 55—60% объясняется тем, что сернокислые соли титана и железа при этих концентрациях не переходят полностью в раствор. Приведенные данные показывают сравнительно хорошее разложение титановых концентратов 40— 50%-ной H2S04 при температуре кипения кислоты, т. е, при 122°. Однако при этом процесс разложения протекает весьма медленно— до 20 час.
Значительно полнее и быстрее разложение концентратов происходит при обработке концентрированной серной кислотой (90—95%-ной) ( что в определенной степени объясняется также
возможностью повышения при этом температуры разложения до 190—210°.
Растворы сернокислого титана в воде обладают рядом свойств, которые отличают их от обычных растворов — истинных и коллоидных. Так, все растворы сернокислого титана показывают эффект Тиндаля. Осторожное упаривание этих растворов не приводит к образованию кристаллического осадка "постоянного состава и обычно заканчивается образованием полужидких или твердых стеклообразных масс, напоминающих типичные гели.
Оказалось также, что растворы сернокислого титана одинакового состава могут весьма сильно различаться по своей устойчивости в зависимости от условий получения, что не должно иметь места при истинных растворах. Весьма характерным в этом отношении является также растворение двуокиси титана в концентрированной серной кислоте, которое отличается от обыкновенных процессов растворения окисей в кислотах и напоминает пептиза — цию коллоидных веществ. Так, например, растворение 1 вес. ч. ТЮ2 в 2,6 вес. ч. H2SO4 при температуре выше 120—130° происходит с постепенным увеличением вязкости жидкости до превращения ее в прозрачную пасту. Явление протекает так, как будто бы частицы двуокиси титана поглощают серную кислоту, набухая при этом и образуя коллоидную массу.
Вместе с тем растворы сернокислого титана не обладают структурной вязкостью, не коагулируют при высаливании кислотой, солями и спиртом и при диализе проходят в значительной степени через полупроницаемую перегородку, т. е. ведут себя как истинные растворы.
Противоречивые свойства растворов сернокислого титана пытаются объяснить тем, что титан в сернокислом растворе находится как в ионном, так и в коллоидном состоянии, причем оба эти состояния находятся между собою в равновесии. В концентрированных растворах и сильнокислой среде превалирует ионное состояние, в разбавленных растворах и слабокислой — коллоидное [23].
Растворы сернокислого титана являются сильнокисльши, кислота в них находится как бы в свободном состоянии; для характеристики такого состояния кислеты введен термин активная кислотность.
В титановых растворах различают три вида H2S04: а) свободную, под которой понимают избыточную кислоту против расчетного количества, необходимого для образования сернокислого титана Ті(S04)2 или TiS04; 6} активную, представляющую собою сумму свободной кислоты и кислоты, связанной с титаном, и в) кислоту, связанную с титаном, которая определяется расчетом, как разность кислоты активной и свободной. Для практических целей имеет значение только активная кислота, которую обычно определяют путем титрования. Активную кислоту характеризуют
весовым отношением H2SO4: ТЮ2, которое называют кислотным фактором и обозначают через F. Так, например, растворы сернокислого титана с содержанием 200 г/л ТЮ2 и 400 г/л H2SO4 имеют
F = ^ = 2, растворы с содержанием*150 г/л ТЮ2 и 270 г/л актив-
270
ной H2SO4- имеют F ~ 256 = 1.8 и т. д.
Иногда кислотность выражают в процентах избытка кислоты против необходимой для образования титанилсульфата. Кислотность вычисляют по формуле:
^ свободная кислота■100
где 1,22 — весовое отношение H2SO4: ТЮ2 в титанилсульфате.
Эту формулу можно представить в несколько ином виде, а именно:
![]() К =»
К =»
Так, например, кислотность раствора, содержащего 200 г/л ТЮ2 и 366 г/л H2S04, при F= 1,83:
![]() 1,83—1,22
1,83—1,22
Растворы сернокислого титана проявляют склонность к старению, которое выражается в их помутнении, и выделению из них осадков даже при недлительном хранении. Растворы, в которых склонность к старению выражена сильно, называются нестабильными, в отличие от стабильных растворов, которые могут сохраняться продолжительное время, не выделяя коллоидных частиц. Стабильность находится в непосредственной зависимости от концентрации в растворе ТЮ2, активной H2SO4 и от фактора кислотности. Так, например, растворы, содержащие 120 г/л ТЮ2 и имеющие F ниже 1,7—1,8, малостабильны. При том же содержании ТЮ2, но F>1,8—2,0, растворы стабильны, а растворы, содержащие 180—200 г/л ТЮ2 (и выше), стабильны даже при F ~ 1,7~ 1,8, так как в этом случае высокая концентрация активной кислоты предотвращает выпадение коллоидных частиц.
Для производства двуокиси титана применяют растворы сернокислого титана с содержанием 120—200 г/л титана, считая на ТЮ2 с фактором кислотности —2.
Одним из основных свойств растворов сернокислого титана является их способность к гидролизу при разбавлении или при нагревании с выделением в осадок гидрата окиси титана,
В сильно разбавленных растворах гидролиз протекает на холоду, в концентрированных — лишь при нагревании.
В отличие от солей других металлов гидролиз солей титана может происходить при очень большой концентрации кислоты в маточном растворе до 400—500 г)л [24].
Скорость и полнота гидролиза зависят от температуры, концентрации в растворе титана и свободной кислоты, а также его стабильности.
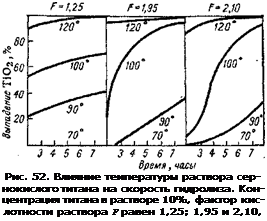
На рис. 51, 52, 53 приведены кривые, характеризующие эту зависимость (концентрация титана в растворе 10%, считая на ТЮа).
Как видно из кривых рис. 52, при 70° гидролиз не проходит, при 90° — весьма слабо и лишь при 100й — со значительной скоростью и-полнотой. Дальнейшие повышения температуры до 120°
приводят к еще большему ускорению гидролиза.
Кривые рис. 51 показывают, что при факторе кислотности 2,56 гидролиз протекает крайне медленно, при факторе 2,11— недостаточно полно, при F от 1,55 до 1,95 — весьма быстро и полно, причем, чем ниже кислотность, тем полнее.
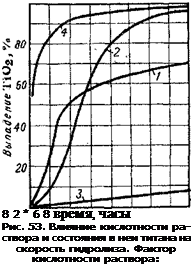
![]() На кривых рис. 53 показан ход гидролиза двух растворов сернокислого титана (/ и 3) одинакового состава с тем различием, что в одном растворе титан находится в стабильном состоянии, в другом — в коллоидном. Стабильный раствор гидролизуется весьма медленно, коллоидный же очень быстро, несмотря на большое содержание в растворе свободной кислоты (фактор кислотности 2,56) [25],
На кривых рис. 53 показан ход гидролиза двух растворов сернокислого титана (/ и 3) одинакового состава с тем различием, что в одном растворе титан находится в стабильном состоянии, в другом — в коллоидном. Стабильный раствор гидролизуется весьма медленно, коллоидный же очень быстро, несмотря на большое содержание в растворе свободной кислоты (фактор кислотности 2,56) [25],
Гидролиз при кипячении в начальный период протекает медленно, после определенного периода, называемого инкубационным, ускоряется и в конечной стадии вновь замедляется. Процессы, происходящие при гидролизе, могут быть в общем виде представлены следующим образом: вначале, в инкубационный период, образуются центры кристаллизации, затем происходит наращивание на этих центрах мицелл двуокиси титана с образованием коллоидного раствора и, наконец, укрупнение частиц и их выделение в осадок.
Для выделения всего или почти всего титана (95—97%)’ в осадок необходимо кипячение в течение длительного времени (~8час.), особенно при работе с сильно концентрированными растворами. Необходимость длительного кипячения объясняется трудностью образования в сильнокислых растворах коагуляционных центров, в связи с чем инкубационный период сильно растягивается,
Оказалось, что процесс гидролиза может быть значительно ускорен путем добавления к раствору зародышей, служащих центрами кристаллизации. В качестве зародышей предлагались многочисленные соединения, но наибольшее значение имеют зародыши, представляющие собою коллоидные растворы гидроокиси титана; эти зародыши были предложены Мекленбургом [26] и ■ Блюменфель — дом [27].
 Чтобы верно направить гидролиз, необходимо наличие в растворе точно соответствующего числа (на единицу ТЮ2) зародышей определенного состава. Растворы до гидролиза должны быть свободны от коллоидных примесей. В так называемых нестабильных растворах сернокислого титана уже существуют центры кристаллизации или коагуляции, но как состав, так и количество их переменны, и поэтому гидролиз каждой новой партии в этом случае протекает по-иному.
Чтобы верно направить гидролиз, необходимо наличие в растворе точно соответствующего числа (на единицу ТЮ2) зародышей определенного состава. Растворы до гидролиза должны быть свободны от коллоидных примесей. В так называемых нестабильных растворах сернокислого титана уже существуют центры кристаллизации или коагуляции, но как состав, так и количество их переменны, и поэтому гидролиз каждой новой партии в этом случае протекает по-иному.
Гидраты окиси титана
При обработке на холоду водного раствора солей титана щелочами (NaOH, NH4OH, ЫагСОз) выпадает гелеобразный осадок гидрата окиси титана. Этот гидрат хорошо растворяется на холоду в органических и разбавленных минеральных кислотах, щелочах, а также растворах солей титана. Образующиеся при этом растворы имеют явно выраженный коллоидный характер.
![]() По своему составу этот гидрат приближается к дигидрату двуокиси титана ТЮ2-2Н20, или ТЦОН)*. При старении (например, путем нагрева) гидрат теряет гелеобразный характер, а также способность легко пептизироваться и
По своему составу этот гидрат приближается к дигидрату двуокиси титана ТЮ2-2Н20, или ТЦОН)*. При старении (например, путем нагрева) гидрат теряет гелеобразный характер, а также способность легко пептизироваться и
растворяться в органических и слабых минеральных кислотах, щелочах и растворах солей титана. Так, например, насыщенный раствор, образующийся при обработке «состарившегося» гидрата 20%-ной H2S04 при 25° содержит лишь 0,5% титана, при обработке 35%-ной H2SO4 — 2,25% титана (считая на ТЮ2). Полностью он растворяется лишь в концентрированной серной кислоте при нагревании, например, 60—70%-ной H2SO4 при 130—140°.
По содержанию связанной воды гидрат при старении приближается к моногидрату ТЮ2*Н20, или TiO(OH)2.
В связи с амфотерным характером гидратов окиси титана с превалированием в них кислотных свойств их рассматривают как титановые кислоты, а именно как ортотитановую, или а-титановую, кислоту Н4ТЮ4 и как метатитановую, или р-титановую, кислоту Н2ТіОз.
Рентгеноанализ гидратов окиси титана показывает, что ортокислота является аморфным соединением, мета-кислота обладает слабо выраженной кристаллической структурой, которая полностью совпадает с кристаллической структурой двуокиси титана модификации анатаз.
Это дает основание предполагать, что титановые, кислоты в сущности представляют собою двуокись титана в состоянии высокой дисперсности и активности, вследствие чего они прочно удерживают значительное количество воды.
Ортотитановая и метатитановая кислоты получаются из солей титана путем осаждения щелочами или путем гидролиза: орто-кислота — на холоду, мета-кислота — при кипячении:
TiOS04 — f — Na2C03 -р 2Н20 комнатная * 14Ді04 + Na2S04 + С02
температура
TiOS04 Д — 2НгО сильное разбавление; * H4Tl04 — j — H2S04
комнатная температура
ТЮ304 + Na2C03 + Н20 Н2ТЮ3 + Na2S04 + СО,
TiOS04 + Н20 кипячение-^ Н*ТЮз + H*S04
Метатитановая кислота образуется также при обработке металлического титана концентрированной азотной кислотой или перекисью водорода в среде аммиака [28].
Метатитановая кислота является основным промежуточным продуктом при производстве двуокиси титана.
В промышленности она получается исключительно путем гидролиза раствора сернокислого или хлористого титана при кипячении.
Титановые кислоты, получаемые при гидролизе растворов сернокислого титана, адсорбируют значительное количество сернокислых ионов — примерно до 0,3 моля SO4” на моль Ті в случае орто-кислоты и ОД моля SO4 —в случае мета-кислоты.
 20 августа, 2015
20 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 