Окраска химических соединений, и в частности пигментов, является следствием избирательного поглощения ими составных частей белого цвета. В результате избирательного поглощения пигмент кажется окрашенным в цвет, дополнительный поглощенному.
Избирательное поглощение, а следовательно и цвет химических соединений (пигментов), с точки зрения современного учения
0 строении вещества, объясняется структурой кристаллической решетки.
В настоящее время в результате работ Бора атом представляется состоящим из электромагнитного ядра и электронов, которые вращаются вокруг ядра по определенным орбитам. Электромагнитное ядро, заряжено положительно; его заряд составляет от
1 до 92 элементарных единиц[4]. Число элементарных зарядов электромагнитного ядра равно номеру, определяющему положение элемента в таблице Менделеева. Число электронов, вращающихся
вокруг ядра, равно числу зарядов ядра. В таком виде атом представляет собой нейтральную, уравновешенную электромагнитную систему.
Если из наружной электронной орбиты атома каким-нибудь способом удалить один или несколько электронов, то атом зарядится положительно, так как соответствующее число положительных зарядов не будет нейтрализовано электронами. Следовательно, в результате удаления электронов нейтральный атом превращается в положительно заряженный катион. При введении в электронные орбиты излишних электронов получается отрицательно заряженный анион. Анион и катион взаимно притягиваются. При достаточном их сближении катион может перетянуть в свои орбиты излишние электроны аниона. В этом случае, если только заряды аниона и катиона по величине равны, получается электромагнитно-нейтральная молекула.
Так как орбиты электронов лежат не в одной плоскости, то ион можно рассматривать как шар, в центре которого находится электромагнитное ядро. Радиус такого шара — ионный радиус — равен радиусу орбиты, по которой движутся наиболее удаленные от ядра электроны. Величина ионных радиусов для разных веществ различна. Для катионов величина ионного радиуса R колеблется
от 0,16 А {для углерода) до 1,65 А (для цезия), для большинства же катионов ионный радиус равен приблизительно 1 А. Ионные радиусы анионов больше: от 1,32 А (для кислорода) до 2,20 А (для иода) [16, 17].
В зависимости от величины ионных радиусов веществ, принимающих участие в образовании кристаллической решетки, могут встретиться два случая.
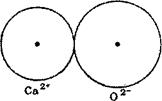
В одном случае кристаллическая решетка образуется катионом с большим ионным радиусом (например, Cs—1,65 А) и анионом с маленьким (например, О—1,32 А); при этом ионные радиусы аниона и катиона оказываются приблизительно одинаковыми, и ионы, образуя кристаллическую решетку, сближаются на расстояние, определяемое только их зарядом и величиной ионных радиусов. Анионы и катионы с приблизительно одинаковыми ионными радиусами при расположении в пространстве образуют симметричную кристаллическую решетку, в узлах которой находятся ионы. Расстояние между узлами такой кристаллической решетки равно сумме ионных радиусов аниона и катиона.
При прохождении света через симметрично построенную кристаллическую решетку электромагнитные световые колебания не изменяются. Таким образом, если белым светом осветить вещество с симметричной кристаллической решеткой, то оно будет казаться белым, так как все колебания, из которых состоит белый свет, пройдут через такую кристаллическую решетку неизменными; при
освещении красным светом такое вещество будет казаться красным.
 |
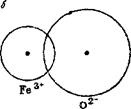 |
В кристаллических решетках, построенных из ионов с различными по величине ионными радиусами, оптические явления протекают иначе. Когда небольшой катион соприкасается вследствие взаимного притяжения с значительно большим анионом, то электроны аниона, вращающиеся по наружной орбите, оказываются ближе к положительному ядру катиона, чем к собственному. Вследствие этого наружные орбиты аниона втягиваются в сферу катиона, но они не могут дойти до положительно заряженного ядра катиона, так как на них одновременно действуют (отталкивают) электроны катиона, В результате действия этих сил орбиты аниона оказываются только частично втянутыми в сферу катиона.
Ряс. 21. Схема сочетания ионов с приблизительно одинако-
выми и разными радиусами:
а —известь СаО — белая; б—окись железа РеЮ.,™красная, бурая.
На рис. 21 схематически показано сочетание ионов Са2+ и О2- в извести и Fe3+ и О2" в окиси железа. В первом случае ионные радиусы почти равны (1,06 и 1,32 А), вследствие чего ионы только соприкасаются и расстояние между их ядрами равно сумме ионных радиусов; во втором случае разница размеров ионных радиусов
велика (0,67 и 1,32 А), и поэтому ион кислорода втянут в сферу иона железа. В результате внедрения сферы аниона в катион сам анион оказывается как бы смещенным, а молекула, состоящая из таких ионов, и кристаллическая решетка вещества становятся асимметричными, поляризованными. Степень асимметрии кристаллической решетки зависит от величины отношения RK:Rat где RK— ионный радиус катиона, а Ra — ионный радиус аниона. Чем больше разница в величине ионных радиусов, тем отношение RK : Ra меньше, а степень асимметрии больше.
При освещении асимметричной кристаллической решетки белым светом не все колебания, из которых состоит белый свет, проходят сквозь решетку. Те колебания, которые не могут пройти, затухают, и энергия этих колебаний превращается в другой вид энергии — тепловую энергию решетки или какую-нибудь другую; вещество же кажется окрашенным в цвет, дополнительный затухшим колебаниям.
В первую очередь в асимметричной решетке затухают наиболее коротковолновые колебания, т. е. соответствующие фиолетовому цвету; в этом случае вещество кажется окрашенным в цвет, дополнительный фиолетовому, — зеленовато-желтый. С увеличением асимметрии кристаллической решетки затухают колебания с последовательно увеличивающейся длиной волны, и вещество окрашивается в соответствующие дополнительные цвета: желтый, оранжевый, красный, фиолетовый, синий, голубой, голубовато-зеленый и зеленый. Изменение цвета в направлении: белый, зеленовато-желтый, оранжевый, красный, фиолетовый, синий, голубой, голубоватозеленый, зеленый и черный — называется понижением, или углублением, цвета. Изменение цвета в обратном направлении называется повышением цвета. Следовательно, при повышении асимметрии кристаллической решетки окраска вещества углубляется. У нескольких соединений, состоящих из одинаковых катионов и разных анионов одного вертикального ряда периодической системы элементов, окраска должна понижаться с повышением атомного веса аниона, так как повышение атомного веса аниона связано с увеличением его ионного радиуса, а следовательно, и с увеличением асимметрии решетки. Действительно, если сравнить галоидные соединения серебра, то цвет их понижается от AgCl к AgJ, переходя от белого через бледно-желтый к чисто-желтому.
В табл. 6 показано изменение цвета соединений серебра, свинца и фосфора в зависимости от увеличения атомного веса аниона.
ТАБЛИЦА б
|
Катион и его ионный радиус Рк, А |
Анион, его атомный вес и ионный радиус J? , А |
Соединение |
Степень асимметрии e |
Цвет |
|
Ag, 1,13 |
‘ CI (35,46), 1,81 |
AgCl |
1,13:1,81=0,63 |
Белый |
|
Вг (79,92), 1,96 |
AgBr |
1,13:1,96 = 0,58 |
Бледно- желтый |
|
|
J(126,93), 2,20 |
AgJ |
1,13:2,20 = 0,51 |
Желтый |
|
|
Pb, 1,32 |
0(35,46), 1,81 |
PbCI2 |
1,32:1,81 =0,73 |
Белый |
|
Вг (79,92), 1,96 |
PbBr2 |
1,32: 1,96 =0,67 |
Белый |
|
|
J (126,91), 2,20 |
PbJ2 |
1,32:2,20=0,60 |
Желтый |
|
|
Р, 0,4 |
0(16,00), 1,32 |
P2Os |
0,4 :1,32 = 0,67 |
Белый |
|
5 (32,07), 1,74 |
p2s5 |
0,4 : 1,74 =0,23 |
Желтый |
|
|
Se (78,96),-1,91 |
P2Se5 |
0,4 : 1,91 =0,20 |
Красный |
Такое же изменение цвета наблюдается у ряда соединений, имеющих одинаковый анион и разные катионы одного вертикаль-
ного ряда периодической системы элементов. В этом случае изме< некие асимметрии кристаллической решетки, а следовательно, и цвета связано с понижением связи наружных электронов у эле* ментов с большим атомным весом. Действительно, если взять ряд сернистых соединений Zn, Cd и Hg, то цвет этих соединений понижается с увеличением атомного веса катионов: ZnS — вещество белого цвета, CdS — желтого, a HgS— красного или черного. Такая же зависимость существует у сернистых соединений фосфора, мышьяка, сурьмы и висмута: P2S5— белого цвета, As2Ss — желтого, Sb2S5 — красного и Bi2S5 — черно-бурого.
Повышение степени окисления повышает также и степень асимметрии кристаллической решетки и поэтому ведет к углублению окраски соединения. Так, в ряде окислов свинца окраска углубляется от РЬО к РЬ02. Действительно, РЬО — соединение желтого цвета, РЬ3С>4 — красного, а РЬ02 — бурого, почти черного.
Наибольшее значение для лакокрасочной промышленности имеют поливалентные элементы, т. е. элементы с переменной валентностью. У таких элементов ионные радиусы могут изменяться, и соответственно изменяются и асимметрия кристаллической решетки и цвет соединения (пигмента), в которое этот элемент входит. Такие поливалентные элементы, действительно, входят в состав важнейших пигментов; к ним относятся Cr, Fe, Со, Мп, РЬ и др. Поливалентные атомы и группы атомов, присутствием которых обусловливается окраска пигментов, называют хромофорами.
Цвет химических соединений (пигментов) определяется, однако, не только степенью асимметрии кристаллической решетки; в некоторых пределах он может колебаться в зависимости от физических свойств пигмента и, в частности, от его дисперсности, которая определяет условия отражения света.
Цвет пигмента, как и вообще всякий цвет, может быть охарактеризован координатами в цветовом графике. Однако так как на практике цвета отдельных партий пигмента могут несколько отличаться, то точки, определяющие их положение в цветовом графике, не совпадают, а располагаются в пределах некоторой области. Чем стабильнее производство, чем меньше одна партия пигмента отличается от другой, тем меньше эта область. Некоторое влияние на цвет пигментов оказывает, как было указано выше, степень их дисперсности.
Изучение влияния дисперсионного состава пигментов на их технические свойства показало, что если пигмент, содержащий обычно частицы различных размеров, разложить на фракции, состоящие из частиц близких размеров, то свойства этих фракций и, в частности, цвет будут различны.
Характеристика цветов отдельных фракций, выделенных из ультрамарина, окиси хрома и железного сурика, приведена в табл. 7.
5 Е. Ф. Беленький, И. В. Рискин
Из приведенных в табл. 7 данных видно, что’при уменьшении размеров частиц пигмента усиливается его основной тон. Так, количество синего в ультрамарине растет с 0,676 до 0,739, после чего несколько уменьшается; количество зеленого в окиси хрома растет с 0,395 до 0,463, а количество красного в сурике повышается с 0,344 до 0,522. Это усиление основного тона идет за счет ослабления двух других составляющих.
Яркость цвета г во всех случаях с уменьшением размера частиц растет. В табл. 7 яркость выражена в процентах от яркости MgO. И наконец насыщенность с уменьшением размера частиц также повышается. Действительно, если взять фракцию ультрамарина ВО—60 р, то из ее цвета можно выделить 0,139 белого цвета, так как в наименьшем количестве в этой фракции содержится зеленый цвет и количество этого зеленого равно 0,139. Из фракции же 2—1 р можно выделить белоголишь 0,122, т. е. цвет этой фракции ближе к спектральному.
У окиси хрома из фракции 40— 20 р можно выделить 0,255 белого цвета, так как в наименьшем количестве эта фракция содержит синий цвет, количество которого составляет 0,255; из фракции же < 1 р можно выделить белого цвета лишь 0,180, т. е. ее цвет ближе к спектральному и насыщеннее.
Так как цвет пигментов зависит от величины частиц, а величина частиц, как будет показано ниже, зависит от соблюдения строго определенного режима производства, то для получения пигментов постоянного цвета необходимо строго соблюдать установленный технологический режим производства.
 18 августа, 2015
18 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 