Электрохимическая коррозия существенно отличается от химической коррозии — прежде всего тем, что электрохимическая коррозия, всегда сопровождается переносом электронов, т. е. возникновением электрического тока; при химической же коррозии никаких
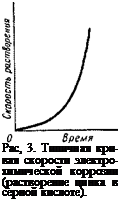
электрических явлений не происходит. Второе различие заключается в изменении скорости процесса коррозии во времени. Химическая коррозия сопровождается образованием защитной пленки, которая вызывает самоторможение реакции. Поэтому процесс химической коррозии идет с постепенно убывающей скоростью; скорость же процесса электрохимической коррозии во времени возрастает. В этом можно легко убедиться на простейших примерах электрохимической коррозии, например на растворении цинка в серной кислоте. Кривые скорости электрохимической коррозии в координатах время — скорость растворения всегда имеют более или менее крутой изгиб книзу. Для примера на рис. 3 приведена кривая скорости растворения цинка в серной кислоте.
 Основоположником электрохимической теории коррозии следует считать Де ла Рива. К мысли об электрохимической природе процесса коррозии он пришел в результате наблюдений над растворением цинка в серной кислоте. Своими работами Де ла Рив установил, что чем чище цинк, тем медленнее он растворяется в серной кислоте и что при погружении цинка в серную кислоту водород выделяется не со всей поверхности цинка, а только с отдельных участков. Для объяснения этих явлений Де ла Рив создал гипотезу микроэлементов.
Основоположником электрохимической теории коррозии следует считать Де ла Рива. К мысли об электрохимической природе процесса коррозии он пришел в результате наблюдений над растворением цинка в серной кислоте. Своими работами Де ла Рив установил, что чем чище цинк, тем медленнее он растворяется в серной кислоте и что при погружении цинка в серную кислоту водород выделяется не со всей поверхности цинка, а только с отдельных участков. Для объяснения этих явлений Де ла Рив создал гипотезу микроэлементов.
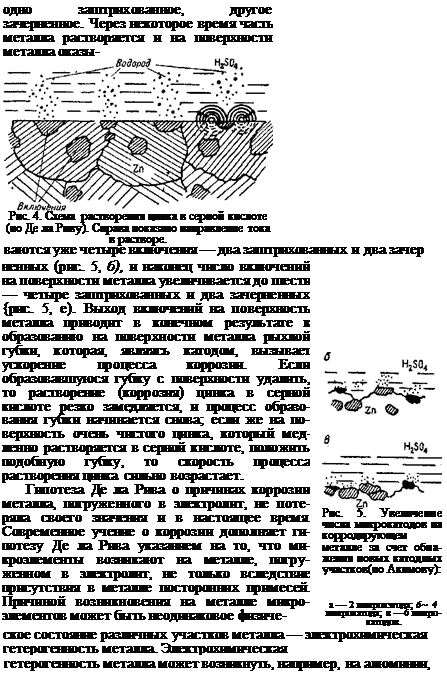
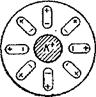
Сущность гипотезы микроэлементов заключается в следующем: на всяком металле, погруженном в электролит, образуется множество микроскопических гальванических элементов (микроэлементов). Микроэлементы образуются вследствие того, что в металле всегда имеются очень мелкие посторонние включения. Эти включения, металл и электролит образуют гальванический элемент, работающий по схеме: металл і электролит і включение! металл. В таком замкнутом самим металлом элементе металл является анодом, а включения — катодами, и поэтому металл (анод) переходит в раствор — корродирует. Скорость растворения металла зависит от природы включений. Схема растворения цинка в серной кислоте по Де ла Риву приведена на рис. 4.
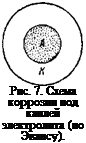
При растворении металла число микрокатодов, находящихся на поверхности металла, со временем увеличивается. Это происходит потому, что в результате растворения металла обнажаются и оказываются на поверхности частицы посторонних включений, находившиеся раньше в толще металла. Процесс увеличения числа микрокатодов на корродирующем (растворяющемся) металле показан на рис. 5. На рис. 5, а показана начальная стадия коррозии: на поверхности металла видны только два различных включения —
![]()
![]()
если лист алюминия на одном конце загнуть. При погружении такого листа в соответствующий электролит загнутый конец алюминия корродирует; следовательно, в образовавшихся местных (локальных) микроэлементах загнутый участок является анодом.
![]()
![]() Наконец, процесс коррозии может развиваться на металле, когда к разным участкам совершенно однородного металла имеется различный доступ воздуха. В этих случаях участок, получающий больш^ воздуха или кислорода, оказывается катодом. Коррозия вследствие неравномерной аэрации была подробно изучена Эвансом [10, И]. В своих опытах Эванс применял прибор, изображенный на рис. 6.
Наконец, процесс коррозии может развиваться на металле, когда к разным участкам совершенно однородного металла имеется различный доступ воздуха. В этих случаях участок, получающий больш^ воздуха или кислорода, оказывается катодом. Коррозия вследствие неравномерной аэрации была подробно изучена Эвансом [10, И]. В своих опытах Эванс применял прибор, изображенный на рис. 6.
 Прибор Эванса состоит из сосуда, наполненного раствором хлористого калия и разделенного полупроницаемой пергаментной перегородкой на два отделения. В оба отделения погружены совершенно одинаковые пластинки шлифованной обезжиренной стали. При замыкании пластинок через гальванометр стрелка последнего не отклоняется, следовательно, электрический ток не возникает. Если же через одно из отделений пропускать кислород или даже воздух, стрелка гальванометра отклоняется, указывая на появление тока. Пластинка в аэрируемом отделении оказывается катодом.
Прибор Эванса состоит из сосуда, наполненного раствором хлористого калия и разделенного полупроницаемой пергаментной перегородкой на два отделения. В оба отделения погружены совершенно одинаковые пластинки шлифованной обезжиренной стали. При замыкании пластинок через гальванометр стрелка последнего не отклоняется, следовательно, электрический ток не возникает. Если же через одно из отделений пропускать кислород или даже воздух, стрелка гальванометра отклоняется, указывая на появление тока. Пластинка в аэрируемом отделении оказывается катодом.
![]()
![]()
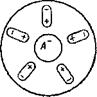
 Возникновение локальных микроэлементов вследствие неравномерной аэрации Эванс доказал также, изучая коррозию под каплей электролита на шлифованной поверхности стали. Через некоторое время под каплей на поверхности металла образуется белая пленка, не доходящая до краев капли (рис. 7). Пленка постепенно приобретает бурую окраску.
Возникновение локальных микроэлементов вследствие неравномерной аэрации Эванс доказал также, изучая коррозию под каплей электролита на шлифованной поверхности стали. Через некоторое время под каплей на поверхности металла образуется белая пленка, не доходящая до краев капли (рис. 7). Пленка постепенно приобретает бурую окраску.
После удаления капли на ее месте можно обнаружить темный участок разрушенного металла в центральной части капли и светлое кольцо неразрушенного металла по краю капли. Следовательно, центральная часть стали под каплей, куда воздух Не попадал, была анодом,
а наружный, хорошо аэрируемый участок по периферии капли,— катодом.
Возникновение локальных микроэлементов, вследствие неравномерной аэрации электролита, является одной из причин сильной коррозии морских судов и портовых сооружений.
В промышленности встречаются случаи, когда электрохимическая коррозия возникает в результате образования локальных элементов с сравнительно крупными электродами. Образующиеся в этом случае гальванические элементы в отличие от микроэлементов называют макроэлементами. Примером такого макроэлемента могут служить некоторые типы морских катеров, у которых алюминиевый или дюралюминиевый корпус склепан стальными заклепками. В образующемся здесь макроэлементе, работающем по схеме алюминий|морская вода|сталь) алюминий, анодом является алюминий, который и корродирует.
Электрохимическая коррозия всегда происходит в результате действия на металл раствора электролита. Всякий металл является веществом кристаллическим. Его атомы расположены в определенном порядке и образуют кристаллическую решетку. Строение кристаллической решетки определяет кристаллическую систему металла,
В процессе образования-кристаллитов, из которых состоят металлы, правильное строение и целостность кристаллической решетки нарушаются, и в решетке появляются деформированные участки. Эти участки расположены преимущественно по граням кристаллитов, так как в процессе роста кристаллиты соприкасаются своими гранями и давят друг на друга. Атомы металла расположены в узлах решетки; они могут отсутствовать только в отдельных узлах деформированных участков решетки. Каждый атом в зависимости от валентности несет один или несколько положительных зарядов. Соответствующее число свободных электронов двигается между атомами металла, но они в своем движении ограничены электростатическими силами.
Частицы металла, находящиеся в узлах решетки, называют ион — атомами. От обычных ионов металла они отличаются тем, что существуют только вместе с электронами, с которыми они связаны электростатическими силами. Если электрон оторвать от ион-атома, последний превращается в обыкновенный ион металла:
М+6 —> M+-f 8
Если же электрон прочно присоединяется к ион-атому, получается нейтральный атом металла:
М+0 —* М
Если поместить металл в электрическое поле, то все электроны, движение которых беспорядочно и ограниченно, начинают двигаться в одну сторону, при этом происходит перенос зарядов, т. е. возникает электрический ток и проявляется одно из основных свойств металла^—проводимость. Так как эта проводимость обусловлена движением электронов, то ее называют электронной проводимостью.
Проводимостью обладают также и растворы электролитов, но а этом случае проводимость обусловлена движением не электронов,
а ионов. Поэтому проводимость растворов электродитов называют ионной проводимостью. Наличие у растворов электролитов ионной проводимости можно объяснить следующим образом.
При растворении в воде электролита его молекулы начинают распадаться на ионы. Металлы и водород образуют катионы, которые несут положительные заряды, а кислотные радикалы и гидроксильные группы — анионы, которые несут отрицательные заряды. Катионы и анионы совершают в электролите беспорядочное движение. Распад молекул электролита на ионы ограничен, так как реакция образования ионов из молекул обратима:
Мо А + К
где А — анион, К — катион, Мо —~ молекула,
Если поместить раствор электролита в электрическое поле, то беспорядочное движение ионов прекращается: анионы начинают
![]()
 двигаться к аноду, катионы — к катоду. Нарушенное равновесие реакции восстанавливается за счет распадения нового числа молекул на ионы.
двигаться к аноду, катионы — к катоду. Нарушенное равновесие реакции восстанавливается за счет распадения нового числа молекул на ионы.
![]() Упорядоченное движение ионов электролита в растворителе проявляется в проводимости раствора и явлении электрического тока. Перенос электрических зарядов в растворе электролита сопровождается, в отличие от переноса электронов в металле, обязательно и переносом эквивалентного количества вещества.
Упорядоченное движение ионов электролита в растворителе проявляется в проводимости раствора и явлении электрического тока. Перенос электрических зарядов в растворе электролита сопровождается, в отличие от переноса электронов в металле, обязательно и переносом эквивалентного количества вещества.
Ионы, образующиеся при растворении электролита в воде, несут разноименные заряды: анион несет, как было указано, отрицательный заряд, катион — положительный. Вследствие присутствия на них зарядов ионы притягивают к себе полярные молекулы воды, поэтому вокруг иона образуется мономолекулярний слой воды с ориентированными молекулами: вокруг аниона — наружу кислородом {отрицательным зарядом) и вокруг катиона — наружу водородом (положительным зарядом) {рис. 8). Слой ориентированных молекул, в свою очередь (хотя и слабее), действует на другие молекулы воды.
Применяя не совсем обычное изображение молекулы воды, можно обозначить гидратированный катион через К^лгОН*1 и анион — через А—я+Н20~. Образование из ионов молекулы или атома сопровождается освобождением связанных ориентированных молекул воды, например:
К+*т“0Н2+ + А"*л+Н20" —Мо-Н^ + гг)Н20 К+ • т~ОН2+ + Є ■—► К + тпЩО
Описанные электрические системы металла и электролита позволяют составить следующую схему процесса электрохимической коррозии.
|
с j-** і, |
При действии электролита на металл может оказаться, что силы гидратации действуют на ион-атом сильнее, чем силы, связывающие его с электроном. В этом случае связь между ион-атомом и электроном порвется; ион-атом переходит в электролит и гидратируется. В результате выхода иона из металла в металле образуется избыток электронов и он получает отрицательный заряд, а в электролите образуется избыток положительно заряженных ионов, и он получает положительный заряд.
![]()
![]()
![]()
![]()
 Вследствие действия электростатических сил вышедшие из металла ионы удерживаются у поверхности металла и образуют с электронами двойной слой, тормозящий дальнейший выход ионов в раствор (рис. 9). В замкнутом элементе электроны двойного слоя нейтрализуются зарядом катиона электролита. В результате этой нейтрализации освобождается место в двойном слое и в раствор может перейти дополнительное число ионов металла, т, е. идет дальнейшая коррозия металла.
Вследствие действия электростатических сил вышедшие из металла ионы удерживаются у поверхности металла и образуют с электронами двойной слой, тормозящий дальнейший выход ионов в раствор (рис. 9). В замкнутом элементе электроны двойного слоя нейтрализуются зарядом катиона электролита. В результате этой нейтрализации освобождается место в двойном слое и в раствор может перейти дополнительное число ионов металла, т, е. идет дальнейшая коррозия металла.
Эти процессы можно представить следующей схемой:
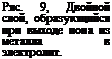 М+*0 -f тН20 —► М+ • тН20 0
М+*0 -f тН20 —► М+ • тН20 0
бад — у 0даг
К+ ■ пН20 + 0 —► К + пН20
Из этой схемы следует, что при замыкании элемента металл, анод, переходит в ионное состояние — корродирует, а на катоде выделяются нейтрализованные катионы электролита.
Для приведенного выше случая растворения цинка в серной кислоте эта схема примет вид:
Zn++ — 20 4* mH20 —у Zn+ + * тН20 4* 20
20ан — у 20дат
20 4- 2Н+ . лН20 -—>- Н2 4- яН20
Цинк переходит в ионное состояние — корродирует, а на катоде выделяются молекулы водорода (из серной кислоты).
Из различных видов коррозии на практике чаще других встречается атмосферная (влажная) коррозия, которая и причиняет, как было указано, народному хозяйству большой ущерб. Атмосферная коррозия происходит вследствие тех же процессов, которые являются причиной коррозии электрохимической. Разница между этими двумя видами коррозии только количественная:
коррозия электрохимическая происходит вследствие действия сравнительно больших масс электролита, в который металл погружен, коррозия же атмосферная вызывается небольшими количествами электролита, покрывающего металл более или менее тонким слоем.
В большинстве случаев атмосферной коррозии слой электролита на поверхности металла появляется за счет влаги, содержащейся в атмосферном воздухе. Если — содержание водяных паров в воздухе невелико, то слой влаги на поверхности металла может появиться за счет адсорбции водяных паров ион-атомами, находящимися на поверхности металла. В этом случае толщийа слоя’ влаги мала. Адсорбированная влага содержит в себе растворенные агрессивные газы и увлеченные из воздуха частицы пыли, вследствие чего она является электролитом. Слой электролита может быстрее появиться на поверхности металла в случае более высокого содержания влаги в воздухе и особенно при содержании влаги, близком к насыщению. В этом случае для появления влаги на поверхности металла достаточно понижения температуры воздуха или металла. При этом воздух становится пересыщенным водяными парами, и часть их осаждается на поверхности металла в виде очень мелких капель, которые затем сливаются в более крупные и образуют сплошной слой электролита. Наконец, слой электролита может образоваться на поверхности металла и за счет выпадения атмосферных осадков, если металл не защищен от воздействия атмосферных реагентов. Атмосферные осадки также содержат растворенные агрессивные газы и пыль и поэтому являются электролитами, способными вызвать на поверхности металла коррозию (атмосферную).
 17 августа, 2015
17 августа, 2015  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 