Селективность адсорбции характеризуют коэффициентом разделения—отношением коэффициентов распределения разделяемых компонентов. Если коэффициент распределения компонента выразить через поверхностную А и объемную с концентрации
D=A/c (III.114)
То коэффициент разделения компонентов 1 и 2 будет равен
P. A=Di/D2=i4,cj/042CL) (III.115)
Коэффициент разделения показывает, во сколько раз различаются коэффициенты распределения разделяемых компонентов или во сколько раз отношение величин адсорбции разделяемых компонентов больше их отношения равновесных концентраций в объеме раствора.
Коэффициенты распределения и разделения не зависят от соотношения между количествами адсорбента (его поверхности) и раствора и поэтому не могут характеризовать распределение массы вещества между этими двумя фазами. Распределение массы вещества характеризуется степенью извлечения и степенью разделения. Степень извлечения есть отношение количества вещества в одной из равновесных фаз (в объеме раствора или в поверхностном слое) к общему его количеству. Например, для поверхностного (адсорбционного) слоя
Степень извлечения Е равна:
|
,4s — I- cV 1 f Ds/V |
— As Ds/V
=* ■ .1. H*,V (III.116)
Где і и V — соответственно площадь межфазной поверхности и объем раствора.
Степень извлечения выражается в долях и процентах.
Степень разделения, как и степень извлечения, может относиться или к фазе, в которую переходит вещество, или к фазе, из которой извлекается вещество. Она определяется отношением степеней извлечения разделяемых веществ. Например, в адсорбционном слое степень разделения Z равна:
Dlh+uls/V) (»F-117>
Из соотношения (III.117) следует вывод о том, что если D и D2 уменьшаются и стремятся к нулю, то степень разделения стремится к максимальному значению, равному коэффициенту разделения (выражения в скобках сокращаются). Такая же зависимость наблюдается, если уменьшать соотношение между массой адсорбента и объемом раствора (S==Syam, где т — масса адсорбента). Таким образом, чем меньше степень извлечения веществ, тем лучше их разделение в поверхностном слое, и тем хуже разделение в объеме раствора. В то же время увеличение степени извлечения компонентов ведет к ухудшению их разделения на адсорбенте.
Факторы, влияющие на селективность адсорбции, многочисленны, и основными из них являются сродство компонентов к поверхности адсорбента и к растворителю. Это следует, например, из уравнений для обменной адсорбции (III.102) и (Ш.103). Если константу обмена выразить через отношение
констант распределения компонентов (констант Генри), то после некоторого преобразования уравнения получим:
|
Pl/2 |
|
Кг2 |
|
Кг2 |
|
ViV2 |
KYi УгУі Кп
■Kv
(111.118)
Или lg Pv, = ig Kn — ‘g /Сг2+ lg АГт
Логарифмы констант распределения в свою очередь, как известно, пропорциональны разности между сродством компонента к адсорбенту и его сродством к растворителю. Таким образом, коэффициент разделения определяется сродством разделяемых компонентов к адсорбенту, к растворителю и соотношением между коэффициентом активности компонентов в объеме и поверхностном слое. Отсюда следует, что из двух растворимых компонентов преимущественно будет адсорбироваться тот, который имеет большее сродство к адсорбенту и меньшее— к растворителю. Эта зависимость может искажаться в связи с изменением коэффициентов активности при изменении состава раствора.
|
|
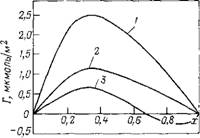
Сродство к адсорбенту определяется свойствами адсорбента и адсорбата. Степень влияния адсорбента на величину адсорбции определяется химической природой его поверхности н размером пор. Поверхность адсорбента может содержать функциональные группы, способные к специфическим взаимодействиям с адсорбатом, образованию водородных связей, диполь — дипольному взаимодействию и др. Соответственно вещества, более склонные к таким взаимодействиям, будут лучше адсорбироваться. В качестве примера на рис. III.17 представлены изотермы гиббсовской адсорбции бензола из растворов в «-гексане на различных адсорбентах. Как видно из рисунка
|
|
Рис. III.17. Изотермы гиббсовской адсорбции бензола из растворов в «-гексане на различных адсорбентах:
/—на силикагеле с гндроксилнрованной гюверхиостью: 2 — на силикагеле с сильно де — гидроксилированной поверхностью; 3 — на графитированной саже
Рис. III.18. Изотермы избирательной адсорбции органических веществ из водных растворов на активном угле КАД:
Ai—A2 — аинлин-нитроаиилни; 61-62 — фенол-аиилин
бензол лучше адсорбируется па гидроксилированной поверхности, так как проявляет к пей специфическое сродство, обусловленное л-взаимодействием. К дегидроксилированной поверхности, а также к графитированной саже это специфическое сродство не проявляется и бензол адсорбируется практически также, как н-гексан (предельный углеводород).
Для оценки адсорбируемости веществ широко используется правило уравнивания полярностей, предложенное П. А. Ре — биндером (1927 г.). Это правило заключается в том, что вещество может адсорбироваться на поверхности раздела фаз, если в результате его адсорбции будут уравниваться полярности этих фаз, т. е. по полярности это вещество должно занимать промежуточное положение между веществами, составляющими фазы. Это согласуется с тем, что из более полярной фазы на неполярной поверхности адсорбируется менее полярное вещество; чтобы оно вытеснялось и из менее полярной фазы, оно должно быть по сравнению с последней более полярным.
Хорошей иллюстрацией правила уравнивания полярностей является адсорбция органических соединений на углях. Изотермы адсорбции, представленные на рис. III. 18 отражают избирательность адсорбции органических веществ из водных растворов па активном угле КАД. По осям координат представлены молярные доли адсорбирующихся компонентов в растворе и на поверхности адсорбента без учета растворителя (воды), и поэтому получены зависимости, подобные уравнению (111,105). Из этой диаграммы видно, что путем адсорбции па активном угле КАД можно разделить анилин и нитроани — лин: анилин лучше адсорбируется на угле, а нитроанилин преимущественно остается в водной фазе (кривые Al и а2). Из системы анилин — фенол — вода анилин адсорбируется несколько хуже фенола, по их коэффициенты разделения небольшие. В результате избирательность адсорбции в этой системе мала (кривые 61 и 62). Это объясняется тем, что полярности фенола и анилина близки; в то же время полярность анилина значительно меньше, чем полярность нитроанилина, который поэтому сильнее удерживается водной фазой и меньше—неполярной поверхностью активного угля.
На избирательность адсорбции из растворов существенное влияние оказывает температура. Так как энтальпия смачивания отрицательна, то в соответствии с уравнением Вант-Гоффа сродство адсорбата к адсорбенту должно уменьшаться с повышением температуры, причем в бинарных растворах оно сильнее уменьшается для компонента, у которого больше отрицательная энтальпия смачивания (чистой адсорбции). Таким образом, с повышением температуры происходит выравнивание констант адсорбции компонентов и приближение кон — етанты обмена к единице, а величины гиббсовской адсорбции — к нулю, что приводит к ухудшению избирательности. Закономерности адсорбции из растворов существенно меняются при изменении растворимости в зависимости от температуры. С увеличением растворимости уменьшается константа распределения (в результате усиления взаимодействия с растворителем). В то же время если с повышением температуры растворимость растет, то появляется возможность увеличения концентрации в равновесном растворе и соответственно на поверхности адсорбента. Изменение растворимости при изменении температуры может привести к расслаиванию в порах адсорбента — к капиллярному расслаиванию.
 2 ноября, 2012
2 ноября, 2012  admin
admin 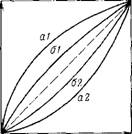
 Опубликовано в рубрике
Опубликовано в рубрике 