В эту группу хроматических пигментов входит большое число разнообразных по химическому составу и свойствам соединений. Общим для всех них является то, что они способны поглощать электромагнитное излучение в области длинноволновой части видимого спектра и поэтому имеют зеленый, синий и ‘фиолетовый цвета, называемые «холодными».
В состав описываемой группы входят пигменты, представляющие собой оксиды металлов, а также соли, в том числе комплексные и алюмосиликаты. Наибольшее значение из них имеют оксиды хрома зеленого цвета, железная лазурь (комплексная соль) и ультрамарин (алюмосиликат) синих цветов.
Среди других особый интерес представляют соединения на основе кобальта. Они имеют очень красивые чистые цвета (голубые, синие, зеленые, фиолетовые), однако из-за высокой стоимости применяются главным образом в художественных красках или для специальных целей.
Особую группу представляют зеленые пигменты, полученные смешением желтых и синих пигментов. Их и принято называть смешанными, или смесевыми. Подавляющее большинство лакокрасочных материалов зеленых цветов получены именно •на смеси желтых и синих пигментов.
■Оксиды хрома
Пигментный оксид хрома. По химическому составу этот пиг — "мент представляет собой оксид хрома Сгг03. Цвет — оливко- во-зеленый с оттенками от желтоватого до синеватого. Цвет и пигментные свойства зависят от условий получения.
Получают пигментный оксид хрома термическим (прокалоч- зшм) и комбинированным (осадочно-прокалочным) способами. Наибольшее распространение нашел термический с по-
соб, который заключается в восстановлении бихромата калия или натрия в присутствии серы, угля и солей аммония или гипса. Шихта, состоящая из перечисленных компонентов, готовится тщательным их смешением и затем прокаливается. При этом протекают следующие реакции:
К2Сг207 + S — Сг203 + K2S04;
К2Сг207 + 2С — Сг203 + К2С03 + СО;
К2Сг207 + 2NH jCI — Cr203 + 2KCI + 4Н20 + N2;
K2Cr207 + CaS04 — Cr203 + K2S04 + СаО + 1,5 02.
На цвет и пигментные свойства существенное влияние оказывает температура прокаливания. Так, при 600 °С получается темный пигментный оксид хрома с низкой укрывистостью. При повышении температуры до 800 °С свойства улучшаются, но оптимальные свойства пигмента достигаются проведением прокаливания при 900 °С. При дальнейшем повышении температуры свойства пигмента вновь ухудшаются. При температурах выше 700—800 °С оксид хрома частично сплавляется с образующимися при реакции восстановления солями (K2SO4, К2СО3), что приводит к ухудшению пигментных свойств. Поэтому обычно проводят двухступенчатое прокаливание. Вначале шихту прокаливают при 650—700 °С, измельчают, отмывают от водорастворимых солей и сушат. Второе прокаливание ведут уже при 700—800 °С. Затем продукт прокаливания вновь отмывают, сушат и измельчают.
|
Ппппп |
На рис. 5.19 показана технологическая схема описанного процесса получения пигментного оксида хрома.
|
|
|
Вода |
|
І Вакуум |
|
.10 |
|
11 |
Готовый продукт
_______
Рис. 5.19. Технологическая схема получения пигментного оксида хрома:
1, 3— шаровые мельницы; 2, 7 — печи; 4, 8 — аппараты для промывки; 5, 9 — фильтры; 6, 10 — сушилки; 11 — дезинтегратор
Шихта готовится в шаровой мельнице 1, откуда она поступает на первое прокаливание в печь 2. Продукт прокаливания затем измельчают в шаровой мельнице 3 и отмывают водой от водорастворимых примесей в аппарате 4. Отмытый, отфильтрованный на фильтре 5 н высушенный в сушилке 6 продукт прокаливают вторично в печи 7. Затем проводится дополнительная промывка пигмента в аппарате 8, фильтрация на фильтре 9 и сушка в сушилке 10. Измельчение проводится в дезинтеграторе П.
О с а д о ч н о-п рокалочный способ получения пигментного оксида хрома состоит в получении гидроксида хрома с последующей его дегидратацией. Гидроксид хрома можна 4і*,„ получать различными способами: осаждением солей трехва
Лентного хрома щелочами или восстановлением хроматов щелочных металлов в растворе. В последнем случае в качестве восстановителей могут использоваться органические соединения или сера.
Восстановление органическими соединениями (чаще всего мелассой) проводят при повышенной температуре (130— 135 °С) и давлении 0,2—0,25 МПа:
Na2Cr207 + 4Н20 +3RCOH-2Cr(OH)3 + 2NaOH + 3RCOOH.
При использовании в качестве восстановителя серы применяют щелочной раствор хромата натрия. К этому раствору добавляют суспензию серы, полученную ее размолом в части раствора хромата натрия. Процесс ведут при 102—103 °С:
4Na2Cr04 + 6S + 7Н20 -4СГ(ОН)3 + 3Na2S203 + 2NaOH.
Полученный осадок гидроксида хрома отмывают горячей водой и прокаливают при 800—850 °С:
2Сг(ОН)3- Сг203 + ЗН20.
Кроме этого основного процесса при прокаливании происходит взаимодействие части образовавшегося оксида хрома со Щелочью с образованием хроматов натрия. Поэтому после прокаливания продукт вновь отмывают и затем сушат и измельчают.
Как уже отмечалось выше, цвет пигментного оксида хрома может иметь желтоватый или синеватый оттенок, что зависит от условий прокаливания. Так, для получения пигмента с желтоватым оттенком необходимо, чтобы паста гидроксида хрома содержала около 5% гидроксида натрия. Прокаливание ведут при 780—800 °С. Для получения же пигмента с синеватым оттенком в пасту гидроксида хрома вводят 3%-ный раствор борной кислоты и прокаливание проводят при 970—1000 °С.
Плотность пигментного оксида хрома 5220 кг/м3; средний размер частиц 0,2—0,3 мкм; удельная поверхность 6—7 м2/г; укрывистость 8—12 г/м2; маслоемкость 18—25. Оксид хрома
Имеет высокие светостойкость, атмосферостойкость и стойкость к действию агрессивных газов. Он нерастворим во всех кислотах и щелочах. Легко окисляется расплавленными окислителями (нитратами, перхлоратами), воздухом в присутствии щелочей, а также горячими растворами некоторых окислителей.
Применяется пигментный оксид хрома для изготовления всех видов лококрасочных материалов, для художественных красок, для окраски пластмасс, изготовления денежных знаков и др.
Изумрудная зелень. Этот пигмент имеет очень красивый изумрудно-зеленый цвет. По химическому составу представляет собой гидроксид хрома Сг203-пН20, где п= 1,5—2,5. Большая часть воды — адсорбционная и может быть удалена без изменения цвета пигмента. Около одной трети воды является гидратной, и удаление ее приводит к разрушению пигмента с образованием Сг20з.
Получают пигмент термическим (прокалочным) способом и осаждением (восстановлением под давлением) из растворов бихромата натрия.
Наиболее широкое распространение получил первый способ. Он заключается в прокаливании смеси борной кислоты и дихромата натрия или калия при 550—600 °С:
4Н3В03 — Н2В407 + 5Н20;
К2Сг207 + Н2В407 — К2В407 + Н2Сг207;
2Н2Сг207 + 2Н20 — 2(Сг203-2Н20) + 302;
Сг203-2Н20 + Н2В407 — Сг203-Н20 + 2В203 + 2Н20.
Плав, полученный после прокаливания, обрабатывают ки — аіящей водой. При этом из него переходит в раствор пироборат калия, а в осадке остается изумрудная зелень. Осадок отмывают горячей водой почти до полного удаления борной кислоты, фильтруют, сушат и измельчают.
Цвет пигмента зависит от вида используемого сырья. Так, при использовании бихромата калия получается пигмент яркого цвета. При использовании же бихромата натрия, введении в шихту дополнительно алюмокалиевых квасцов и прокаливании при более высокой температуре (650—700 °С) цвет пигмента получается темный.
Второй способ получения изумрудной зелени заключается в восстановлении концентрированных растворов хроматов и бихроматов натрия органическими соединениями (мелассой) или водородом. Процесс ведут при 350—360 °С и давлении 35 МПа в установке непрерывного действия.
Изумрудная зелень светостойка и атмосферостойка, не чувствительна к действию агрессивных сернистых газов, не растворяется в кислотах и щелочах; термостойкость ее 200 °С.
Изумрудная зелень очень широко применяется для изготовления художественных красок, а также для получения некоторых эмалей.
Железная лазурь
Железная лазурь представляет собой смешанный ферроцианид. железа и щелочного металла (калия, натрия) или аммония. Химический состав лазури зависит от условий синтеза и может быть выражен формулой: Fe4[Fe(CN)s]3-*M. e4[Fe(CN)6] • •пН20, где х = 0,3—0,8. Содержание воды составляет 3—17%- Цвет лазури меняется от темно-синего (почти черного) до синего (иногда голубого) и может иметь красноватый («бронзя — щий») оттенок. Цвет и оттенок зависят от химического состава: лазури. Так, например, чем больше пигмент содержит калия и одновременно групп Fe(CN)64- и чем меньше воды, тем цвет светлее. При замене калия на натрий цвет становится тусклым,, а при замене калия на аммоний пропадает красноватый оттенок. Вообще красноватый оттенок больше характерен длят темных марок лазури.
Получение. Железную лазурь получают способом осаждения в две стадии. На первой стадии получают белый осадок, («белое тесто») при взаимодействии железного купороса с фер — роциаиидом калия:
2FeS04 +1,8K4Fe(CN)6 — Fe2[Fe(CN)6]-0,8K4Fe(CN)6 + 2K2S04.
Состав белого осадка непостоянен и зависит от соотношения исходных компонентов, температуры осаждения, концентрации и интенсивности перемешивания. Чем больше избыток FeS04 и выше температура осаждения, тем больше ферроцианида калия в осадке.
Белый осадок очень легко окисляется на воздухе с образованием лазури синего цвета:
6{Fe2[Fe(CN)6]-0,8K4Fe(CN)6] + 2KCI03 + 6H2S04 — — 3{Fe4[Fe(CN)6]3-0,6K4Fe(CN)6} + 2КС! + 2K2S04 + 6Н20.
На практике для перевода белого осадка в пигмент применяют окислители — бертолетову соль или бихромат калия. Перед окислением белый осадок подвергают термической обработке— кипячению. Эта операция является очень важной, поскольку от условий ее проведения зависят состав и свойства Белого осадка, а в дальнейшем — лазури. Чем больше продолжительность кипячения, тем больше ферроцианида калия содержится в белом осадке и тем светлее получается лазурь. Кипячение обычно проводят в кислой среде, что значительно повышает эффект термической обработки.
По окончании кипячения осадок охлаждают до 60—70 °С и добавляют раствор окислителя. При использовании в качестве окислителя бертолетовой соли окисление ведут при 60—70 °С, а при использовании бихромата калия — при 20—30 °С. В последнем случае лазурь обычно получается более светлого цвета.
По окончании процесса окисления лазурь отмывают от водорастворимых примесей. Эта операция очень трудоемкая, так как лазурь очень медленно оседает из водной суспензии. Для ускорения этого процесса добавляют поверхностно-активные вещества. Можно не производить отстаивания суспензии лазури, а сразу после репульпации фильтровать ее. Отмытую лазурь сушат и измельчают. Измельчение связано с пылением лазури, при этом лазурь может образовывать с воздухом взрывоопасные смеси.
Лазурь можно выпускать в виде пасты в растворе пленкообразующего вещества. В этом случае после фильтрации отмытой лазури к водной пасте добавляют пленкообразующее вещество и поверхностно-активные вещества и смесь перемешивают. Происходит процесс инверсии смачиваемости, т. е. частички лазури, первоначально смоченные водой, смачиваются пленкообразующим веществом. Вода, не совмещающаяся с последним, отделяется и удаляется в вакууме. Полученная пас та пигмента может непосредственно использоваться для изготовления красок и эмалей. При получении лазури в таком выпускном виде отпадают операции сушки и измельчения, связанные со значительным пылением.
На рис. 5.20 представлена технологическая схема получения железной лазури.
Растворы железного купороса н ферроцнанида калия готовят соответственно в аппаратах / и 2 и после очистки на фильтрах 7, 11 подаются в реактор 14. Полученный белый осадок окисляют бертолетовой солью, раствор которой готовят в аппарате 3. Для создания кислой среды в реактор заливают из мерника 16 хлороводородную (илн серную) кислоту. По окончании синтеза лазурь отмывают от водорастворимых примесей с применением системы листовых вакуум-фильтров 17 и репульпаторов 20. Отмытая лазурь из последнего фильтра попадает в бункер 18, а из него — в гребковую вакуум-сушилку 21. Высушенную лазурь шнеком 22 и элеватором 23 подают на измельчение в мельницу 25. Измельченную лазурь собирают в бункер 26, откуда она поступает на упаковку.
Свойства. Особенностью железной лазури является ее исключительно высокая степень дисперсности. Так, размер ее частиц может достигать величины 0,02—0,04 мкм. Удельная поверхность такой лазури около 110—120 м2/г. Степень дисПерсности лазури оказывает влияние на ее свойства. Напри-
Мер, лазурь тонкодисперсных марок имеет очень темный, почти черный цвет, а грубодисперсных — светло-синий цвет. Плотность лазури 1850—1920 кг/м3; укрывистость 10—20 г/м2; маслоемкость 40—58; интенсивность очень высокая (наивысшая среди неорганических пигментов).
Атмосферостойкость и светостойкость лазури хорошие. Однако в смеси с некоторыми пигментами она изменяет цвет при световом облучении. Так, в смеси с цинковыми белилами лазурь приобретает зеленый оттенок, что объясняется фотохимическими процессами, приводящими к образованию ферроциа — нида цинка. В присутствии диоксида титана лазурь обесцве* чивается, по-видимому, за счет фотохимического процесса ее восстановления. Светостойкость лазури в значительной степени зависит от типа пленкообразующего вещества, при этом наихудшие свойства оказываются в клеевых красках, а в масляных — наилучшие. Термостойкость лазури также зависит от типа пленкообразующего вещества и составляет 160—240°С.
Лазурь обладает стойкостью к действию слабых и средних кислот. Концентрированная серная кислота разрушает ее (особенно при кипении). Концентрированная хлороводородная кислота растворяет лазурь. Щелочи, даже очень слабые, также разлагают лазурь.
Если частично заменить в лазури Fe2+ на Со2+, Ni2+ или Мп2+, можно получить пигмент, стойкий к действию слабых щелочей.
Применение. Лазурь очень широко используют для изготовления красок и эмалей различного назначения, для производства полиграфических красок, красок для кожи, для изготовления цветных карандашей и др.
Ультрамарин
Ультрамарин представляет собой алюмосиликат натрия состава (Na20-Al203-/nSi02)*-Na2Sn, содержащий сульфиды и полисульфиды натрия. Ультрамарин может иметь синий, зеленый, фиолетовый и красный цвет. Наибольшее практическое применение находит синий ультрамарин. Для него т=2,5—3,0, П = 2—5, х = 2,5—3,0.
Получение. Ультрамарин получают термическим способом. В качестве сырья используются: каолин Al203-2Si02-2H20, инфузорная земля, сера и карбонат натрия. Ко всем этим веществам предъявляют особые требования. Например, все сырье должно быть сухим во избежание разложения образующихся полисульфидов натрия; сода по той же причине не должна содержать бикарбонатов; каолин и инфузорная земля не должны иметь примесей железа; сера не должна содержать мышьяка во избежание образования очень токсичного мышьяковистого водорода и т. д.
В качестве восстановителя к смеси перечисленных соединений добавляется каменноугольный пек или древесный уголь.
Все компоненты смеси тщательно измельчают, смешивают в необходимых соотношениях и подвергают совместному измельчению для гомогенизации.
Термическую обработку шихты проводят либо одностадийным методом, либо двухстадийным. По первому методу шихту помещают в специальные пористые тигли из шамота. В каждый такой тигель загружают 5—7 кг шихты. Тигли закрывают крышкой и устанавливают в печь рядами, один на другом.
Процесс термообработки (обжига) делится на три периода. Первый идет при повышении температуры в печи примерно до 450 °С без доступа воздуха в восстановительной среде. В этот период образуются сульфиды и полисульфиды натрия.
Второй период характеризуется реакцией между образовавшимися полисульфидами и каолином, в результате чего образуется зеленый ультрамарин.
Процесс протекает так же, как и на первой стадии, без доступа воздуха в восстановительной среде при повышении температуры до 725—780 °С и выдержке при этой температуре в течение нескольких часов.
Третий период обжига состоит в окислении зеленого ультрамарина с образованием синего продукта. На производстве этот период называется «томлением»; он протекает при охлаждении печи при доступе кислорода воздуха. Продолжительность «томления» 8—15 сут.
Одностадийный метод обжига шихты приводит к получению неоднородного продукта, так как температурный режим в печи неравномерный. Кроме того, этот метод отличается исключительной продолжительностью. Печь, в которой проводится обжиг, имеет низкий коэффициент полезного действия, поскольку много времени тратится на ее разогрев. Условия труда при проведении обжига по описанному методу очень тяжелые.
В настоящее время разработан двустадийный метод обжига шихты, который позволяет устранить перечисленные выше недостатки. Сущность метода состоит в раздельном получении зеленого и синего ультрамарина. Для каждой стадии используется специальное механизированное оборудование, на котором возможно при получении зеленого ультрамарина нагревать сравнительно небольшое количество шихты, а при получении синего — перемешивать продукт. Для первой стадии могут использоваться, например, шахтные Печи, а для второй — печи с мешалками. Продолжительность такого двуста — дийного метода 40—50 ч. Еще более эффективен непрерывный метод получения ультрамарина во вращающихся печах.
При любом способе термической обработки шихты получают ультрамарин-полуфабрикат, который требует дополнительной обработки — отмывки от водорастворимых примесей, сушки и измельчения.
На рис. 5.21 представлена технологическая схема получения ультрамарина.
Инфузорную землю сушат в барабанной сушилке 2, размалывают затем В шаровой мельнице 3 н подают на приготовление шихты в шаровую мельницу 4. Туда же добавляют сухой каолин, серу, карбонат натрня и каменноугольный пек. Обжнг полученной шихты производят в печи 7 н окисляют в печн 8. Ультрамарин-полуфабрикат отмывают водой методом репульпацнн с нспользованнем барабанных вакуум-фильтров 12 я 14 я репульпатора 13. Отфильтрованную пасту ультрамарина сушат в барабанной сушилке 15 н измельчают на мельнице 17. Для получения ультрамарина высших сортов пасту с вакуум-фнльтра 14 вновь репульпируют в репульпаторе 18 н прово — дят мокрый размол пигмента в шаровой мельнице 19, классифицируют в гидроцнклоне 21 и после коагуляции фильтруют на листовом вакуум-фильтре 23, затем сушат в гребковой вакуум-сушнлке 25.
Свойства. По своей структуре ультрамарин представляет объемную кристаллическую решетку алюмосиликата, построенную из оксидов алюминия и кремния. В междуузлиях этой решетки располагаются ионы натрия и серы. Цвет пигмента зависит от характера связи между натрием и серой. Так, считается, что в зеленом ультрамарине натрий и сера образуют дисульфид Na2S2, в синем — тетрасульфид Na2S4, а в фиолетовом и красном связи между натрием и серой нет.
Плотность ультрамарина 2200—2700 кг/м3, укрывистость его невысокая, антикоррозионными свойствами не обладает. Однако этот пигмент имеет очень высокую светостойкость и термостойкость до 500—600 °С. Дисперсионный состав ультрамарина колеблется в широких пределах — от 0,5 до 10 мкм. Однако даже для самых высокодисперсных сортов ультрамарина интенсивность гораздо меньше, чем у лазури. Интенсивность его зависит от химического состава — с увеличением содержания серы цвет становится насыщеннее, следовательно, интенсивность возрастает.
Ультрамарин стоек к действию слабых растворов щелочей, но разлагается с выделением H2S при действии разбавленных кислот.
Применение. Синий ультрамарин используют для изготовления клеевых, эмульсионных и известковых красок, для получения эмалей и художественных красок. Широко используется ультрамарин как добавка для придания ряду материалов белого цвета («нейтрализации» желтого оттенка), например краскам и эмалям, бумаге, сахару, текстилю и др. Применяется ультрамарин также для окрашивания пластмасс, линолеума и т. п.
Кобальтовые пигменты
Кобальт зеленый по химическому составу представляет собой твердый раствор оксида кобальта в оксиде цинка CoO-nZnO, где п составляет 15—50. Цвет пигмента от светло — до темно-зеленого и зависит от содержания оксида цинка — чем выше его содержание, тем светлее пигмент.
Получают кобальт зеленый при прокаливании смеси легко — диссоциирующих солей кобальта (сульфата, карбоната) с цинковыми белилами при 1000—1100 °С. Шихту для прокаливания, как правило, готовят мокрым смешением. Для этого цинковые белила размешивают с небольшим количеством воды, а затем добавляют раствор сульфата кобальта. В процессе смешения образуются основные соли типа Zn(OH)2-CoS04. Пасту, полученную после смешения, сушат, измельчают и прокаливают.
Zn(OH)2-CoS04 — ZnO + СоО + S03 + Н20;
СоО + пZnO — CoO-nZnO.
Продукт прокаливания измельчают, отмывают, сушат и вновь измельчают.
Кобальт зеленый обладает высокой свето-, атмосферо — и термостойкостью. Интенсивность его небольшая. В кипящей серной и хлороводородной кислотах растворяется, щелочи выщелачивают из пигмента оксид цинка.
Применяется кобальт зеленый для изготовления художественных красок разного типа, а также в производстве керамики, эмалей для термостойких покрытий, для окраски пластмасс и др. Из всех кобальтовых пигментов зеленый кобальт самый дешевый из-за низкого содержания оксида кобальта (<10%).
Кобальт синий представляет собой по химическому составу алюминат кобальта СоО-АІ2Оз. В состав пигмента для улучшения цвета обычно вводятся небольшие количества фосфата кобальта Со3(Р04)2 и кобальта зеленого CoO-nZnO. Иногда пигмент выпускается с повышенным содержанием А120з для улучшения его лессирующей способности.
Получают кобальт синий термическим (прокалочным) и комбинированным (осадочно-прокалочным) способами.
При термическом способе шихту готовят смешением тонко — измельченных оксидов и гидроксидов кобальта, алюминия и цинка или расплавлением солей алюминия в собственной кристаллизационной воде с последующим растворением в расплаве всех остальных компонентов смеси. Шихту подвергают прокаливанию при 1200—1300 °С. Продукт прокаливания измельчают, отмывают от водорастворимых примесей, сушат и снова измельчают.
Наиболее высокие пигментные свойства приобретает пигмент при о с а д о ч н о-п рокалочном способе получения. Вначале раствор, содержащий сульфат кобальта, алюмокалие — вые квасцы, сульфат цинка и двухзамещенный фосфат натрия {иди фосфорную кислоту), обрабатывают раствором соды для
Получения осадка. При этом протекают следующие реакции:
CoS04 + Na2C03 — С0СО3 + Na2S04;
2KA!(S04)2 + 3Na2C03 + 3H20 — 2A!(OH)3 + K2S04 +
+ 3Na2S04 + 3C02;
ZnS04 + Na2C03 — ZnC03 + Na2S04;
3CoS04 + 4Na2HP04 + 8H20 — Co3(P04)2-8H20 + 3Na2S04 +
+ 2NaH2P04.
Осадок тщательно отмывают от водорастворимых примесей, сушат и прокаливают при 1150—1200 °С. Образование пигмента протекает по схеме:
СоС03 + 2А1(ОН)3 — СоО А1203 + С02 + ЗпН20;
СоС03 + тZnC03 — CoO-mZnO + (т + 1)С02;
Со3(Р04)2-8Н20 — Со3(Р04)2 + 8Н20.
Полученный пигмент измельчают.
Плотность пигмента 4200—4400 кг/м3; интенсивность низкая; свето-, термо — и атмосферостойкость очень высокие. Кобальт синий не растворяется в кислотах, стоек к слабым щелочам. При действии кипящей концентрированной серной кислоты разлагается. Пигмент имеет высокую стоимость.
Применяют пигмент для изготовления художественных красок, термостойких эмалей, а также в керамической, стекольной промышленности и др.
Кобальт фиолетовый выпускается промышленностью двух типов: светлый, представляющий собой моногидрат фосфата кобальт-аммония CoNH4P04-H20, и темный — безводный фосфат кобальта Со3(Р04)2.
Кобальт фиолетовый светлый получают способом осаждения при взаимодействии сульфата кобальта с фосфатом аммония или смесью двухзамещенного фосфата аммония и аммиака:
C0SO4 + (NH4)2HP04 + NH40H — CoNH4P04.H20 + (NH4)2S04.
Выпавший осадок отмывают от водорастворимых солей, сушат при температуре не выше 40—50 °С и измельчают.
Кобальт фиолетовый темный получают осадочно-прокалоч- ным способом. На первой стадии получают осадок октагидра — та фосфата кобальта взаимодействием сульфата кобальта с фосфатом натрия в водной среде по реакции:
3CoS04 + 2Na3P04 + 8Н20 — Со3(Р04)2-8Н20 + 3Na2S04.
Полученный осадок отмывают от водорастворимых примесей, сушат и прокаливают при 800—900 °С для удаления кристаллизационной воды.
Продукт прокаливания измельчают, отмывают, сушат и Вновь измельчают.
Кобальт фиолетовый светлый обладает лессирующей способностью. Он растворяется в кислотах, разлагается щелочами. Светостойкость его относительно невелика. Особенностью пигмента является то, что он при нагревании уже при 100 °С заметно изменяет свой цвет, что связано с его разложением с выделением аммиака.
Применяется кобальт фиолетовый светлый для производства художественных красок и для изготовления термоиндикаторных красок.
Кобальт фиолетовый темный относится к полулессирующим пигментам. Он нерастворим в воде, растворяется в кислотах и разлагается щелочами, обладает свето-, атмосферо — и термостойкостью.
Применяется пигмент для изготовления художественных красок, а также для окраски пластмасс.
Смешанные зеленые пигменты
В лакокрасочной промышленности находят широкое применение так называемые смешанные зеленые пигменты, которые представляют собой механические смеси желтых и синих пигментов. Из желтых пигментов для получения смесей могут применяться почти все неорганические пигменты, но чаще всего используются свинцовые и цинковые крона. Из синих неорганических пигментов применяется лишь железная лазурь, обладающая исключительно высокой интенсивностью.
Свинцовая зелень представляет собой смесь желтого свинцового крона с лазурью. Цвет зелени зависит от соотношения желтого и синего пигментов в смеси и от цвета использованного крона. Например, чем больше лазури в смеси, тем темнее цвет свинцовой зелени. При применении желтых кронов получают зелени с оливковым оттенком, а при использовании лимонных кронов — с чисто-зеленым оттенком.
Получают свинцовые зелени тремя методами: смешением сухих порошков, смешением водных суспензий или паст пигментов и совместным осаждением.
Свойства свинцовых зеленей сочетают в себе свойства исходных компонентов. Так, светостойкость зеленей на основе кро — нов, полученных из нитратов свинца, больше, чем у зеленей? на основе кронов, полученных из ацетатов свинца. Свинцовые зелени обладают ярким насыщенным цветом, высокой укры — вистостью, атмосферостойкостью. Однако они чувствительны к. воздействию сернистых газов, в присутствии которых темнеют за счет образования черного сульфида свинца. Разрушаются пигменты и в присутствии даже разбавленных щелочей, так. как к ним очень чувствительна лазурь.
Существенным недостатком свинцовой зелени является ее склонность к расслаиванию в красках и в слое покрытия в Процессе его отверждения. Это обусловлено значительным различием физических свойств лазури и крона, главным образом плотности. В результате расслаивания покрытие приобретает пятнистый или полосатый вид. Уменьшению расслаивания способствует применение поверхностно-активных веществ, а также использование специальных методов синтеза.
Применяют свинцовые зелени для изготовления красок в эмалей самых различных типов. Кроме того, они используются В полиграфической промышленности, для окраски линолеума и др.
Цинковая зелень. По аналогии со свинцовой цинковой зеленью называют смесь цинкового крона и железной лазури.
Получают цинковую зелень так же, как и свинцовую.
В настоящее время смешанные зеленые пигменты как таковые утратили свое значение. Разработка и внедрение производства цветных лакокрасочных материалов способом однопиг — ментных паст (см. гл. 9) дают возможность получать эмали (краски) любых зеленых оттенков смешением желтых и синих паст на основе различных пигментов (неорганических и органических) желтых и синих цветов.
Прочие зеленые, синие и фиолетовые пигменты
Кроме рассмотренных выше пигментов зеленого, синего и фиолетового цветов известен еще целый ряд пигментов, которые выпускаются промышленностью по разным причинам в ограниченных количествах. Наибольший интерес из них представляют фосфат и титанат хрома, титанат кобальта, церулеум, медянка.’ и марганцовые пигменты.
 1 ноября, 2012
1 ноября, 2012  admin
admin 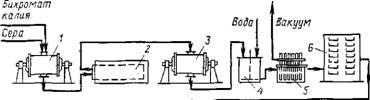
 Опубликовано в рубрике
Опубликовано в рубрике 