Важнейшим свойством пигментов является их кристалличность. В настоящее время установлено, что все частицы неорганических пигментов имеют кристаллическое строение.
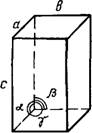
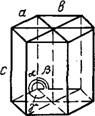
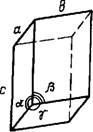
Кристалл — физическое тело, имеющее строгую трехмерную периодичность внутреннего строения. Иоиы, атомы и молекулы кристалла расположены в пространстве закономерно и образуют так называемую кристаллическую решетку. Она характеризуется трансляциями, т. е. определенными отрезками, перемещение иа которые в определенном направлении приводит к точному повторению первоначальной структуры. Трехмерная решетка имеет три главные трансляции (трансляционных вектора)—а, бис. Направления этих векторов можно использовать для обозначения осей кристалла.
Минимально возможный объем кристаллической решетки носит название Элементарной ячейки. Оиа представляет собой параллелепипед, построенный иа трех трансляциях. Форма элементарной ячейки определяется отношением ее ребер а, 6 и с и величинами углов а, р и к между ними.
Систематизация кристаллов основана иа особенностях их симметрии. Основными элементами симметрии являются следующие.
1. Центр симметрии (инверсии)—это точка в кристалле, характеризующаяся тем, что каждая проведенная через нее прямая с двух сторон иа равных расстояниях проходит через одинаковые точки.
2. Плоскость симметрии — это плоскость, делящая кристалл иа две части, каждая из которых является зеркальным отражением другой.
3. Ось симметрии — прямая, при повороте вокруг которой иа 360° кристалл совмещается сам с собой п раз. Число п называют порядком оси. Разделив 360° иа п, получают угол наименьшего поворота, при котором кристалл совмещается сам с собой.
Элементы симметрии могут проявляться в кристаллах отдельно или в различных комбинациях. Число комбинаций элементов симметрии, ие противоречащих принципу решетчатого строения кристаллов, составляет 32 группы,
Таблица 5.1. Кристаллографические системы (сингонии)
Элементарная ячейка
|
Система (Сингония) |
|
Пигмент |
|
Характеристика |
Геометрическая форма
|
Кубическая |
|
А=Ь—с «=£=4=90° |
Сульфид цинка ZnS (белый пигмент)
|
|
|
Тетрагональная |
|
А=ЬФс «=£=4=90° |
|
|
Диоксид титана ТЮг (белый пигмент). Оранжевый и красный свинцовый крои РЬСг04
|
Гексагональная |
|
А=ЬФс «=£= 90° 4=120° |
|
|
Ртутная киноварь hgS (красный пигмент)
|
Моноклинная |
|
А^ЬФс A=f=90° £=^90° |
Желтый свинцовый крои РЬСг04
|
|
Называемые классами, или видами симметрии. Все кристаллы, принадлежащие к одному классу, имеют одинаковые наборы элементов симметрии.
В зависимости от внешней формы и строения кристаллы делятся на кристаллографические системы, или сингонии (Син — Сходный, гония — угол). Всего существует семь кристаллографических систем которые сгруппированы по набору элементов симметрии в три категории: высшую, среднюю и низшую. К высшей категории относится только кубическая система. Кристаллы, входящие в нее, в наборе элементов симметрии имеют несколько осей симметрии высшего порядка (я>2). К средней категории относятся уже три системы — Тригональная (ромбоэдрическая), тетрагональная И гексагональная. Кристаллы этих систем имеют лишь по одной оси симметрии высшего порядка. К низшей категории относятся оставшиеся три системы— Триклинная, моноклинная и ромбическая. Кристаллы этих систем не имеют ни одной оси симметрии высшего порядка.
В табл. 5.1 приведены некоторые виды элементарных ячеек, их характеристики, а также примеры пигментов, кристаллизующихся в них.
Элементарные ячейки, приведенные в табл. 5.1, называют примитивными. Узлы в них располагаются только в вершинах многогранника. В сложных ячейках дополнительные узлы могут находиться еще и в их центре (объемно-центрированные ячейки), в центре каждой грани (гранецентрирован — ные ячейки) и в центре пары параллельных граней (базоцентрированные ячейки).
Для кристаллических решеток существуют и более сложные элементы симметрии. Они появляются при их комбинировании с трансляциями. Так, при комбинировании плоскости симметрии с трансляцией появляется так называемая плоскость скользящего отражения, а при комбинировании оси симметрии с трансляцией — винтовые оси.
Таким образом, даже из самых кратких сведений о строении кристаллов, приведенных выше, становится очевидным факт существования большого числа нх форм. Было установлено существование 230 пространственных групп симметрии, т. е. всех возможных комбинаций элементов симметрии, присущих пространственным решеткам.
Основой разделения кристаллов на главные физико-химические группы являются четыре типа химической связи. Различают ионные, ковалентные, металлические и молекулярные структуры. В некоторых случаях нельзя со всей определенностью указать тип связи, поскольку она носит промежуточный характер. Вследствие сосуществования в одном соединении различных типов связи трудно классифицировать структуры по химическим связям.
Примерами структур с однотипной химической связью могут служить кристаллы благородных газов (молекулярная связь), алмаза (ковалентная связь), хлорида натрия (ионная связь), золота (металлическая связь). Кристаллы графита могут служить примером структуры, характеризующейся связью, промежуточной между ковалентной и металлической. Структуры ■неорганических пигментов, обычно являющихся солями или оксидами, чаще всего характеризуются ковалентной или ионио-ковалентной связями. Молекулярная связь присуща кристаллической структуре органических пигментов.
Наиболее характерным признаком кристаллического состояния вещества является анизотропия — различие свойств по разным направлениям. Вследствие того что в структуре кристалла © разных направлениях различны расстояния и силы связи между частицами, почти все свойства кристалла различны в разных направлениях (но одинаковы в симметричных направлениях). Анизотропными являются электрические, магнитные, оптические, тепловые и прочностные свойства кристалла, а также скорость — роста кристалла.
Важнейшими особенностями кристаллического состояния являются полиморфизм и изоморфизм.
Полиморфизм — способность одного и того же вещества существовать в разных кристаллических формах. Полиморфные модификации различаются физическими свойствами, например твердостью, плотностью, цветом и т. п. Вещества, имеющие две •или три полиморфные модификации, называют диморфными или триморфными. Каждая полиморфная модификация является устойчивой фазой при соответствующих физико-химических условиях. Кристаллические модификации одного и того же вещества принято обозначать буквами греческого алфавита в порядке •повышения температуры стабильного состояния данной модификации: например, а-РЬО и р-РЬО или а-ZnS и p-ZnS. Для обозначения модификаций пигментов чаще всего пользуются исторически сложившимися названиями. Так, для приведенных выше пигментов это соответственно глет и массикот или сфалерит и ■вюртцит.
Переход одной полиморфной модификации в другую называется полиморфным превращением. Он происходит при определенных температуре и давлении, а каждому фазовому превращению такого рода обычно сопутствует изменение свойств кристалла. Кроме того, полиморфный переход связан с поглощением или выделением тепла.
Процесс перехода одной полиморфной модификации в другую бывает «обратимым и необратимым. Примером перехода первого типа может служить шревращение алмаза в графит, второго — превращения сфалерита (a-ZnS) в вюртцит (fJ-ZnS) или глета (а-РЬО) в массикот (fi-PbO). Полиморфные превращения, как правило, требуют значительной энергии активации. Это — приводит к возможности существования метастабильных кристаллических, структур, т. е. относительно устойчивых, но термодинамически неравновесных. Образование таких структур возможно, например, в случае переохлаждения — (или перегрева) системы вблизи температуры полиморфного превращения. Так, при нагревании сфалерита при 700 °С он превращается в вюртцит. При> медленном охлаждении протекает обратный процесс. В том случае, когда вюртцит быстро охлаждают погружением в холодную воду, он сохраняет свою структуру.
Кристаллы, имеющие один и тот же тип структуры, называются изоструктурными. Это могут быть совершенно различные по химическому составу вещества. Например, к одному типу кристаллической структуры относятся КОН, AgCl, BaS и MgO. Если вещества кроме одинаковой кристаллической структуры обладают еще подобием химической формулы (идентичным химическим строением), они называются изоморфными. В качестве — примера можно привести РЬСг04, PbS04, BaS04 и КМПО4. Изоморфизм проявляется в способности различных соединений образовывать изоморфные смеси — кристаллические твердые растворы (смешанные кристаллы). Такие растворы являются гомогенными смесями двух или более веществ, находящихся в кристаллическом состоянии.
По способу заполнения позиций в кристаллической решетке различают три основных вида твердых растворов:
Твердые растворы замещения, в которых атомы или ионы одного- элемента замещаются в кристаллической структуре атомами или ионами другого элемента;
Твердые растворы внедрения, в которых атомы, ионы или молекулы растворенных веществ занимают свободные места (например, междууз — лия) в кристаллической решетке растворителя;
Твердые растворы вычитания, в которых в процессе образования смешанных кристаллов остаются незаполненными структурные позиции атомов или ионов.
Кроме описанных выше изоморфных структур существуют еще так называемые частично изоморфные системы, которые как, бы образованы из многочисленных очень тонких чередующихся, слоев двух различных веществ.
Внешний вид, структура и физические свойства кристаллов; могут закономерно изменяться в зависимости от химического состава. Эти изменения, происходящие в результате замены в структуре одного иона другим, называются морфотропными.
Описанные выше явления морфотропии, изоморфизма и полиморфизма теснейшим образом связаны между собой.
Изучение кристаллических структур проводится чаще всего — двумя методами: рентгеноструктурным анализом, основанном дифракции рентгеновских лучей кристаллической решеткой вещества, и электронографическим анализом, основанном на дифракции электронов или нейтронов. Используя эти методы, было установлено, что реально существующие кристаллы имеют отличия от рассмотренных выше идеальных. В реальных кристаллах строгая пространственная периодичность нарушается из-за наличия дефектов кристаллической структуры.
Многие свойства кристаллических тел объясняются наличием таких дефектов. Последние могут быть собственными, если они образуются вследствие теплового движения в кристалле, или примесными, если в кристалле появляются посторонние примеси случайно или преднамеренно. Дефекты могут затрагивать одну или несколько элементарных ячеек или весь кристалл в целом. В устойчивом состоянии структурные элементы кристаллов совершают тепловые колебания около узлов кристаллической решетки. При этом электроны располагаются на наииизших из возможных энергетических уровнях. В результате теплового воздействия или облучения светом определенное число электронов переходит на более высокие энергетические уровни; при этом они приобретают возможность передвигаться по кристаллу. Этим явлением обусловлена электропроводность многих твердых тел, являющихся в обычных условиях диэлектриками. Вакантное место, возникшее в системе после удаления электрона, образует дефект, который носит название положительной дырки (или просто дырки). Такие дефекты характерны для молекулярных и атомных кристаллов.
В ионных кристаллах электроны локализованы на определенных ионах. Однако и в этом случае возможно наличие в них описанных дефектов. Это происходит в том случае, когда в решетке присутствуют катионы одного и того же элемента, но в разных валентных состояниях (характерно для соединений переходных элементов). Присутствие в узле кристаллической решетки катиона с большей валентностью, чем в других узлах, равноценно положительной дырке. В этом случае электрон может перейти с катиона меньшей валентности на рядом расположенный катион большей валентности.
В результате теплового воздействия некоторые атомы или ионы могут покидать свои места в узлах решетки и образовывать дефекты, называемые Вакансиями. Атомы или ионы («собственные» и «чужие») также могут появиться между узлами кристаллической решетки. В ионном кристалле (в отличие от атомного) вакансии должны быть обязательно скомпенсированы электрически. Комбинация вакансии и иона в междуузлиях называется Дефектом по Френкелю, а комбинация анионной и катионной вакансий — Дефектом по Шоттки. Дефекты по Френкелю и Шоттки относятся к так называемым точечным дефектам. Эти дефекты могут мигрировать в кристалле, чем объясняется самодиффузия и ионная проводимость. Наличие примесных атомов или ионов в структуре сильно влияет на физические и механические свойства кристаллов. Так, например, при добавлении 20% КВг к КС1 теплопроводность снижается на 50%. Добавление к железу 1% Ni, Мп или Сг приводит к повышению его твердости соответственно на ‘/го, ‘/в и ‘/«. Примесные атомы или ионы поглощают свет в тех областях, где чистый кристалл прозрачен, что может влиять на его цвет. В некоторых случаях возбуждается люминесценция.
Кроме рассмотренных выше для кристаллов характерны линейные дефекты (дислокации), когда смещается целый ряд атомов. Такие дефекты возникают под действием механических и термических факторов, а также в процессе роста кристаллов. Дислокация может быть краевой, когда в кристалле появляется дополнительная неполная плоскость, и винтовой, когда вокруг линии дислокации образуется наклонная плоскость в виде спирали. При деформациях кристаллов дислокации и их скопления могут перерастать в ультрамикротрещины, наличие которых преимущественно и определяет прочность кристалла.
Многие структурные дефекты представляют собой атомные плоскости шли, чаще, поверхности. Проявлением таких дефектов является наличие зерен и границ зерен в поликристаллическом материале. Слой атомов на границе между зернами представляет собой область нарушенной решетки (аморфи — зация поверхности). Зерна обычно не соответствуют по форме и структуре кристаллу. Они ограничены поверхностями, которые имеют случайную форму. При повышении температуры подвижность атомов возрастает, и некоторые зерна начинают расти за счет других. Особенности такой блочной структуры оказывают влияние на механические свойства твердого тела и некоторые другие его свойства, например реакционную способность. Так, материал на границах зерен характеризуется большей реакционной способностью, а иногда даже отличается от самих зереи по химическому составу вследствие увеличения или уменьшения концентрации примесей в этой области. Блоч — ность (или мозаичность) строения поверхности вещества сказывается также на его адсорбционных свойствах.
 1 ноября, 2012
1 ноября, 2012  admin
admin 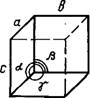
 Опубликовано в рубрике
Опубликовано в рубрике 