Взаимодействие фенола с формальдегидом происходит в щелочной и кислой средах при температуре 50 °С:
ОН ОН
(6+сн2°^и 20Н
При этом присоединение формальдегида возможно только в Юрто- и пара-положения. Одна молекула фенола способна при
соединить до трех молекул формальдегида с образованием три — метилолфенола:
|
|
СНгОН
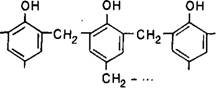
Монометилолфенолы при поликонденсации образуют полимеры линейного строения, являющиеся термопластичными полимерами:
—— j^jj-CH2OH
|
Он |
|
ОН |
|
|
|
TJCHr |
П-2
Термореактивные полимеры сетчатого строения могут быть получены только в присутствии триметилолфенола. Строение молекулы такого полимера может быть представлено следующим образом: _
|
Сн2он |
|
Сн2он |
|
Нон2с |
|
С Н 2 ~ О ~ С ^2~fT С Н 2 О Н V |
СН о —
Было отмечено также, что с увеличением кислотности реакционной массы возрастает доля замещения в пара-положение фенола. В качестве катализаторов чаще всего используют щавелевую, соляную, серную и фосфорную кислоты.
Термореактивные резолы получают в щелочной среде. Образующиеся при этом моно-, ди — и триметилолфенолы достаточно стабильны и могут быть выделены как самостоятельные соединения. Взаимодействие фенолоопиртов в щелочной среде происходит медленно и при повышенных температурах (до 60°С). Поэтому процесс можно остановить практически на любой стадии поликонденсации и получить олигомер с хорошей растворимостью при избытке формальдегида (экзотермический эффект реакции 58 кДж/моль фенола).
В качестве катализаторов для получения резолов используют гидроксиды натрия, кальция, магния, бария, аммиак и гек- саметилентетрамин (ГМТА). При применении гидроксидов металлов наблюдается следующая закономерность: доля орто-Изо-
меров возрастает в ряду используемых гидроксидов: Na<Ba<C <Ca<Mg. Синтез фенолоформальдегидных олигомеров с высоким содержанием орто-замещенных фенолов имеет большое значение для получения быстроотверждающихся материалов.
Резолы, получаемые при катализе аммиаком, резко отличаются от других резолов. Присутствие азометиновых групп (—CH=N—) придает олиго — меру характерный желтый цвет.
При взаимодействии фенола, формальдегида и аммиака образуются олигомеры, содержащие звенья дибензиламина и трибензиламина:
TOC o "1-3" h z ОН ОН
СН2 — NH — CH2-|^jJ-CH2OH
Дибензиламин ОН ОН
— СН2 — N — СН2-
СН2 СН2ОН Jv
LjL СН2ОН
ОН
Трибензиламин
![]()
![]()
![]()
|
СН2ОН |
При использовании в качестве катализатора ГМТА происходит его» гидролиз в реакционной массе с образованием аминоспиртов, способных взаимодействовать с фенолом:
|
N Сн2 |
|
NH2 СН2ОН I I > СН2 + NH I I Nh2 СН2ОН |
|
Сн2 |
|
Н2с |
|
Н20 |
|
.СН2 H2Cn |
Вследствие этого в качестве взаимозаменяемых катализаторов, обеспечивающих достижение одинаковых конечных результатов, могут быть использованы как ГМТА, так и эквивалентное количество аммиака.
|
81 |
Фенолоформальдегидные олигомеры можно получать также при взаимодействии формальдегида с различными замещенными фенолами.
6—134
|
Таблица 2.2. Свойства основных материалов, используемых для получения
|
|
* Приведены значения соответственно для о-, м- и «-крезола. |
Свойства основных материалов для синтеза фенолоформаль — дегидных олигомеров приведены в табл. 2.2.
Реакционная способность фенолов по отношению к формальдегиду зависит от структуры фенолов. Например, фенол, ж-крезол, 3,5-ксиленол и резорцин являются трех функциональными; о-крезол, «-крезол, 2,5- и 3,4-ксилено — лы, п-грег-бутилфенол — бифункциональными.
При использовании бифункциональных фенолов образуются линейные ■олигомеры. Для получения разветвленных структур применяют смеси трех — функционального фенола с фенолами более низкой функциональности.
Природа и положение заместителя оказывают большое влияние на реакционную способность фенола. Например, о-крезол реагирует с формальдегидом в 0,76 раза медленнее фенола, а ж-крезол — в 2,28 раза быстрее; 3,5-ксиленол — в 7,75 раза быстрее фенола.
Формальдегид представляет собой газообразное вещество. В промышленности он обычно применяется в виде водного раствора 37%-ной концентрации, называемого формалином. Формальдегид в растворе склонен к полимеризации с образованием полиоксиметиленгликолей (параформа), выпадающих в осадок:
Н2о + псн2о Но-[-сн2-о-]п-н,
Где п колеблется от 12 до 100.
Для стабилизации формалина в него вводят 8—15% метанола. Кроме того, в формалине содержится около 0,15% муравьиной кислоты, образующейся при его получении.
 1 ноября, 2012
1 ноября, 2012  admin
admin 
 Опубликовано в рубрике
Опубликовано в рубрике 