Стабилизующее действие ПАВ определяется их способностью адсорбироваться на межфазной поверхности. Вследствие высокой поверхностной активности концентрация ПАВ в поверхностном слое в десятки тысяч раз превышает объемную концентрацию. В адсорбционных пленках, так же как и в мицеллах ПАВ, происходит ассоциация неполярных групп. Строение адсорбционного слоя зависит от природы ПАВ и межфазной поверхности, степенй заполнения поверхности, введения в среду различных добавок. Изменение строения адсорбционного слоя отражается на его защитных свойствах.
Адсорбционные слои ПАВ лиофйлизируют, а в водных растворах гидрофилнзируют поверхность, вследствие чего при сближе
нии частиц развиваются силы отталкивания. Для ионогенных; ПАВ — это электростатическое отталкивание двойных электрических слоев, которое описывается рассмотренной в гл. IX теорией ДЛФО. Для неионогенных ПАВ электростатическое отталкивание, как правило, не играет роли; вопрос о стабилизации дисперсных, систем этими веществами является одной из нерешенных проблем коллоидной химии.
Наиболее перспективными кажутся следующие представления, развиваемые как для неионогенных ПАВ, так и для адсорбционных слоев полимеров
При сближении частиц на расстояние меньшее, чем удвоенная толщина адсорбционного слоя, происходит перекрытие (взаимопроникновение) адсорбционных слоев, и концентрация НПАВ в области перекрытия увеличивается по сравнению с ее значением в адсорбционном слое При этом, если среда представляет собой хороший растворитель для вещества, образующего адсорбционный слой, возникает осмотическое давление, подобное давлению набухания (рис XIII, 6). Это обуславливает приток жидкости из объема раствора в область перекрытия адсорбционных слоев и возникновение расклинивающего давления. Осмотическое давление, в зависимости от природы взаимодействия НПАВ и растворителя, может быть функцией изменения энтропии или изменения энтальрии системы в области перекрытия. В первом случае падение энтропии определяется тем, что в области перекрытия уменьшается число конформаций гибких цепей стабилизатора, что в конечном счете вызывает повышение агрегативной устойчивости. Во втором случае в области перекрытия некоторые контакты между молекулами воды и полярными группами НПАВ заменяются контактами между молекулами НПАВ, т е происходит дегидратация адсорбционного слоя Это приводит к возрастанию энтальпии системы, вызывает отталкивание, т. е также повышает агрегативную устойчивость системы
На основании представлений о роли осмотических сил в стабилизации дисперсных систем немецким ученым Фишером было предложено уравнение, позволяющее рассчитать энергию отталкивания U0См при сближении частиц на расстояние меньше чем 26:
Uocu~2BNAc*V-6kT (XIII, 1>
Где В — коэффициент, характеризующий взаимодействие молекул растворяемого вещества с растворителем, NA — число Авогадро, с — концентрация НПАВ в межфазиом слое; V{, — объем области перекрытия, который можно рассчитать,, если известен радиус частиц, толщина адсорбционного слоя б НПАВ и расстояние между частицами
|
Рис. XIII, 6. Схема, иллюстрирующая взаимодействие адсорбционных слоев неионогенных ПАВ. Г —радиус частиц; б—толщина адсорбционного слоя, Я — расстояние — между частицами. |
Как видно из уравнения (XIII, 1), энергия отталкивания тем больше, чем выше концентрация адсорбтива в межфазном слое. Она возрастает также с увеличением объема области перекрытия. Кроме того, энергия отталкивания зависит от знака и значения коэффициента В. В хороших растворителях, когда В > 0, возникает положительное расклинивающее давление, стабилизующее систему. Если среда является плохим растворителем для вещества,, образующего адсорбционный слой, то В < 0 и расклинивающее-
давление отрицательно, т. е. среда вытекает из области перекрытия. В этом случае осмотический эффект, наряду с силами межмолекулярного притяжения, способствует агрегации частиц. Наконец, при 6 = 0 энергия отталкивания равна нулю.
Следует иметь в виду, что адсорбционные слои, даже при отсутствии взаимодействия с растворителем при В ^ 0, представляют собой стерический барьер, препятствующий сближению частиц на достаточно малые расстояния, при которых существенную роль начинают играть силы межмолекулярного притяжения. Конечно, эффективная стерическая стабилизация осуществляется лишь тогда, когда адсорбционные слои насыщены, а образующие их молекулы не способны десорбироваться при соударениях частиц. Для таких стерически стабилизованных систем невозможна коагуляция с непосредственным контактом частиц, а возможна лишь дальняя агрегация.
 1 ноября, 2012
1 ноября, 2012  admin
admin 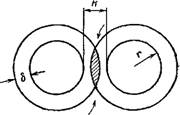
 Опубликовано в рубрике
Опубликовано в рубрике 