Приведенные выше правила коагуляции золей охватывают в основном все характерные ее особенности. Ознакомимся теперь с тем, как могут быть истолкованы явления, наблюдаемые при коагуляции электролитами.
Авторами предлагались различные теории коагуляции электролитами. Сюда относятся химическая теория коагуляции (Дюкло), адсорбционная теория (Фрейндлих), электростатическая теория.(Мюллер, А. И. Рабинович, В. А. Каргин). Однако все они по тем илн иным причинам утратили свое значение и представляют сейчас только исторический интерес[21]. В настоящее время общепризнанной является физическая теория коагуляции электролитами, базирующаяся на общих принципах статистической физики, теории растворов и теории действия молекулярных сил. Физическая теория
коагуляции электролитами строится на рассмотрении баланса молекулярных сил притяжения и сил ионно-электростатического отталкивания, действующих между частицами, как это было изложено на примере взаимодействия пластинчатых частиц во втором разделе главы.
|
Рнс. IX, 10. Потенциальные кривые, характеризующие изменение энергии взаимодействия двух коллоидных частиц от расстояния Я между нх поверхностями. Нумерация кривых возрастает с уменьшением’ Фо-потенциала, |
Впервые качественный подход к изучению устойчивости золей наметили Кальман и Вильштеттер в 1932 г. Первые количественные расчеты были произведены Б. В. Дерягиным в конце 30-х годов и затем завершены в работе Б. В. Дерягина и J1. Д. Ландау,(1941 г.). Аналогичный подход к изучению устойчивости коллоидных систем в дальнейшем был развит и в работах голландских исследователей Фервея и Овербека. По начальным буквам основных авторов возникшей физической теории коагуляции эту теорию теперь часто называют теорией ДЛФО.
При рассмотрении коагуляции коллоидных систем следует различать два предельных случая:
1) нейтрализационную коагуляцию, когда потеря устойчивости происходит в результате разряжения коллоидных частиц и уменьшения их фо-потенциала [22];
2) концентрационную коагуляцию, при которой потеря устойчивости связана не с падением фо-потенциала, а вызвана сжатием диффузного двойного слоя.
Рассмотрим эти два типа коагуляции несколько подробнее.
Нейтрализационная коагуляция наблюдается у золей со слабо заряженными частицами, обладающими сравнительно низкими значениями фо-потенциала. В этом случае коагуляция происходит обычно у золей при снижении электрического заряда частиц из-за уменьшения вследствие тех или иных причин адсорбции потенциалопределяющих ионов. В результате уменьшения заряда электрические силы отталкивания между частицами ослабевают, частицы при сближении слипаются и выпадают в осадок.
Теория, развитая Б. В. Дерягиным, позволяет вычислить, при каком достаточно низком значении фо-потенциала должен исчезнуть энергетический барьер, т. е. когда результирующая потенциальная кривая (рис. IX, 10), характеризующая зависимость энергии взаимодействия частиц от расстояния между ними, должна только в одной точке коснуться оси абсцисс (пунктирная кривая). При достаточно малом ф0-потенциале связь между кри
тическим потенциалом фо, Крит, при котором энергетический барьер исчезает, и толщиной 1/и (или h) диффузных слоев, окружающих обе коллоидные частицы, выражается формулой:
Где С — константа; А — постоянная притяжения; е — диэлектрическая проницаемость раствора.
Связь между фо, крит и и, вытекающая из уравнения (IX, 42), была эмпирически установлена Эйлерсом и Корфом еще в 1940 г. Согласно этим исследователям
Ф2/г = В — (IX, 43)
Где В — некоторая критическая величина, определяемая из опыта.
Условие фH < В представляет собой условие коагуляции, а фд/г > В является условием устойчивости системы.
Для достаточно разбавленных растворов электролитов, когда толщина диффузного слоя велика, и для малых значений фо-потен — циала можно принять, что этот потенциал довольно близок к ^-потенциалу, измеренному по подвижности частиц в электрическом
|
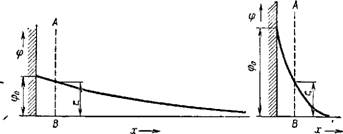
Рис. IX, П. Схема, выражающая зависимость ф0 и ^-потенциалов для слабо заряженных частиц в разбавленном растворе электролита (а) и для сильно заряженных частиц в достаточно концентрированном растворе электролита (б). |
Поле (рис. IX, 11а). Надо, однако, подчеркнуть, что отождествление общего скачка потенциала фо или потенциала Штерна ф6, отвечающего границе ионный конденсатор — диффузный слой, и £-по — тенциала, вообще говоря, незаконно и в ряде случаев может приводить к неправильным результатам. В самом деле, определение ^-потенциала связано с гидродинамическими особенностями системы, а именно, с положением границы скольжения у поверхности раздела частица — раствор или вязкостью прилегающих к ней слоев жидкости, тогда как потенциалы ф0 и ф6, очевидно, никакого
отношения к этим особенностям не имеют. Использование £-потен — циала как критерия устойчивости коллоидных систем связано в основном с тем, что ^-потенциал сравнительно легко экспериментально измерить и в определенных условиях его изменение сходно с изменением фо-потенциала.
Концентрационная коагуляция наблюдается обычно у золей с сильно заряженными частицами при увеличении концентрации индифферентного электролита в системе. Это обстоятельство позволяет в первом приближении вовсе не учитывать возможное изменение фо-потенциала при различного рода адсорбционных или десорбционных явлениях. Единственной причиной коагуляции системы в эхом случае является, согласно теории ДЛФО, чисто электростатический эффект сжатия двойного электрического слоя.
В предельном случае потенциал поверхности — фо-потенциал — при коагуляции может сохранять достаточно высокие значения (более 100 мВ). При этом соответствие между £-ротенциалом, который при увеличении концентрации раствора электролита может значительно падать, и фо-потенциалом теряется. Это легко понять из схемы, представленнной на рис. IX, 116. Теряется также связь между устойчивостью системы и фо — и ^-потенциалами. Таким образом, становится понятным, почему ^-потенциал далеко не всегда может являться критерием устойчивости золя.
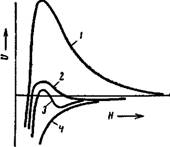
Для того чтобы понять механизм концентрационной коагуляции, необходимо остановиться на весьма важной особенности — зависимости сил электростатического взаимодействия от фо-потенциала, рассмотренного ранее на примере двух пластинок. Теория показывает, что по мере безграничного возрастания ф0-по? енциала обеих поверхностей сила электростатического отталкивания F3 между коллоидными частицами любой формы не возрастает безгранично, а стремится к ^конечному пределу, подходя к нему уже прн значениях потенциала поверхности, превышающих 100 мВ (рис. IX, 12). Вследствие этого свойства, как бы насыщения сил, можно говорить о силе взаимодействия предельно заряженных поверхностей как о величине, не зависящей от точных значений потенциала поверхности.
Этот на первый взгляд трудно понятный вывод объясняется, как мы видели, тем, что по мере роста фо-потенциала увеличивается притяжение противоионов тс поверхности частицы. Таким образом, параллельно с ростом заряда внутренней обкладки двойного электрического слоя и потенциала поверхности усиливается и экранирование внешнего поля этой обкладки противоионами. Поэтому дальнейший рост напряженности электрического поля в периферийных частях ианных атмосфер и сил взаимодействия обеих частиц прекращается. Таким образом, если коллоидные частицы заряжены достаточно сильно, то их взаимодействие зависит только от заряда противоионов, экранирующих действие внутренней обкладки двойного слоя и обусловливающих его толщину.
При прибавлении к системе индифферентного электролита происходит сжатие диффузной части двойного электрического слоя и толщина ионных атмосфер уменьшается. Одновременно также в результате сжатия ионного слоя увеличивается глубина вторичного потенциального минимума, что приводит к возрастанию вероятности дальней агрегации. Изменение формы потенциальных кривых парного взаимодействия частиц при увеличении содержания индифферентных электролитов в системе показано на рис. IX, 13.
Теоретические расчеты позволили Б. В. Дерягину и Л. Д. Ландау установить, что энергетический барьер на диаграмме энергия
|
Рис. IX, 13. Изменение вида результирующих кривых, характеризующих парное взаимодействие частиц, при увеличении содержания электролита. Нумерация кривых возрастает с уменьшением Фг-потенциала. |
|
Рис. IX, 12. Зависимость электростатической силы отталкивания F3 между двумя коллоидными частицами от потенциала <р0 их поверхности. |
|
<р0,мВ- |
Взаимодеиствия — расстояние между коллоидными частицами исчезает, когда достигнут порог. коагуляции у, определяемый по формуле:
‘Y = cJS?’4 (1Х’44)
Где С — константа, слабо зависящая от асимметрии электролита, т. е. от отношения числа зарядов катиона и аниона; е — заряд электрона; г — валентность про — тивоиоиа.
Порог концентрационной коагуляции, как и следовало ожидать, не зависит от фо-потенциала, но зависит от значения постоянной/!, диэлектрической проницаемости е раствора, температуры Т и_ва — лентности Z иротивоиона. Ион, заряженный одноименно с коллоид-" ной частицей, на коагуляцию оказывает малое влияние, несколько изменяя лишь значение коэффициента С.
Из уравнения (IX,44) следует также, что значения порога коагуляции для одно-, двух-, трех — и четырехвалентных ионов должны относиться, как
1:(72)в:(7з)в:(7Лв или как 1:0,016:0,0013 : 0,00024
В некоторых случаях этот ряд в первом приближении согласуется с опытными данными, получившими свое выражение в правиле Шульце — Гарди, и как будто дает его теоретическое обоснование.
Ниже приведены собранные Овербеком средние значения порогов коагуляции — (в ммоль/л) некоторых золей, заимствованные из ряда исследований Как можно видеть, отношения экспериментально определенных порогов коагуляции ионами различной валентности (I, II, III, IV) довольно хорошо совпадают с теоретически рассчитанными данными (особенно для коагуляции одно — и двухвалентными ионами).
Золи с отрицательно заряженными частицами
Порог коагуляции у золя
AS2S3…………………………………..
Соотношение………………………….
Порог коагуляции у золя Аи
Соот гашение………………………….
Порог коагуляции у золя Agl Соотношение
Золи с положительно
Порог коагуляции у золя
Fe203 ………………………………….
Соотношение…………………………..
Порогу коагуляции у 30ля
А120з…………………………………..
Соотношение…………………………..
|
Валеніность иона
|
|
Заряженными частицами Валентность иона I II III IV
|
Наблюдающиеся отклонения можно объяснить следующими обстоятельствами.
Во-первых, опыты по определению порогов коагуляции проводились в различных условиях. Между тем на результаты определения порогов коагуляции могут влиять малейшие, порой даже трудно учитываемые воздействия Кроме того, есть все основания полагать, что золи, с которыми проводили эксперименты различные авторы, даже если они имели одну и ту же природу, обладали разной дисперсностью и другими неодинаковыми характеристиками, сказавшимися на результатах определения порогов коагуляции.
Во-вторых, при определении порога коагуляции обычно берут то количеств» электролита, которое нужно для коагуляции еще не полностью астабилизоваи — ного золя. Однако остается неизвестным, в каком соотношении находятся найденные таким образом значения порога коагуляции к значениям концентрации» соответствующим коагуляции полностью астабилизоваиного золя, причем для различных электролитов это соотношение может быть не одинаковым.
В-третьих, фактически найденная концентрация электролита при коагуляции может значительно отличаться от концентрации, определяемой путем расчета, вследствие ионного обмена, в особенности когда порог коагуляции низок.
Однако в последнее время получены экспериментальные данные, которые указывают на иеприложимость в ряде случаев правила Шульце — Гарди в виде закона Дерягииа — Ландау z6. На опыте часто наблюдаются значительные отклонения от такой закономерности, а именно, в ряде случаев коагулирующее действие электролитов пропорционально валентности противоионов в степени меньше шести. Согласно И. Ф, Ефремову и О. Г. Усьярову, это отклонение от закономерности объясняется взаимодейстием частиц во вторичной потенциальной яме, что ведет или к образованию сравнительно малопрочных флокул или к желатинированию.
Обобщая все сказанное выше о нейтрализационной и концентрационной коагуляции, можно прийти к следующим выводам.
Когда потенциал <р0 частиц невысок, устойчивость золя зависит от значения потенциала поверхности, а адсорбционные явления определяют коагуляционный процесс; этим, как мы видели, объясняется правило Эйлерса — Корфа. Для объяснения коагуляции золя с сильно заряженными частицами теория ДЛФО исходит уже из представлений о сжатии двойного электрического слоя, согласно которым объясняется правило Шульце — Гарди. Существенно, что оба правила приложимы к золям одной и той же природы, а иногда и при одинаковом составе электролита.
 1 ноября, 2012
1 ноября, 2012  admin
admin 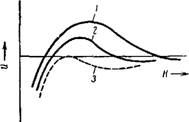
 Опубликовано в рубрике
Опубликовано в рубрике 