Ознакомившись со строением двойного электрического слоя, составляющего внешнюю оболочку мицеллы, и с физико-химическими основами" синтеза коллоидных систем, можно перейти к рассмотрению строения коллоидных мицелл в целом.
Строение мицелл в золях интересовало ученых уже давно, и по этому вопросу имеется множество миеиий, часть из которых представляет теперь лишь исторический интерес
Иордис в 1902 г. при изучении химических методов получения различных золей пришел к выводу, что состав коллоидных мицелл не соответствует тем веществам, которые должны образоваться в результате предполагаемой реакции. Иордис одни из первых отметил, что дисперсная фаза золя всегда содержит в качестве примеси вещества, из которых она была получена При удалении этих веществ, например, путем диализа, золь теряет устойчивость. На основании этого Иордис правильно считал, что примеси не безразличны для коллоидной системы. Согласно Иордису, коллоидная частица представляет собой комплексное соединение сложного состава.
Аналогичных взглядов придерживался и известный французский ученый Дюкло Он, как и Иордис, считал весьма существенным для свойств коллоидных систем присутствие в них небольших количеств исходных веществ и полагал, что эти примеси входят в состав коллоидных частиц. Например, состав частиц золя As2S3, получающегося в результате взаимодействия As203 и H2S и всегда содержащего небольшие количества H2S, Дюкло изображал формулой
As2S3 • nH2S
С помощью буквенного коэффициента п в этой формуле Дюкло хотел подчеркнуть возможность широкого изменения содержания H2S в коллоидной частице. Для подобной сложной частицы Дюкло первый предложил название «мицелла». Небольшое же количество стабилизатора в мицелле он назвал активной частью и указал, что именно эта часть обусловливает движение частицы в электрическом поле и ее присутствием объясняется поведение золя при введении в него электролитов
Паули расширил представления Иордиса и Дюкло. Он тоже считал, что мицелла состоит из сравнительно инертного ядра и способной к ионизации активной части Эту способную к ионизации часть мицеллы он назвал ионогенным комплексом Паули рассматривал этот комплекс как настоящее комплексное соединение по теории Вернера и поэтому выражал строение мнцеллы, например золя сульфида мышьяка, следующей формулой:
JcAs2S3 . {/As2S4H — • £/Н+
Эта схема объясняет как заряд частиц золя сульфида мышьяка, так и поведение золя при. введении в него электролитов. Однако схема ничего не говорит о том, какнм образом обеспечивается связь между ионогенным комплексом и неактивной частью мицеллы. Эта схема не может объяснить и того, почему коллоидные частнцы характеризуются как общим скачком потенциала на границе двух фаз, так и особым ^-потенциалом, обнаруживающимся только при электрокннетиче — ских явлениях.
Наряду с рассмотренными выше представлениями, которые можно назвать химическими гипотезами строения коллоидных мицелл, существовал и другой, физический, или адсорбционный, подход к объяснению структуры мицеллы. В 1914 г. Панет показал, что кристаллы некоторых нерастворимых в воде солей особенно энергично адсорбируют из окружающего раствора ионы, образующие с противоположно заряженными ионами кристаллической поверхности малорастворимые соединения. Причина этого явления заключается в том, что при образовании малорастворимой соли энергия гидратации всегда меньше энергии кристаллической решетки.
Дальнейшее развитие этой концепции и приложение ее к объяснению образования коллоидных систем принадлежит Фаянсу. Фаянс считал, что коллоидные частицы являются ультрамикроскопическими кристалликами и что, например, кристаллики Agl, полученные в результате реакции KI, взятого в избытке с AgNC>3 И находящиеся в растворе иодида калия, испытывают тенденцию к росту. Поскольку из ионов к+ и I", присутствующих в растворе, нерастворимое соединение с ионами Ag+ и I-, находящимися на поверхности кристалла, способен давать только ион он один и способен достраивать кристалл. Понятно, что достройка кристалла ионом I" может продолжаться только до тех пор, пока этим ионом не будут закрыты на кристаллической поверхности все ионы Ag+, которые только и могут взаимодействовать с ионом I" вследствие разноименности зарядов.
Достройка кристалла Agl имеет место и тогда, когда кристалл находится в растворе AgN03. В этом случае ионом, достраивающим поверхность, будет ион Ag+, который придаст кристаллу уже положительный заряд.
Достройка кристалла Agl ионами I — и Ag+ происходит не только потому, что они образуют нерастворимое соединение на кристаллической поверхности, но и потому, что эти ионы идентичны по размерам и свойствам с ионами I" и Ag+, уже имеющимися в кристалле, и, следовательно, наиболее подходят к данной кристаллической решетке. Правильность такой точки зрения подтверждается тем, что ионами, достраивающими решетку, могут быть не только ионы, общие с ионами кристалла, но и изоморфные с ними. Так, кристалл Agl может достраивать не только — ион I", но и изоморфные с ним ионы Вг~ или С1~.
Легко видеть, что в результате достройки на поверхности кристалла образуется двойной электрический слой. При этом, когда кристалл Agl находится в растворе KI, потенциалопределяю — щим ионом будет ион а противоионом — ион К+; когда же кристаллик находится в растворе AgNC>3, потенциалопределяющим ионом будет ион Ag+, а противоионом — ион NO3.
Существенно, что как химическая, так и физическая теории строения мицеллы приводят к одним и тем же выводам, а именно — к тому, что ионы электролита — стабилизатора препятствуют дальнейшему росту кристаллика, сообщают ему заряд и тем самым способствуют агрегативной устойчивости коллоидной системы.
Следует, однако, заметить, что химические и приведенные выше адсорбционные представления приложимы далеко не всегда. Например, при получении водцых эмульсий углеводородов с применением в качестве стабилизатора обычных мыл также образуется двойной электрический слой на поверхности капелек. При этом потенциалопределяющими ионами служат анионы жирной кислоты со сравнительно длинным углеводородным радикалом, а про — тивоионами — катионы щелочного металла. Понятно, что никакого комплексообразования или достройки кристаллической решетки в этом случае не может быть, так как капельки углеводорода химически инертны и аморфны. Однако существенно то, что в этом случае капельки углеводорода адсорбируют ионы, в состав которых входят углеводородные радикалы.
Таким образом, обобщая приведенное выше* можно прийти к выводу, что заряд коллоидной частицы всегда определяется родственными ионами стабилизатора, способными достраивать кристаллическую решетку или преимущественно адсорбироваться на поверхности частицы. Стабилизатором же может служить всякое вещество, имеющее такие ионы, независимо от того, является ли оно одним из исходных веществ, взятым в избытке при образовании дисперсной фазы (например, KI или AgN03 при образовании
золя Agl) или оно специально введено в систему при ее получении (мыло при образовании эмульсии).
На основании изложенного выше можно уточнить строение мицелл различных золей и выразить это строение специальными формулами.
Обратимся для примера к мицелле золя Agl, находящейся в межмицеллярной жидкости, представляющей собой слабый раствор К1. Учитывая строение двойного электрического слоя, образующегося на поверхности дисперсной фазы, и пользуясь правилом Панета — Фаянса, строение этой мицеллы можно представить — схемой, изображенной на рис. VIII, 9. Внутри мицеллы находится кристалл, состоящий из молекул Agl. Эту часть мицеллы, согласно терминологии, предложенной Н. П. Песковым, будем называть агрегатом, так как она всегда состоит из агрегата атомов, молекул или ионов, образующих дисперсную ■фазу. На поверхности кристалла находятся достраивающие его ионы, которые придают ему электрический заряд. Эти ионы, как мы уже знаем, являются потенциалопределяющими. Агрегат вместе с адсорбированными рис. VIII.9. Схема строения яа нем потенциалопределяющими ио- мицеллы золя иодида серебра Нами составляет ядро мицеллы. в слабом растворе нодида ка-
В, непосредственной "близости ОТ ЛИЯ’
Ядра в адсорбционном слое находится
Часть противоионов К+, которые настолько прочно связаны электростатическими и адсорбционными силами, что в электрическом поле они движутся совместно с ядром к аноду. Заметим, что эти противоионы К+ вместе с эквивалентным числом потенциалопреде — ляющих ионов I-"формально можно рассматривать как недиссо — циированные молекулы.
Ядро вместе с частью прочно связанных с ним противоионов будем в дальнейшем называть собственно коллоидной частицей. В отличие от мицеллы, в целом электронейтральной, частица всегда имеет заряд (в рассматриваемом случае отрицательный).
Остальные противоионы, находящиеся ближе к периферической части мицеллы, образуют диффузный слой мицеллы. Благодаря ослаблению с расстоянием кулоновских и адсорбционных сил эти ионы относительно свободны и в электрическом поле движутся уже к катоду. Граница между диффузным слоем и собственно коллоидной частицей, по которой мицелла «разрывается» при электрофорезе, называется плоскостью или границей скольжения. На рис. VIII, 9 она обозначена пунктирной линией.
|
|
Строение мицеллы можно представить также удобной для написания формулой. Например, для золя Agl, межмицеллярной
жидкостью которого является слабый раствор KI, можно написать следующую формулу мицеллы:
Мицелла т [Agl] пГ • (я — х) К+}ХК+ Агрегат
Ядро______________
Частица
В этой формуле т [Agl] соответствует числу молекул Agl, содержащихся в агрегате мицеллы, nl~ — числу потенциалопределяющих ионов, (П — х) К+ — числу противоионов в непосредственной близости от ядра и дгК+ — числу противоионов, находящихся в диффузном слое. Как правило, Таким же способом можно
Изображать и мицеллу золя с положительно заряжённой частицей, например мицеллу золя Agl в слабом растворе AgN03:
{т [Agl] raAg+ • (я — х) NO;} лЖ>з
Мы рассмотрели строение мицелл, у которых ионогенная часть образуется в результате адсорбции стабилизующего электролита, отличающегося по своей химической природе от вещества дисперсной фазы. В других случаях ионогенная часть мицеллы может образоваться из вещества самого агрегата. Примером такой коллоидной системы может служить достаточно постаревший гидрозоль двуокиси кремния. Поверхность агрегата, реагируя с окружающей его водой, образует метакремневую кислоту H2Si03, которая и будет являться стабилизатором. Строение миДеллы такого золя, очевидно, следует изображать формулой
{т [Si02] «Sior • 2 (я — х) Н+} 2*1^
Численный коэффициент 2 перед (ft — х) и х в этой формуле поставлен ввиду двухосновности метакремневой кислоты.
При пользовании схемами строения мицелл и их формулами следует помнить, что мицелла лиозоля не является чем-то раз и навсегда сформированным, а может претерпевать самые различные изменения. Так, при введении индифферентного электролита в золь происходит сжатие диффузной части двойного электрического слоя, а следовательно, радиус мицеллы уменьшается. При этом противоионы, находящиеся в диффузном слое, проникают за плоскость скольжения и в результате (П — х) возрастает, а х Уменьшается. При достаточном количестве индифферентного электролита ионы диффузного слоя могут полностью перейти в адсорбционный слой и частица окажется лишенной заряда. При этом, например, мицелла золя Agl, для которой стабилизатором является KI, будет иметь вид
Т [Agl] пГ • яК+
Кроме того, при введении индифферентного электролита с про тивоионом, отличным от противоиона мицеллы, происходит обмен противоионов.
При введении в золь электролита, один из ионов которого способен достраивать кристаллическую решетку, может изменяться число потенциалопределяющих ионов и даже один потенциалопре — деляющий электролит может замениться другим, т. е. произойдет перезарядка, например, при введении избытка AgN03 к золю Agl, стабилизованному KI.
3. ПРИМЕРЫ ПОЛУЧЕНИЯ КОЛЛОИДНЫХ СИСТЕМ
Ниже приводятся только наиболее характерные примеры синтеза коллоидных систем, причем основное внимание обращено на сущность способа, а не на его технические подробности, которые можно найти в специальной литературе.
Получение лиозолей методом конденсации. К этой группе синтезов относится получение лиозолей прямой конденсацией, заменой растворителя и путем различных химических реакций.
Примером синтеза прямой конденсацией может служить получение золя ртути. Для этого Нордлунд пропускал пары ртути через слой воды и получал довольно высокодисперсную эмульсию ртути в воде. Аналогичным способом могут быть получены золи серы, селена и теллура. Путем конденсации в жидкости паров меди, серебра, золота и платины, полученных в вольтовой дуге,, можно получить соответствующие золи в воде, спиртах, глицерине или бензоле. Строение мицелл этих золей мало изучено. Стабилизатором при получении всех этих систем служат окислы веществ, получающиеся при соприкосновении их паров с воздухом при высокой температуре. Образование в таких условиях окислов, обладающих свойствами электролитов, подтверждается заметным возрастанием электропроводности системы. Однако более стойкие* золи получаются в том случае, если в воду, в которой происходит конденсация паров, вводят стабилизующие электролиты.
Синтез коллоидных систем путем замены растворителя сводится к тому, что вещество, из которого хотят получить золь, растворяют в соответствующем растворителе в присутствии стабилизатора и затем раствор смешивают с другой жидкостью, в которой вещество нерастворимо. В результате этого вещество выделяется из раствора, но ввиду присутствия в системе стабилизатора оно> не выпадает в виде осадка, а образует золь. Таким образом могут быть получены гидрозоли канифоли и серы. Этот же метод Перрен использовал для получения классических дисперсий гуммигута и мастики. Растворителем для этих веществ служит этанол. Стабилизаторами являются примеси, содержащиеся в ничтожных количествах в исходных веществах и спирте (продукты окисления). Строение мицелл полученных таким способом золей еще не изучено, но известно, что во всех случаях коллоидные частицы заряжены отрицательно.
/
Коллоидные системы можно получить в результате химических реакций почти всех известных типов: реакций обмена, восстановления, окисления, гидролиза и т. д. Следует, однако, заметить, что коллоидные системы при проведении реакций, способных давать золи, образуются не. всегда, а лишь при определенных концентра — ‘ циях исходных веществ, порядке их смешения, температуре и соблюдении некоторых других условий.
В качестве примера получения золя путем реакции двойного обмена можно привести синтез гидрозоля иодида серебра из разбавленных растворов иодида калия и нитрата серебра. Существенно, что при смешении растворов, содержащих исходные вещества в количествах, близких к эквивалентным, золя не получается, а образуется осадок иодида серебра по реакции: AgN03 + KI —► AgU + KN03
Если же при смешении одно из исходных веществ взято в избытке, образуется золь. П. П. Веймарн, указавший на особую положительную роль избытка одного из веществ, принимающих участие в образовании коллоидной системы, полагал, что этот избыток необходим для понижения растворимости дисперсной фазы. Однако гораздо более правильно объяснить получение устойчивого золя Agl в присутствии избытка AgN03 или KI тем, что эти электролиты являются стабилизаторами частиц иодида серебра, образуя яа них двойной электрический слой.
Интересно, что устойчивость золя иодида серебра с отрицательно заряженными частицами несколько выше, чем с положительно заряженными. Причина этого заключается в том, что иодид-ионы адсорбируются на агрегатах иодида серебра сильнее, чем катионы серебра [16].
Аналогичным образом можно получить золи бромида и хлорида серебра, однако эти золи менее устойчивы. Причина этого заключается в сравнительно большой растворимости этих соединений. (Растворимости иодида, бромида и хлорида серебра в воде при 20 °С равны соответственно 9,7-10~9, 6,6- Ш~7 и 1,25-10~5 моль/л). Чем выше растворимость дисперсной фазы, тем легче происходит перекристаллизация коллоидных агрегатов и тем быстрее стареет золь.
Метод синтеза с помощью реакции обмена может быть использован не только для получения гидрозолей. Например, золь иодида серебра в ацетоне можно получить, смешивая растворы нитрата серебра и иодида калия в ацетоне. Впрочем, этот же золь очень легко получить путем диализа гидрозоля против ацетона.
Разработанный Зигмонди синтез гидролиза золота путем восстановления аурата калия формальдегидом может иллюстрировать получение коллоидной системы при реакции восстановления.
Исходным веществом в этом случае служит эолотохлористоводо — родная кислота Н [АиСЦ^НгО, из которой при взаимодействии с карбонатом калия в’ водном растворе образуется аурат калия:
2HfAuClJ — f 5К2С03 —2KAu02 + 5С02 + 8КС1 + Н20
Полученный раствор нагревают и к нему по каплям добавляют слабый раствор формальдегида. Реакция восстановления протекает по следующему уравнению:
2KAu02 + ЗНСНО + К2С03 —v 2Аи + ЗНСООК + КНС03 + Н20
Получается красный золь Золота. Стабилизатором золя золота служит аурат калия. Строение мицеллы этого золя можно приставить следующей формулой:
{т [Aii] «AuOJ •("-*) К+} дсК+
При проведении этого синтеза, равно как и рсех синтезов золей благородных металлов, необходимо особенно тщательно следить за чистотой посуды и реактивов.
Для получения монодиоперсных золей золота этим способом в раствор перед восстановлением вводят зародышевый золь золота (т. е. очень высокодисперсный), приготовленный отдельно путем восстановления хлорида золота фосфором. Золото, выделяющееся при восстановлении аурата калия в присутствии зародышевого золя, равномерно распределяется на зародышах, что и обеспечивает монодисперсность конечного золя..Все выделяющееся золото отлагается на зародышах, и в полученном золе образуется столько частиц, сколько было введено зародышей. Размер частиц такого золя, очевидно, тем больше, чем меньше зародышей было введено в раствор перед восстановлением. Зародышевый способ получения монодисперсных коллоидных систем с частицами желаемого размера широко используется при проведении ряда исследований в коллоидной химии.
Простейшим примером получения золя путем окислительной реакции является окисление сероводорода кислородом в водной среде. Этой реакцией объясняется помутнение сероводородной воды при стоянии на воздухе. Основная реакция протекает по уравнению:
2H2S + 02 —»- 2S + 2H20
Параллельно протекают более сложные реакции окисления, приводящие к образованию политионовых кислот, являющихся стабилизаторами золя серы. Принимая условно, что стабилизующим электролитом при этом синтезе служит пентатионовая кислота H2S5O6, строение мицеллы полученного золя серы можно представить следующей формулой:
{т [S] nS50|" -2(п — х) Н+} 2*Н+
Наконец, примером получения коллоидной системы путем реакции гидролиза является синтез золей гидратов окисей тяжелых — металлов нагреванием или диализом растворов их солей. Например, золь гидрата окиси железа получается, если в кипящую воду ".добавить небольшое количество хлорида железа FeCl3. При этом образуется красно-бурый золь Fe(OH)3-.
FeCl3 + ЗН20 —v Fe(OH)3 +ЗНС1
Кипячение способствует реакции благодаря удалению из системы хлористого водорода с парами воды. Стабилизатором в этом процессе принято считать хлорокись железа FeOCl, являющуюся продуктом неполного гидролиза хлорида железа;
FeCl8 + Н20 —FeOCl+2НС1
Впрочем, согласно другой точке зрения стабилизатором может быть и, сам хлорид железа. Хлористый водород можно удалять из системы также диализом. В результате этого золь гидрата окиси железа может образоваться и при достаточно длительном диализе раствора хлорида железа. Наконец, согласно третьей точке зрения, стабилизатором может являться хлористый водород. Эта точка зрения основана на том, что на поверхности частиц гидрата •окиси железа находится огромное число групп —ОН, способных адсорбировать водородный ион, всегда присутствующий в системе в момент образования золя.
Таким образом, мицелла золя Fe(OH)3 в соответствии с тем, •что является стабилизатором, может быть выражена формулами:
{т [Fe(OH)3] «FeO+ • (я — *) СГ} хС~
-ИЛИ
{т [Fe(OH)3] «Fe3+ • 3 (я — х) СГ} ЗхСГ
;ИЛИ
{т [Fe(OH)3] яН+ • (я — х) СГ} *СГ
В заключение необходимо указать, что лиозоли получаются всегда более устойчивыми, если при реакции не образуется индифферентных электролитов, обусловливающих астабилизацию. В связи с этим такие реакции, как:
2H2S + S02 —v 3S + 2H20
ИЛИ
AS203 +3H2S —V AS2S3 + 3H20
‘более благоприятны для получения устойчивых коллоидных систем, чем, например, реакция:
AgN03 + KI —»- Agl + KN03
Получение золей методом диспергирования. К этому методу относится получение коллоидных или микрогетерогенных систем обычным механическим диспергированием и вибрационным измельчением, например с помощью ультразвуковых колебаний. К этому же методу можно отнести получение золей и с помощью электрораспыления, хотя по существу электрораспыление является комби — нацией процессов диспергирования и конденсации.
Получение высокодисперсных систем методом механического диспергирования осуществляют обычно путем дополнительного дробления частиц сравнительно грубых дисперсий. Для этого грубую дисперсию обрабатывают обычно в жидкой среде в шаровых мельницах, краскотерках или коллоидных мельницах. В этих аппаратах сравнительно еще большие частицы подвергаются ударам, раздавливанию или истиранию в зависимости от типа машины, в результате чего они распадаются на мелкие частицы, которые благодаря стабилизатору, вводимому в дисперсионную среду, образуют относительно, высоко дисперсную устойчивую систему.
Принцип, по которому работают шаровые мельницы, понятен из рис. VIII, 10. Шаровая мельница представляет собой вращающийся полый металлический цилиндр, который частично заполнен тяжелыми металлическими или фарфоровыми шарами. В этот цилиндр загружают грубую дисперсию измельчаемого вещества и дисперсионную среду, содержащую стабилизатор, после Рис. VIII, 10. Принципиальная схема этого цилиндр приводят в мед — шаровой мельницы,
Ленное вращение. Шары под действием центробежной силы прижимаются к стенке и вместе с ней поднимаются на некоторую высоту, затем, оторвавшись, падают на шары, находящиеся внизу, и дробят попадающие между ними частицы дисперсной фазы. Понятно, что при перекатывании шаров во вращающейся шаровой мельнице происходит также и истирание частиц материала.
Для хорошего диспергирования объем шаров, загружаемых в мельницу, должен составлять 30—40% от ее общего объема. При большем числе шаров они падают с меньшей высоты, и, следовательно, измельчение идет хуже; при меньшем числе шаров они скользят по стенке, что также ухудшает измельчение и, кроме того, шары быстрее изнашиваются. Объем дисперсии в шаровой мельнице не должен превышать 20% от объёма мельницы.
Если измельчение вещества в шаровой мельнице проводить в > отсутствие дйсперсионной среды, то обычно невозможно получить частицы размером меньше 60 мкм. При мокром помоле в присутствии стабилизатора могут быть получены дисперсии с размерами частиц, близкими к коллоидным.
|
|
Шаровые мельницы имеют ряд преимуществ перед другими аппаратами для получения высокодисперсных систем, а именно, измельчение проводится в замкнутом пространстве без потерн растворителя, еслн он летуч; процесс можно продолжать до тех пор,
Пока не будет достигнута нужная степень измельчения- обслуживание машины чрезвычайно просто. Недостатком шаровых мельниц является значительное истирание шаров при работе, что приводит к загрязнению получаемой дисперсии, а также их сравнительно малая производительность.
Принцип диспергирования частиц сравнительно грубых дисперсий в аппаратах типа краскотерок заключается в раздавливании частиц между двумя вращающимися валиками или между вращающимся валиком и неподвижной поверхностью. Кроме того, в — данном случае диспергирование происходит и в результате больших сдвиговых напряжений, возникающих в тонком слое Жидкости между валиками. К краскотеркам по принципу работы приближаются смесительные вальцы, применяющиеся в резиновом производстве.
Наибольшую степень дисперсности можно получить используя для диспергирования твердого вещества в жидкости коллоидные мельницы. Первая коллоидная мельница, сконструированная Плаузоном, представляла собой металлический охлаждаемый водой кожух, в котором вращался эксцентрический вал с частотой 10 000—20 000 об/мин. На валу в несколько рядов были укреплены металлические пальцы — била. На внутренней стенке ь еталличе- ского кожуха были расположены металлические зубья, между которыми при вращении вала проходили била. Суспензию предварительно грубоизмельченного вещества подавали в кож^х сверху.
При вращении вала с большой скоростью жидкость отбрасывается от него, но одновременно засасываются новые ее порции. Дробление грубых частиц в мельнице Плаузона происходит в результате удара частичек о била и зубья и за счет истирания. Жидкость, содержащую диспергированные частицы, близкие по размерам к коллоидным, отбирают из кожуха снизу.
|
Рис. VIII, 11. Схема коллоидной мельницы: I—конический диск ротора; 2—вал ротора; 3— статор, 4—пришлифованные рабочие поверхности. |
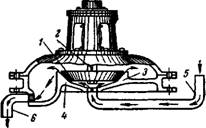
Другой тип коллоидной мельницы, широко распространенный в настоящее время, изображен на рис. VIII, 11. Эта мельница состоит из ротора, представляющего собой конический диск 1, сидящий на валу 2, и статора 3. Ротор приводится во вращение с помощью специального расположенного вертикально мотора, совершающего обычно около 9000 об/мин. Рабочие поверхности ротора и статора 4 пришлифованы друг к другу и толщина щели между ними составляет около 0,05 мм. Грубая суспензия подается в мельницу по трубе 5 под вращающийся диск центробежной силой, развивающейся в результате вращений ротора, проталкивается через щель и затем удаляется из мельницы через трубу 6. При прохо
ждении жидкости в виде тонкой плеики через щель взвешенные в Жидкости частицы испытывают значительные сдвиговые усилия и Измельчаются. Степень дисперсности полученной системы зависит от толщины щели и скорости вращения ротора: чем меньше зазор и больше скорость, тем больше сдвиговое усилие и следовательно, выше будет дисперсность.
Разработан ряд конструкций коллоидных мельниц. Однако с помощью коллоидных мельниц даже самых совершенных Конструкций никогда не удается получить системы такой дисперсности, как методом конденсации.
Диспергирование е помощью ультразвуковых колебаний, т. е. колебаний с частотой выше 20 000 в секунду, не улавливаемых человеческим ухом, является эффективным лишь в том случае, когда диспергируемое вещество обладает малой прочностью. К таким веществам следует отнести смолы, серу, графит, гипс. Применяя ультразвук, можно получать также дисперсии легких металлов и их сплавов в органических жидкостях. Ультразвук может быть с успехом использован и при пептизации свежеприготовленных осадков.
Ультразвуковые колебания обычно получают с помощью пьезоэлектрических осцилляторов, принцип действия которых заключается в превращении электрических колебаний высокой частоты в механические. В настоящее время с помощью кварцевых осцилляторов получают ультразвуковые волны с частотой до 1 миллиона колебаний в секунду. С помощью магнитострикционных осцилляторов, рабочей частью которых является ферромагнитный стержень, получают ультразвуковые волны с меньшей частотой — до 50 тысяч колебаний в секунду.
Диспергирование с применением пьезоэлектрических осцилляторов проводят следующим образом. Пьезоэлектрическую пластинку, к которой прилагают разность потенциалов, помещают в жидкость с малой диэлектрической проницаемостью, например в трансформаторное масло, через которую ультразвуковые колебания передаются сосуду с системой, подвергающейся диспергированию.
Механизм диспергирования твердых тел ультразвуком еще сравнительно мало исследован. Под влиянием ультразвуковых колебаний в системе возникают местные, быстро чередующиеся сжатия и расширения вещества, приводящие к образованию мельчайших полостей — кавитаций, сейчас же исчезающих под влиянием внешнего давления. Эти сжатия, расширения и кавитации разрушают твердую фазу, т. е. диспергируют ее. Следует, впрочем, заметить, что ультразвуковые волны в определенных условиях^могут вызывать не только диспергирование, но и коагуляцию, которая происходит в результате скопления частиц в узлах колебаний и движения меньших частиц по направлению к большим. В результате такой коагуляции при диспергировании быстро достигается равновесие, при котором диспергируется столько же вещества» сколько его выпадает из золя в виде осадка.
В последнее время для диспергирования стали широко применять вибрационные измельчители. Работа этих измельчающих аппаратов основана на воздействии на материал частопеременных силовых импульсов, в результате чего материалу сообщается большое число сравнительно слабых ударов. По этому принципу действуют вибромельницы, представляющие собой комбинацию шаровой мельницы и специального вибратора Работа вибратора вызывает крлебания корпуса мельницы с частотой, равной числу оборотов электромотора, приводящего в движение вибратор. Это вызывает перемещение и соударение шаров, что приводит к дроблению и измельчению частиц материала. Эффективность работы вибромельииц (т. е. интенсивность действующих измельчающих усилий и мощность установки) определяется частотой и амплитудой колебаний.
Имеются также вибрационные измельчители без измельчающих тел Работа этих измельчителей, имеющих весьма различное устройство, основана иа соударении частиц измельчаемого материала в движущихся с большой скоростью пересекающихся потоках газа или пара При скоростях движения, превышающих 100 м/с, наступает вибрационный режим разрушения, поэтому в таких измельчителях эффективно диспергируются не только хрупкие, но и пластические материалы Преимущество подобных машин заключается в том, что они дают весьма равномерный помол и в измельченном материале отсутствуют продукты износа измельчающих поверхностей Кроме того, такие измельчающие устройства гораздо экономичнее обычных мельниц
Дробление частиц дисперсной фазы при получении систем методом механического диспергирования, как правило, проводят в водной среде. Однако водные системы, если их частицы смачиваются органическими жидкостями, легко можно перевести в суспензии с неводной средой. Так, измельченйе пигментов обычно ведут в воде, а затем, не высушивая, влажный пигмент смеширают с маслом, при этом гидрофобные частицы пигмента переходят в масло. Интересно, что для высокодисперсных коллоидных систем, полученных методом конденсации, этот способ замены среды обычно непригоден, так как при смешении гидрозоля с органической жидкостью частицы коллоидных размеров, как правило, собираются на поверхности раздела жидкостей.
К диспергационным методам получения золей условно можно отнести и получение золей электрораспылением в вольтовой дуге металлических электродов, погруженных в дисперсионную среду. Этот способ можно считать диспергационным потому, что в данном случае дисперсная фаза образуется путем непосредбтвеиного диспергирования металла, при котором твердые частицы коллоидных размеров отрываются от металлических электродов, поступают в среду и образуют лиозоль. Однако, с другой стороны, этот метод можно считать, хотя бы отчасти, и конденсационным, так как при высокой температуре дуги металл электродов превращается в пар, который, соприкасаясь с окружающей средой, охлаждается, конденсируется и образует коллоидные частицы.
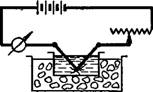
Метод электрораспыления был предложен Бредигом в 1898 г. Бредиг включал в цепь постоянного тока силой 5—10 А и напряжением 30—110 В амперметр, реостат и два электрода из диспергируемого металла. Электроды он погружал в сосуд с водой, охлаждаемый снаружи льдом. Схематическое устройство прибора, которым пользовался Бредиг, показано на рис. VIII, 12. При прохождении тока через электроды между ними под водой возникает вольтова дуга. При этом у электродов образуется облачко высокодисперсного металла. Для получения более стойких золей в воду, в которую погружены электроды, целесообразно вводить следы стабилизующих электролитов, например гидроокисей щелочных металлов. Интересно, что диспергированию в описанных условиях подвергается не только катод, но и анод. Это подтверждает тот факт, что при электрораспылении существенную роль играют термические процессы и явления парообразования.
Метод Бредига из-за высоких температур, создающихся около вольтовой дуги, применим только для получения гидрозолей. Сведберг усовершенствовал этот метод, сделав его пригодным для получения органозолей. Для этого вместо постоянного тока Сведберг применил переменный ток высокой частоты, а сам процесс электрораспыления проводил путем погружения электродов в металлический порошок, лежащий на дне сосуда в дисперсионной среде. Электрораспыление в этом случае происходит в результате проскакивания искры между отдельными частицами порошка. При таком способе сильно уменьшается термическое разложение окружающей среды и можно получить золи металлов в различных органических жидкостях.
М А. Луниной совместно с сотр. усовершенствован метод получения металлических органозолей. Этот метод сводится к пропусканию электрического тока через металлический порошок в жидкой органической среде, при этом переменный ток проходит по слою металлического порошка, находящегося на дне сосуда с жидкой средой, и вызывает в точках неполного касания электрический разряд. Таким образом путем электрораспыления были получены органозоли железа, никеля, алюминия, хрома, вольфрама и других металлов. Для повышения устойчивости этих золей в систему добавляют стабилизаторы, обычно нафтенат или стеарат алюминия.
|
Рис. VIII, 12. Получение золей электрораспылением по Бредигу. |
Органозоли металлов широко применяются при гидрировании и восстановлении различных органических соединений, в качестве катализаторов горения жидкого топлива в ракетах, как наполнители пластических масс, клеев, антикоррозионных лаков и красок, в медицине для изготовления лекарственных препаратов и т. д.
Получение лиозолей методом пептизации. Различают следующие виды пептизации: пептизация промыванием осадка; пептизация осадка электролитом; пептизация поверхностно-активными веществами; химическая пептизация.
Пептизация промыванием осадка сводится к удалению из нега электролита, вызвавшего коагуляцию. В результате этого оставшийся двойной электрический слой утолщается, силы отталкивания начинают преобладать над силами притяжения и отделившиеся друг от друга мицеллы в результате броуновского движения равномерно распределяются в дисперсионной среде, т. е. образуют коллоидный раствор. Этот вид пептизации, как можно видеть, не требует введения в систему специального пептизатора, так как стабилизатор присутствует в осадке и промывание лишь обеспечивает увеличение его активности.
Пептизация осадка промыванием хорошо известна из практики аналитической химии, где она обычно рассматривается как нежелательное явление. Очень часто при промывании полученного осадка водой он начинает проходить через фильтр, что указывает на увеличение его дисперсности и образование гидрозоля.
Ниже в качестве примера приведены данные о поведении при промывке водой осадка М02О5, полученного коагуляцией различными электролитами; промывку проводили несколько раз, всегда постоянным объемом воды при 18—20 °С:
Электролит, примененный прн коагуляции
NaCl…………………………………… Полная пептизация после одной
Промывки NH4C1 То же
КС1 . …………………………………. То же, пэсле двух промывок
Морфинхлорид …… То же, после трех промывок
Sr(NO,)2………………………………. То же, после шести промывок
ВаС12………………………………….. Следы пептизации после семи промывок
A12(S(V3……………………………… То же
Как можно видеть, чем больше валентность и радиус коагулирующего иона, тем труднее идет пептизация осадка промывкой. Это объясняется тем, что обусловившие коагуляцию ионы, если они поливалентны или обладают большим радиусом, прочней удерживаются осадком и этим затрудняют пептизацию.
Пептизация электролитами наблюдается при введении в осадок, образовавшийся при коагуляции, электролита, один из ионов которого может достраивать кристаллическую решетку дисперсной фазы или, по крайней мере, адсорбироваться на ее поверхности. Понятно, такой пептизации всегда способствует предварительная промывка осадка чистым растворителем.
Примером пептизации с помощью электролита является введение в свежеполученный и промытый водой осадок гидрата окиси железа раствора хлорида железа. В результате неполного гидролиза из хлорида железа образуется хлорокись железа, которая, как мы видели, способна стабилизовать частицы гидрата окиси железа. При этом происходит косвенная пептизация, когда вводимое вещество сначала реагирует с водой, а затем уже продукт этой реакции пептизирует осадок. Существенно, что-на пептизацию осадка электролитом оказывает влияние не только ион, сообщающий свой заряд частице, но и противоположно заряженный ион.
Примером пептизации с помощью поверхностно-активных веществ может служить пептизация высокодисперсиого порошка кровяного угля пикриновой кислотой и мылами Окись железа также может быть пептизирована мылами, а окись алюминия — ализарином. Высокодисперсный порошок гидрофильного каолина пептизируется гуминовыми кислотами. Хорошим пептизирующим действием часто обладают высокомолекулярные вещества, макромолекулы которых способны адсорбироваться на частицах и придавать им заряд или сольватную оболочку. Согласно новым воззрениям Пептизация может обусловливаться и взаимным отталкиванием совершающих тепловое движение гибких цепных молекул, только частично адсорбировавшихся на поверхности коллоидной частицы. Более подробно об этих взглядах сказано в гл. IX.
Химическая пептизация происходит, когда вещество, добавляемое в систему, взаимодействует с веществом осадка, в результате чего образуется электролит, придающий устойчивость частицам дисперсной фазы. Примером химической пептизации может служить пептизация осадка гидрата окиси железа хлористоводородной кислотой, которая, взаимодействуя с Fe(OH)3, образует на поверхности частиц осадка стабилизатор — хлорокись железа: Fe(OH)s + НС1 —> FeOCl +2Н20
 1 ноября, 2012
1 ноября, 2012  admin
admin 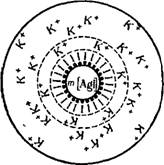
 Опубликовано в рубрике
Опубликовано в рубрике 