Существование газообразных и конденсированных поверхностных пленок было блестяще доказано Ленгмюром при помощи сконструированных им специальных весов,’ позволяющих определять
|
|
|
Рис. V, 5. Весы Ленгмюра: |
|
/—кювета; 2, 3 —Левый и правый барьер; 4—Коромысло; 5—чашечка. |
|
Рис. V, 6. Зависимость поверхностного давления р от площади, занимаемой молекулой кислоты S0: 1 — изотерма для лауриновой кислоты; 2—то же для миристиновой кислоты; 3—то же для пальмитиновой кислоты. |
Поверхностное давление, под действием которого находится пленка, и устанавливать зависимость этого давления от площади, занимаемой пленкой.
Устройство весов Ленгмюра в первоначальном их виде схематически показано на рис. V, 5.
Измерение с помощью таких весов проводят следующим образом. На поверхность воды, налитой вровень с краями кюветы 1 и ограниченной слева и справа барьерами 2 и 3 из полосок пропитанной парафином бумаги, помещают небольшое количество летучего растворителя, содержащего нерастворимое вещество, способное образовывать поверхностную пленку. Растворитель быстро улетучивается, а дифильные молекулы вещества распространяются по поверхности воды. Приближая левый подвижный барьер 2 К правому 3, связанному с коромыслом 4, уменьшают пространство, занятое пленкой. При этом под действием возросшего поверхностного давления пленки барьер 3 передвигается вправо и таким образом выводит из равновесия связанное с ним коромысло 4. Помещая нужные разновесы на чашечку 5, можно привести весы к нулевому положению и таким образом измерить давление, под которым находится пленка.
Проделав эту операцию несколько раз, можно получить данные для построения изотермы, связывающей давление, под действием которого находится пленка, с площадью, занятой известным количеством исследуемого вещества, или с площадью, занимаемой одной молекулой этого вещества. Последнюю легко вычислить, зная площадь, занятую всем веществом, его массу и молекулярный вес.
На рис. V, 6 представлены такие изотермы, полученные Адамом для различных жирных кислот при температуре 12,5—14,5 °С. Кривая 1 относится к лауриновой кислоте (СцНгзСООН), которая благодаря сравнительно короткому углеводородному радикалу образует только газообразные поверхностные пленки. Как можно видеть, эта изотерма по своей форме напоминает изотерму PV = const для идеального трехмерного газа. Кривая 2 была получена для миристиновой кислоты С13Н27СООН, которая способна давать и газообразные и конденсированные пленки. В этом случае после достижения известной степени сжатия пленки (определенной площади, приходящейся на одну молекулу) давление перестает увеличиваться и кривая на некотором участке идет параллельно оси абсцисс. Наличие этого участка, аналогичного подобному участку на изотерме р, V для реального трехмерного газа, указывает на конденсацию двухмерного газа и отвечает наличию равновесия между двумя поверхностными фазами — газообразной пленкой и островками конденсированной пленки.
Интересно отметить, что наблюдаемое максимальное давление двухмерного ґаза при его конденсации, равное примерно 0,4 дин/см, может показаться весьма малым. Однако это не так. Следует учесть, что молекулы двухмерного газа лежат «плашмя» и толщина поверхностной пленки составляет всего около 4,5 А. Соответствующий расчет показывает, что поверхностное давление в 0,4 дин/см примерно соответствует 8,7-Ю6 дин/см2, или 8,5 атм. Это значение уже довольно близко к критическому давлению для обычных жидкостей.
При дальнейшем сжатии пленки, когда «островки» приближаются вплотную друг к другу и двухмерный газ между ними исчезает, давление снова резко увеличивается. Наконец, при сравнительно высоких давлениях оно достигает определенного предела и уже не изменяется (на рис. V, 6 этот участок не показан). Этот предел соответствует давлению, при котором пленка разрушается.
При этом отдельные обломки пленки наползают друг на друга, как льдины во время ледохода, и на поверхности воды образуется уже полимолекулярный слой поверхностно-активного вещества.
Кривая 3 относится к пальмитиновой кислоте С15Н31СООН, обладающей большим молекулярным весом. Эта кислота из-за сильного взаимодействия между длинными углеводородными радикалами при обычной температуре образует только конденсированные пленки. Если такой пленке предоставлена достаточно большая поверхность, то на остальной поверхности жидкости, не занятой пленкой, конечно, находится двухмерный газ, но давление его настолько мало, что его трудно измерить. При достаточном сжатии подобных пленок наблюдается внезапное резкое возрастание давления, отвечающее тому, что вся поверхность воды покрывается конденсированной пленкой. Дальнейшее сжатие пленки приводит к ее разрушению аналогично разрушению пленки из ми — ристиновой кислоты.
Установление зависимости между поверхностным давлением и площадью, занимаемой молекулой, позволяет не только найти связь между природой поверхностно-активного вещества и характером образующейся пленки, но и выяснить влияние температуры на строение пленки. Опыт показал, что по мере повышения температуры сначала в пленке преодолеваются молекулярные силы между углеводородными радикалами и пленка может стать растянутой, затем пленка превращается в газообразную.
Все сказанное об ориентации молекул поверхностно-активного вещества на границе вода — воздух относилось к пленкам, полученным из дифильных молекул, очень мало растворимых в воде. Однако это же относится и к поверхностным пленкам растворимых веществ, образованных в результате адсорбции их молекул. Необ-, ходимо лишь помнить, что между количеством веществ на поверхности и в объеме всегда устанавливается известное равновесие. Кроме того, следует учесть, что поверхностные пленки растворимых поверхностно-активных веществ, благодаря сравнительно^ небольшой длине углеводородных радикалов их молекул, почти всегда бывают газообразными.
По зависимости поверхностного давления от площади пленки в кювете весов Ленгмюра можно определить размер и форму молекул, образующих’пленку. В некоторых случаях подобные исследования позволили уточнить строение молекул, до этого остававшееся неясным. Именно с помощью этого метода выяснено строение ряда эфиров высокомолекулярных спиртов и других органических соединений.
Рассмотрим, как можно определить указанным способом размер и форму дифильных молекул нерастворимых в воде веществ. Согласно сказанному выше, резкий подъем изотермы давление — площадь пленки отвечает образованию плотно упакованного слоя молекул, ориентированных перпендикулярно поверхности воды. Соответствующий перегиб кривой позволяет найти площадь So, при — холящуюся на одну молекулу, расположенную в вертикальном (по отношению к плосі сти воды) положении:
Su = NAm/M = NAm/Ms = ГМаксЛГА (V>28)
Где s — площадь всей пленки, равная произведению расстояния между барьерами на ширину кюветы весов Ленгмюра; т — масса взятого для определения вещества, г; М — молекулярный вес вещества; NA — число Авогадро.
Значение s0, найденное по этому методу для всех жирных кислот, имеющих в цепи 14 и больше атомов углерода, оказалось равным 20,5 А2. Тот факт, что площадь, занимаемая молекулой в сплошном мономолекулярном слое, не зависит от длины цепи, подтверждает характер расположения молекул, а именно, цепи не лежат на поверхности воды, а ориентированы более или менее вертикально. В результате рентгенографических исследований было установлено, что в кристаллах площадь сечения параллельных плотно упакованных углеводородных цепей составляет 18,4 А2. Соответствие значению 20,5 А2 довольно хорошее. Несколько большие значения s0 для молекул жирных кислот в пленках можно объяснить либо меньшей плотностью их упаковки, либо тем, что они не вполне перпендикулярны к поверхности, а образуют с нею некоторый угол.
Опыты также показали, что s0, не изменяясь с увеличением длины углеводородного радикала, зависит от полярной группы молекулы. Так, s0 для жирных кислот равно 20,5 А2, для сложных эфиров предельных кислот — 22 А2 и для спиртов — 21,6 А2. Это указывает, что s0 является молекулярной константой, которая характеризует полярную группу дифильной молекулы. Кроме того, опыты показали, что s0 сравнительно мало зависит от природы поверхности, на которой образовалась пленка. Так, было найдено, что площадь, занимаем’ая молекулой я-толуидина на границе водный раствор — воздух, равна 25,4 А2, на границе вода — гексан — 26,2 А2 и на границе вода — бензол — 25,8 А2. Поэтому, зная ГМако и число молей п вещества, адсорбированного поверхностью в условиях, отвечающих образованию сплошного мономолекулярного слоя, можно вычислять поверхность адсорбента s, пользуясь простым уравнением:
S = "макс/Гмакс (V,29)
Этот метод широко применяется для определения удельной поверхности различных адсорбентов и дисперсных систем. Для этого можно воспользоваться следующим уравнением:
5уд = 5/« (V,30)
Толщину поверхностной пленки 6, или, что то же, длину молекулы вещества при допущении вертикального ее расположения на поверхности, также можно вычислить. Объем поверхностного слоя, приходящийся на единицу поверхности, очевидно, численно равен 6. С другой стороны, объем этого же слоя равен ГмаксУмол (где Умол — мольный объем). Поэтому
® " Гмакс^мол ^ ГмаксМ/р (V.31)
Где р — плотность адсорбированного вещества.
Ясно, что значение 6 в гомологическом ряду должно правильно возрастать с увеличением длины цепи. И действительно, опыт показал, что при удлинении алифатической цепи на группу СН2 3 возрастает на 1,43 А. Рентгенографически установленное расстояние между двумя атомами углерода в углеводородной цепи, где валентные связи расположены под углом 109°28′, равно по прямой, соединяющей оба атома, 1,54 А, а по вертикали—1,26 А.
Несовпадение последнего значения со значением 1,43 А объясняется, вероятно, теми же причинами, что и несовпадение значений So, определенных с помощью весов Ленгмюра и рентгенографически.
 1 ноября, 2012
1 ноября, 2012  admin
admin 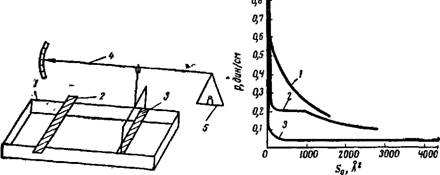
 Опубликовано в рубрике
Опубликовано в рубрике 