Выше были рассмотрены представления о поверхностном натяжении индивидуальных жидкостей. На поверхностном натяжении растворов сильно сказывается явление адсорбции. ,
Все растворимые вещества по их способности адсорбироваться на границе жидкость — воздух можно разделить на две группы: поверхностно-активные вещества и поверхностно-инактивные вещества.
Поверхностно-активные вещества способны накапливаться в поверхностном слое, и, следовательно, при этом должна происходить положительная адсорбция, т. е. Г > 0. ПоверхностНо-активные вещества должны обладать поверхностным натяжением, меньшим поверхностного натяжения растворителя (иначе накопление вещества в поверхностном слое термодинамически невыгодно), и сравнительно малой растворимостью; при хорошей растворимости они стремились бы уйти с поверхности в глубь жидкости. Иначе говоря, взаимодействие между молекулами поверхностно-активного вещества (в целом) и молекулами растворителя всегда меньше взаимодействия между молекулами растворителя. Поэтому поверхностно-активные вещества будут преимущественно выталкиваться из объема раствора на поверхность, т. е. в этом случае Г > 0. В результате накопления на поверхности раствора молекул этих веществ, слабо взаимодействующих друг с другом, межмолекулярное взаимодействие в поверхностном слое уменьшается и поверхностное натяжение падает.
Поверхностно-активными веществами относительно воды являются многие органические соединения, а именно жирные кислоты с достаточно большим углеводородным радикалом, соли этих жирных кислот (мыла), сульфокислоти и их соли, спирты, амины. Характерной особенностью строения молекул большинства поверхностно-активных веществ является их дифильность, т. е. строение молекулы из двух частей — полярной группы и неполярного углеводородного радикала. Обладающая значительным дипольным моментом и хорошо гидратирующаяся полярная группа обусловливает сродство поверхностно-активного вещества к воде. Гидрофобный углеводородный радикал является причиной пониженной растворимости этих соединений. Наименьшее значение поверхностного натяжения водного раствора поверхностно-активных веществ Может достигать 25 эрг/см2, т. е. почти равняться поверхностному натяжению углеводородов.
В дальнейшем дифильные молекулы поверхностно-активного вещества мы будем изображать общепринятым символом:
Где кружок обозначает полярную группу, а черточка — неполярный радикал.
Поверхностно-инактивные вещества стремятся уйти с поверхности жидкости в объем, в результате чего происходит отрицательная адсорбция, т. е. Г < 0. Поверхностно-инактивные вещества обладают поверхностным натяжением, большим поверхностного натяжения растворителя (иначе они самопроизвольно накапливались бы в поверхностном слое), и обычно высокой растворимостью, что способствует их стремлению уйти с поверхности в объем. Другими словами, взаимодействие между молекулами по — верхностно-инактивных веществ и растворителя всегда больше, чем взаимодействие между самими молекулами растворителя, поэтому поверхностно-инактивные вещества стремятся перейти в объем раствора.
Поверхностно-инактивными веществами в отношении воды являются все неорганические электролиты — кислоты, щелочи, соли. Молекулы этих веществ не имеют гидрофобной части и распадаются в воде на хорошо гидратирующиеся ионы. Одновалентные ионы вызывают сравнительно небольшое повышение поверхностного натяжения.
Двухвалентные ионы эффективнее одновалентных в эквимоляр — ных растворах.
Из органических веществ поверхностно-инактивными относительно воды являются лишь ионизирующиеся вещества, у которых неполярная часть молекулы отсутствует или очень мала. К таким веществам относятся, например, муравьиная и аминоуксусная кислоты.
В неводных растворителях неорганические электролиты также повышают поверхностное натяжение, причем величина этого эффекта зависит от природы растворителя. Так, при введении иодида натрия в метиловый спирт сильно повышается поверхностное натяжение, у этилового спирта поверхностное натяжение повышается примерно вдвое меньше, в спиртах большего молекулярного веса эффект еще меньше.
Вещества, не влияющие на поверхностное натяжение растворителя, распределяются равномерно между поверхностным слоем и объемом раствора и, следовательно, для них Г = 0. Такие вещества обладают поверхностным натяжением, близким к поверхностному натяжению растворителя. Примером веществ, весьма малоактивных в отношении воды, могут служить сахара — при растворении Сахаров в воде ее поверхностное натяжение почти не изменяется. Однако следует заметить, что сахара, не изменяя заметно поверхностного натяжения на границе водный раствор — воздух, часто оказываются поверхностно-активными на границе водный раствор — твердая фаза или другая жидкость.
На рис. V, 1 приведены изотермы поверхностного натяжения — кривые, характеризующие изменение поверхностного натяжения при повышении концентрации вещества. Как можно видеть, при повышении концентрации поверхностно-активного вещества (кривая /) изотерма сначала круто падает почти по прямой. Наличие этого участка на изотерме определяется тем, что вначале вся поверхность раздела жидкость — воздух свободна от поверхностно — активного вещества и небольшие его количества, присутствующие
2
|
|
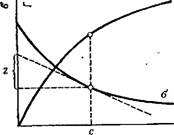
Рис. V, 1. Зависимость поверхност — Рис. V, 2. Зависимость поверхностного натяжения а от концентрации ного натяжения а от температуры: раствора: 1— индивидуальная жидкость; 2—Раствор
1 — изотерма для поверхностно-активного поверхностно-активного вещества,
Вещества, 2 —то же для поверхностно-ин — активного вещества; 3 — то же для вещества, ие влияющего на поверхностное иатяжеиие растворителя.
В растворе, почти целиком уходят на поверхность. Затем следует криволинейный участок изотермы, отвечающий средним концентрациям поверхностно-активного вещества. В этих условиях значительная часть поверхности уже занята молекулами поверхностно — активного вещества, что снижает дальнейшую его ‘адсорбцию на границе раздела. Наконец, большим концентрациям поверхностно — активного вещества на изотерме отвечает почти горизонтальный участок, показывающий, что поверхностное натяжение мало зависит от концентрации. При этих условиях на поверхности жидкости образуется сплошной мономолекулярный слой поверхностно-активного вещества и дальнейшая адсорбция уже невозможна.
При повышении концентрации поверхностно-инактивного вещества в растворе (кривая 2) изотерма полого поднимается. Это объясняется тем, что поверхностно-инактивные вещества благодаря большому поверхностному натяжению и хорошей растворимости уходят в объем, а на границе раздела жидкость — воздух имеется лишь сравнительно небольшая часть этого вещества, попадающая туда в результате диффузии из объема раствора.
Наконец, при повышении концентрации веществ, не влияющих на поверхностное натяжение (кривая 3), изотерма, естественно, представляет собой прямую, параллельную оси концентраций.
В заключение следует отметить, что поверхностная активность вещества зависит не только от его природы, но и от свойств растворителя (среды). Если растворитель обладает большим поверхностным натяжением, данное вещество может проявлять значительную поверхностную активность, если же растворитель имеет малое поверхностное натяжение, те же вещества могут стать поверхностно-инактивными. Вода, наиболее часто применяющийся растворитель, обладает большим поверхностным натяжением, и поэтому по отношению к ней многие вещества проявляют поверхностную активность. Спирты обладают значительно меньшим поверхностным натяжением, чем вода. Поэтому некоторые вещества поверхностно-активные в отношении воды, являются инактивными в отношении спиртов.
Установление равновесного значения поверхностного натяжения. Баланс молекулярных сил на вновь образованной поверхности индивидуальных жидкостей, а следовательно, и равновесное значение поверхностного натяжения устанавливаются практически мгновенно. На поверхности же растворов поверхностно-активных веществ должна установиться равновесная концентрация поверхностно-активного вещества, что осуществляется в результате диффузии. Поэтому, если молекулы поверхностно-активного вещества большие, медленно диффундирующие, например молекулы высших жирных кислот и их солей, равновесное значение поверхностного натяжения на границе раствор — воздух может устанавливаться довольно долго.
Зависимость поверхностного натяження от температуры. Весьма своеобразна зависимость поверхностного натяжения растворов поверхностно-активных веществ от температуры, изученная П. А. Ребиндером. Поверхностное натяжение индивидуальных жидкостей, как уже было сказано, монотонно уменьшается с температурой. Поверхностное натяжение растворов некоторых поверхностно-активных веществ с повышением температуры может изменяться по кривой с максимумом. На рис. V, 2 схематически изображена температурная зависимость поверхностного натяжения для индивидуальных жидкостей (1) и растворов таких поверхностно-активных веществ (2). Максимум на кривой 2 объясняется десорбцией поверхностно-активного вещества в определенном интервале температур, что приводит к увеличению поверхностного натяжения. При более высоких температурах, после окончания процесса десорбции, поверхностное натяжение снова начинает снижаться.
3. УРАВНЕНИЕ ГИББСА
Для интерпретаций явлений адсорбции на границе раствор — газ весьма существенно установить связь между избытком адсорбированного вещества в поверхностном слое Г, концентрацией поверхностно-активного вещества в растворе с- и поверхностным натяжением а на границе раствор — газ. Эта связь для разбавленных растворов дается известным уравнением адсорбции Гиббса, выведенным им в 1876 г.:
Г = — — (V.1V
1 Rt dc К ‘lt
Приведем упрощенный вывод уравнения Гиббса, данный Во, Оствальдом.
Представим себе раствор поверхностно-активного вещества с поверхностью со и поверхностным натяжением о. Пусть поверхностный слой этого раствора содержит избыток в 1 моль растворенного вещества. Очевидно, в этом случае можно написать:
Г = I/(o (V,2>
Допустим, что в объеме поверхностно-активного раствора содержится тоже 1 моль поверхностно-активного вещества. Перенесем мысленно весьма малое количество поверхностно-активного вещества из объема в поверхностный слой. При этом поверхностное натяжение изменится на величину Da.
Так как система вначале находилась в равновесии, то перенос вещества из объема в поверхностный слой потребует затраты некоторой работы на преодоление осмотического давления Vdit (где V — объем раствора; Dn — разность осмотических давлений до и после переноса).
Поскольку изменение поверхностной энергии должно быть равно значению затраченной осмотической работы с обратным знаком, можно написать:
Ю da = — Vdn
Но так как V = RT/N и поскольку для достаточно разбавленных, растворов я пропорционально концентрации с, последнее уравнение можно представить следующим образом:
TOC o "1-3" h z , RT dn RT dc …
<ado =—————————— (v,3>
Я с R
Подставляя в это уравнение значение со, найденное из уравнения (V, 2), и решая его относительно Г, получим уравнение Гиббса:
1 ~~ . RT dc
В случае, когда имеют дело с достаточно концентрированным» растворами, концентрацию с в уравнении Гиббса следует заменить на активность вещества а.
Приведем еще один более строгий вывод уравнения Гиббса, основанный на. применении химического потенциала.
Как известно из термодинамики, для системы, состоящей из двух компонентов, связь между изобарно-изотермическнм потенциалом G и химическими потенциалами Ці и Цг обоих компонентов выражается уравнением:
G = Ц!«, + jХіПі
Где «і и п2 — число молей первого и второго компонентов, например растворителя и растворенного вещества.
Это уравнение не учитывает возможности изменения поверхности системы. Для реального раствора, обладающего поверхностью, в уравнение следует ввести член As (где а— поверхностное натяжение, a s — площадь поверхности). Тогда приведенное выше уравнение можно написать следующим образом:
G = As + P.|«J + P2« 2 После дифференцирования имеем:
DG — a ds + S da + р, + Я, Dp, + ц2 dn2 + П2 di2 (V. 4)
С другой стороны, из термодинамики известно, что
DG = — S DT + V Dp + р, Dtti + р2 Dn2 Где S — энтропия; V—объем; р — давление.
Это уравнение также не учитывает возможности изменения поверхности. При введении соответствующей поправки оно принимает внд:
DG = — S DT + V Dp + A Ds + р, At, + Й2 Dn2 (V, 5)
Приравнивая правые части равенств (V, 4) и (V, 5), получаем:
S DT — V Dp + s Da + я, dp, + N2 =0 При постоянной температуре и давлении это уравнение упрощается:
S Da + «і ^Рі + «2 D[I2 = 0 (V, 6)
Рассматриваемый раствор можно представить состоящим из двух частей — части, испытывающей действие поверхностных сил (поверхностная фаза), и части, не находящейся под действием этих сил (объемная фаза). Обозначим через «Ї и я® число молей первого и второго компонентов в объемной фазе, а п, и П2 — число молей тех же компонентов в поверхностной фазе.
Очевидно, для поверхностной фазы пригодно уравнение (V, 6). Для объемной же фазы аналогичным уравнением будет:
Я® + п°2 d[i2 — 0 (V, 7)
Решим уравнение (V, 7) относительно dp,:
„і
Я2
Dv-l =—— 2
П
Подставив найденное значение rfp, в уравнение (V, 6), получим:
&
|
(V,8) |
S da + { П2—- Цг— ) di2 = 0
Da П2~ ППЦ П] di2 s
Где «2 — число молей растворенного вещества, связанное с я, молями растворителя в поверхностной фазе; «j/l®//?, — число молей растворенного вещества, связанное с п, молями растворителя в объемной фазе.
Правая часть уравнения (V, 8) представляет собой избыток количества растворенного вещества на единице поверхности, т. е. величину адсорбции Г. Тогда уравнение (V, 8) примет вид:
Г = —da/dni (V, 9)
Так как для разбавленных растворов ц2 = М-2 + ^ ‘п с> то ПРИ постоянной температуре DL2 = RTdNc. Подставляя это значение dp.2 в уравнение (V, 9), получаем уравнение Гнббса:
Г=_____ с_ Da
RT ‘ dc
Из уравнения Гиббса ясно, что если поверхностное натяжение увеличивается с концентрацией с, т. е. если Do/Dc > 0, то Г < О, иначе говоря, концентрация растворенного вещества в поверхностном слое меньше, чем в объеме раствора (отрицательная адсорбция). Наоборот, если о уменьшается с увеличением с, т. е. если Do/Dc <0, то Г > 0 и концентрация
Вещества в поверхностном слое боль — || (
Ше, чем во всем объеме (положительная адсорбция). Наконец, если о не зависит от с, то концентрация растворенного вещества в поверхностном Слое и в объеме раствора одинакова (адсорбции не наблюдается).
Величина — Do/Dc называется поверхностной активностью. Взятая на практически прямолинейном участке изотермы поверхностного натяжения, когда концентрация растворенного вещества невелика и ее значение постоянно, она может служить мерой поверхностной активности данного вещества.
В честь Гиббса величину —‘Da/Dc обозначают через G и называют гиббсом. Уравнение Гиббса в этом случае принимает очень простую форму:
Г = (V, 10)
Откуда
G = -^ = RT — (V, 11)
Dc С > г
Как следует из уравнения (V, 11), единицы измерения G эрг-см/моль.
|
Сра6н — Рис. V, 3. Построение изотермы адсорбции по изотерме поверхностного натяжения. |
Уравнение Гиббса было выведено на основании термодинамических представлений. Экспериментальная проверка этого уравнения весьма затруднительна в связи со сложностью определения концентрации растворенного вещества в поверхностном слое. Тем не менее опыты Мак-Бена, в которых с поверхности раствора с помощью прибора, напоминающего микротом, срезался очень тонкий слой жидкости, показали, что во всех исследованных случаях экспериментально найденные значения адсорбции в пределах ошибки опыта совпадали со значениями, вычисленными по уравнению Гиббса. Правильность уравнения Гиббса была подтверждена также опытами А. Н. Фрумкина.
Пользуясь уравнением Гиббса, по изотерме поверхностного натяжения для поверхностно-активного вещества легко построить соответствующую изотерму адсорбции следующим образом. Возьмем какую-нибудь точку на изотерме поверхностного натяжения и проведем через нее касательную и прямые, параллельные осям координат, как это показано на рис. V, 3. Отрезок, отсекаемый на оси ординат касательной и прямой, параллельной оси концентраций, деленный на отрезок абсциссы, отсекаемый на ней прямой, проведенной через точку параллельно оси ординат, равен —Do/Dc, Т. е
Г _ Da
С Dc
Подставив значение, найденное для —do/dc, в уравнение Гиббса, получим:
_____ с_ Da ___ Г
~ RT ‘~dc RT
Определив для ряда точек изотермы поверхностного натяжения соответствующие значения величины Г, легко построить изотерму адсорбции.
 1 ноября, 2012
1 ноября, 2012  admin
admin 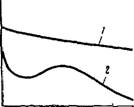
 Опубликовано в рубрике
Опубликовано в рубрике 