Использовались образцы гамма-оксида алюминия (^-АЬОз) с удельной поверхностью S = 77,6 м2/г, три образца гидроксида алюминия (ГОА-4, ГОА-2, ГОА-1) с 5 = 51,5; 20,1; 8,8 м*/г и кварц с S = 2,l м2/г. Измерения показали, что, в отличие от натриевых форм цеолитов, для дегидратированных ■у-АЬОз, гидроксида алюминия и кварца не наблюдаются максимумы при температурах 180—280 К. Это говорит об отсутствии ионов или полярных групп, способных переориентироваться под действием теплового движения в указанном интервале температур. При 105—180 К наблюдаются слабые токи, которые, однако, превышают погрешность измерений (рис. 16.8). Размытость этого максимума связана, по-видимому, со значительным распределением времен релаксации.
Адсорбция воды приводит к появлению трех максимумов /, II, III, которым соответствуют, как и в случае льда [696], процессы с временами релаксации 103—104 с (рис. 16.8 и 16.9). Однако, в отличие от льда, максимумы наблюдались при более высоких температурах. Максимум / наиболее слабый и проявляется при наиболее низких температурах. Зачастую он не виден на фоне более значительного максимума II. Близость температур проявления максимума I и максимумов, связанных с адсорбцией воды на Na-цеолитэх [683] и полимерах [681, 682], а также увеличение поляризации (имеющей порядок Ю-8 Кл/ /м2) процесса I с ростом гидратации позволяют предположить, что этот процесс в оксидах алюминия связан с релаксацией молекул адсорбированной воды.
Максимум II значительно больше максимума I (рис. 16.8 и 16.9). Он проявляется для оксида и гидроксида алюминия при близких температурах. Энергия активации составляет 30— 40 кДж/моль при определении методом начального наклона и 40—50 кДж/моль — при определении методом Буччи [678]. Последнее значение может быть сопоставлено с энергией активации электропроводности льда [676]. Можно предположить, что процесс II связан со смещением зарядов (вероятно, протонов в пределах ассоциатов молекул адсорбированной воды, расположенных в порах образца). В пользу этого говорит примерно линейный рост поляризации процесса II с ростом гидратации (заполнение вплоть до половины монослоя), хорошая воспроизводимость результатов (данные для 4-AI2O3), появление максимумов II уже при незначительной адсорбции и высокое значение поляризации (порядка 10-7Ч-10~6 Кл/м2).
Отметим, что по величине токов в области II можно судить о количестве адсорбированной воды при малых гидратациях.
Поскольку энергия активации процесса III близка к энергии активации электропроводности на постоянном токе (данные
|
Рис. 16.8. Температурная зависимость токов ТСД в дегидратированном Y-AI2O3 (1) и при содержании воды 12,3 мг/г (2). См. пояснення в тексте |
Рис. 16.9. Температурная зависимость токов ТСД в гидроксиде алюминия ГОА-2 при различных содержаниях воды:
/ — 0; 2 — 0,25ат; 3 — 0,5ат; 4 — ат (в долях монослоя)
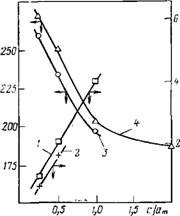
Рис. 16.10. Зависимость силы тока в максимумах II {I, 2) и температуры максимумов II (3, 4) от величины адсорбции воды (в долях монослоя) для образцов К-АЛ2О3, дегидратированных при 473 К (/, 3) и 673 К (2, 4)
Для Y-AI2O3), то можно предположить, что максимум III связан с накоплением зарядов на мак — ронеоднородностях образца. Результаты измерений плохо воспроизводятся в области рассматриваемого максимума. Этот максимум проявляется при больших степенях гидратации и стремительно растет с увеличением содержания воды, значительно превышая максимум II. При этом его поляризация примерно на порядок выше поляризации процесса II. Температура максимума III близка к температуре максимумов, наблюдавшихся для кристалликов льда в специально поставленном опыте, когда в пустую ячейку помещали небольшое количество воды, пары которой при резком охлаждении конденсировались и кристаллизовались на электродах.
Интересно отметить, что процесс III развивался особенно интенсивно в образце гидроксида алюминия ГОА-1, имевшем малую удельную поверхность.
|
Ттах’К НО, А
|
В случае 4-AI2O3 были проведены измерения с образцом, дегидратированным при 473 и 673 К — Сравнение полученных результатов показывает, что при повышении температуры термовакуумной обработки происходит смещение зависимости температуры максимумов и силы тока в максимумах от степени гидратации (рис. 16.10). В результате прогрева уменьшается величина поляризации (сравнение проведено при адсорбции воды, равной 5,4 мг/г). Эти явления можно объяснить уменьшением числа молекул воды, обеспечивающих процесс II, для образца, дегидратированного при 673 К. При этом часть молекул воды, переставшая участвовать в процессе II, становится «невидимой» для метода токов ТСД. Доля таких молекул, определенная по величине температурного смещения максимумов, их высоте и уменьшению поляризации (рис. 16.10), составила, соответственно, 0,11; 0,12; 0,08 числа молекул в монослое ат. Все это можно объяснить восстановлением частью адсорбированных молекул воды гидроксильного покрова, который частично был разрушен при прогревании ^-АІгОз до 673 К [703—705]. Можно предположить, как это сделано в работах [703, 704], что первые порции адсорбированных молекул взаимодействуют с
координационно-ненасыщенными центрами, восстанавливая гид — роксильный покров. Эти молекулы перестают участвовать в процессе II. Последующие молекулы садятся на поверхность с частично восстановленным гидроксильным покровом и участвуют в процессе II. Отметим, что по данным работы [703] число координационно-ненасыщенных центров для Y-AI2O3 составляет примерно 0,1 от ат. Потерей части молекул воды на восстановление гидроксильного покрова можно объяснить и обнаруженное увеличение емкости БЭТ—монослоя на 0,14ат при переходе от образца, дегидратированного при 473 К, к образцу, дегидратированному при 673 К-
Таким образом, метод токов ТСД позволяет исследовать процессы ионной релаксации и влияние на эти процессы адсорбированной воды, а также кинетические явления в адсорбенте. Результаты, полученные для оксидов алюминия, показывают, что этот метод применим к изучению процессов в гетерогенных системах при адсорбции воды.
[1] Выделение вкладов атомных групп производилось при двух предположениях: 1) вклады полярных и неполярных групп независимы; 2) вклады неполярных групп пропорциональны площади вандерваальсовой поверхности, независимо от кривизны поверхности.
[2] В ^-структуре, рассчитанной с использованием потенциала (1), одна из связей
Йах правильного тетраэдра, отстоящих от его центра на расстоянии 98 пм. К электростатическим взаимодействиям добавляются невалентные взаимодействия между центрами тетраэдров (атомами кислорода) и атомами кислорода и водорода, описываемые формулой:
U=—A/Re+B Ехр (— cR).
Потенциалы (2) — чисто атом-атомные. Точечные заряды расположены на атомах кислорода и водорода (<7н = 0,34е, qo = = 0,68е), невалентные взаимодействия между всеми атомами описываются формулой
U=~A/R»+B/R"
Где п= 6 для взаимодействий О.. .О и Н.. .Н и га= 10 — для взаимодействий О.. .Н.
/•"-Структуры получали тем же способом, что и в работе [386], т. е. в процессе моделирования данной системы при температуре 300 К — На одном из шагов процедуры Метрополиса температуру понижали до 1 К, при этом резко уменьшались величины максимальных смещений и поворотов молекул, что предотвращало переход системы в другую область Стиллинджера— Вебера. В некоторых случаях /"-структуру, полученную при помощи одних потенциалов, использовали в качестве исходной для моделирования с другими потенциалами. При этом моделирование проводили сразу же при низкой температуре.
При помощи как потенциалов (1), так и потенциалов (2) удалось получить ряд конфигураций, резко отличающихся числом водородных связей, но с близкой потенциальной энергией. Водородные связи в системах, моделируемых с помощью потенциалов (1), в большей степени стремятся быть прямолинейными и направленными к вершинам тетраэдра, чем в системах, моделируемых потенциалами (2). Поэтому эти два типа потенциалов дают разные ряды стабильности кластеров. Существование
[3] В выражении (9.16) оставлены лишь главные по (г/|0)»1 члены.
[4] Возможно, при этом существенны также эффекты, связанные с флуктуацией поверхности бислоя [457].
[5] В работе (461] было предложено альтернативное объяснение механизма преодоления гидратационного барьера, связанное с тем, что значительные неравновесные флуктуации формы бислоев могут привести к снижению «гидратационных» сил.
[6] Авторы выражают глубокую благодарность С. А. Панаевой за препараты ПАВ, которые она любезно предоставила для проведения настоящей работы.
 24 октября, 2012
24 октября, 2012  admin
admin 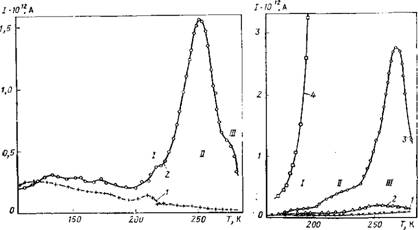
 Опубликовано в рубрике
Опубликовано в рубрике 