Электрохимическая коррозия — самопроизвольное разрушение металлов вследствие электрохимического взаимодействия их с окружающей электролитически проводящей средой. Протекание этой коррозии подчиняется законам электрохимической кинетики и определяется скоростями электродных процессов — анодного и катодного.
При соприкосновении двух электропроводящих фаз — металла и электролита — между ними возникает разность потенциалов вследствие образования двойного электрического слоя как результата перехода заряженных частиц из одной фазы в другую (рис. 5.4). При этом происходят следующие процессы:
Ме + ТН20 Ме”+ • ТИ2О + Пе.
Восстановительный, Окислительный,
Или катодный, процесс или анодный, процесс
Способность посылать свои ионы в раствор у различных металлов неодинакова. Она определяется энергией гидратации металла, т. е. энергией, необходимой для разрыва связи между его ион-атомами и электронами.
Растворению металла противодействуют силы осмотического давления его ионов в растворе, благодаря чему система переходит в равновесное состояние. Установившийся при достижении равновесия обратимый (равновесный) потенциал металла Е> являющийся разностью электрических потенциалов металла фМе и раствора фр, может быть рассчитан по следующему уравнению:
Е = ФМе — фр = Е° +^£-пау
Где Е° — стандартный потенциал металла; Я — газовая постоянная; Т — абсолютная температура; П — заряд ионов металла; Р — число Фарадея; А — активность ионов металла.
Это уравнение, известное под названием уравнения Нернста, при условии протекания процесса при 25 °С (298 К) имеет вид:
Эта зависимость в координатах Е = /(^ А) прямолинейна, и тангенс угла наклона прямой tg а = = 2,303.
Когда активность ионов металла в растворе равна единице, Е = Е°. Таким образом, стандартный потенциал Е° представляет собой частный случай равновесного потенциала Е.
Значения стандартных потенциалов металлов обычно определяют по отношению к стандартному
Рис. 5.4. Схема двойного электрического слоя при выходе ионов металла в раствор
|
Потенциалу водородного электрода, который условно принимают равным нулю. Ниже приведены значения стандартных электродных потенциалов для некоторых наиболее распространенных металлов в водных растворах при 25 °С:
|
Представленный ряд напряжений позволяет судить о химическом и электрохимическом поведении металлов. Каждый из указанных металлов вытесняет из раствора ионы любого другого металла, стоящего в ряду справа от него. Например, цинк, погруженный в раствор СиБ04, покрывается металлической медью, причем эквивалентное количество цинка переходит в раствор.
При составлении гальванического элемента из двух металлов более электроотрицательный всегда служит анодом и разрушается при этом.
Равновесные электродные потенциалы дают представление лишь
О химическом поведении металлов в растворах электролитов, содержащих катионы того же металла. Если металл погрузить в другой электролит и в процессе обмена электронами будут участвовать катионы других металлов, то потенциал, возникающий в этих условиях на межфазной границе, будет неравновесным. Именно с неравновесными потенциалами чаще всего приходится сталкиваться в условиях коррозионного разрушения металлов. Их значения (в В) нередко сильно отличаются от значений равновесных потенциалов:
|
Металл |
Mg |
Al |
Zn |
Fe |
|
Среда: |
||||
|
3 %-й раствор ИаС1 |
-1,60 |
-0,60 |
-0,83 |
-0,50 |
|
7 %-й раствор Ка2504 |
-1,36 |
-0,47 |
-0,81 |
-0,50 |
Значения потенциалов существенно меняются при изменении pH среды, а также при замене воды как электролита на органическую среду. Так, в растворах органических кислот потенциал олова становится более электроотрицательным, чем потенциал железа. Это позволяет использовать олово в качестве протектора при защите черных металлов. Из сказанного следует, что при оценке коррозионного поведения металлов и при выборе средств противокоррозионной защиты важно учитывать характер контактирующей с металлом среды, ее влияние на формирование электродного потенциала.
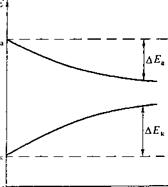
Протекание коррозионного процесса по электрохимическому механизму зависит от скорости двух сопряженных реакций — катодной и анодной. О ее величине обычно судят по изменению потенциала электрода при пропускании через него электрического тока, т. е. по коррозионной диаграмме (рис. 5.5), которая типична для каждого металла в зависимости от характера среды.
Как правило, потенциалы электродов, по которым проходит ток, отличаются от исходных (не нагруженных током): потенциал катода становится более отрицательным, а потенциал анода — более положительным. Происходит смещение потенциалов катода на величину АЕК и анода — на АЕ^:
ЕК = Щ-АЕЮ Еа = Е2-АЕа.
Процесс изменения (сближения) потенциалов, а следовательно, и их разности, приводящий к уменьшению силы тока, называют Поляризацией. По наклону поляризационных кривых можно судить, какая из электродных реакций — катодная или анодная тормозится в большей степени, т. е. какие участки больше подвержены поляризации (рис. 5.6).
Падение напряжения может быть вызвано не только поляризацией электродных участков, но и в результате омического сопротивления в цепи Акоторое определяется суммой сопротивлений коррозионной среды и переходным сопротивлением между катодным и анодным участками. Суммарное падение напряжения АЕ при этом равно:
А Е = АЕК + А £а + А Ек.
 Отсюда можно вычислить до — ^ лю падения каждого напряжения и оценить его вклад в суммарный контроль коррозионного процесса: Е
Отсюда можно вычислить до — ^ лю падения каждого напряжения и оценить его вклад в суммарный контроль коррозионного процесса: Е
Ск = АЕ./АЕ; Са = АЕа/АЕ;
Сц = АЕц/АЕ.
Где Ск, Са и Си — степень катодного, анодного и омического контроля соответственно.
Рис. 5.5. Диаграмма коррозионного процесса (кривые поляризации анодного и катодного участков) 0 /
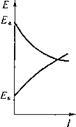
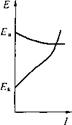
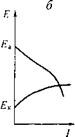 Рис. 5.6. Типовые поляризационные диаграммы:
Рис. 5.6. Типовые поляризационные диаграммы:
А — катодный контроль; Б — анодный контроль; В — смешанный контроль
Тот фактор, который преобладает, т. е. лимитирует процесс, называется контролирующим.
Из сказанного следует, что скорость коррозионного процесса определяется следующими основными факторами: значениями исходных потенциалов катодного и анодного участков, степенью их поляризуемости и сопротивлением цепи (внутренней и внешней).
Поляризация может быть вызвана разными причинами. Замедление анодной реакции происходит чаще всего в результате несоответствия скоростей анодной реакции и отвода электронов во внешней цепи или недостаточно быстрого отвода перешедших в раствор ионов металла. Первый вид поляризации называют перенапряжением ионизации металла, второй — концентрационной поляризацией. Поляризация анода может быть обусловлена также образованием пассивных пленок на поверхности металла.
Причина поляризации катода — несвоевременная ассимиляция перетекающих электронов (вследствие недостаточной скорости разрядки катионов — водородных и других) или низкая скорость поступления кислорода к катоду. В кислых средах катодная поляризация может быть вызвана также водородным перенапряжением. Наряду с этими основными процессами возможно протекание Побочных — взаимодействия первичных продуктов коррозии друг с другом, с электролитом, растворенными в нем газами и другими примесями. Их результатом может явиться образование нерастворимых продуктов коррозии, способных отлагаться на поверхности анодных или катодных участков и вызывать их экранирование и соответственно поляризацию. Например, железо в фосфорнокислых средах образует труднорастворимые фосфаты Ре3(Р04)2, БеНР04, осаждающиеся на поверхности и предотвращающие дальнейшее растворение металла; при контакте свинца с серной кислотой и ее солями возникает нерастворимый осадок РЬ504.
Подавление анодной и катодной реакций и повышение омического сопротивления — основной принцип борьбы с коррозионным разрушением металлов.
 13 апреля, 2013
13 апреля, 2013  editor
editor  Опубликовано в рубрике
Опубликовано в рубрике 