Существующие представления об особенностях твердения смесей на основе жидкого стекла
Принято считать, что твердение силикатных масс с жидким стеклом объясняется выделением из последнего коллоидного кремнезема. Образующийся гель служит связкой для частиц наполнителя и обусловливает тем самым процесс схватывания и твердения силикатных композиций.
В работе [36] установлено, что твердение смесей с жидким стеклом протекает по-разному, в зависимости от метода их обработки. При продувке смесей С02 твердение идет за счет разложения силиката натрия с образованием геля кремневой кислоты и бикарбоната нагрия:
Na2Si305 -Ь 2Н20 ^ H2Si205 + 2NaOH;
2Na0H + 2C02^2NaHC03. (11)
В основе этого процесса лежит гидролиз дисиликата натрия реакция (11).
При тепловом высушивании или другом способе обезвоживания смеси (подвяливание, вакуумирование) формирование прочности объясняется склеивающим действием обезвоженных пленок силиката натрия.
Жидкое стекло способно вступать в обменные реакции с солями щелочноземельных металлов и в первую очередь с солями кальция, к которым относится и двухкальциевый силикат. В результате реакции образуются труднорастворимые соединения, главным образом гидросиликаты кальция. По данным Э. Тило, хорошо растворимые нейтральные соли кальция, например СаС12, осаждают из метасиликата натрия гидросиликат кальция CaH2Si04. Другие авторы отрицают образование силиката кальция, считая, что при взаимодействии концентрированных растворов жидкого стекла и СаС12 на границе раздела возникают пленки геля кремне — кислоты.
Нет единого мнения а о механизме взаимодействия жидкого стекла с гидроокисью кальция.
П. Н. Григорьев и М. А. Матвеев отмечают, что реакция жидкого стекла с Са(ОН)2 должна протекать с образованием силика — геля и гидросиликата кальция. Э. Тило считает возможным образование при этом двойных кальцийнатриевых гидросиликатов состава
2,4СаО • 0,6Na.,0 — 3Si02 • Aq.
Гидросиликаты кальция образуются и при гидратации безводных силикатов кальция, в частности составляющих портландцемента.
Изучая систему СаО—Si02—Н20, Е. Флинт и 3. Уэллс получили гидросиликаты, которым они приписывают структуру солей ортокремневой кислоты с различной степенью замещения: Ca(H3Si04)2; CaH2Si04; Ca3(HSi04)2; Ca2Si04.
В настоящее время установлено существование не менее десяти гидросиликатов с содержанием кальция от 0,5 до 3 молей на моль Si02 и с содержанием химически связанной воды 2—4 моля на моль Si02.
Следует немного остановиться на поведении двухкальциевого силиката по отношению к воде. В литературе, как правило, отмечается, что в водной среде у—C2S не проявляет вяжущих свойств, в то время как р—C2S этими свойствами обладает Г5]. Однако исследованиями П. П. Будникова и Р. Д. Азелицкой установлено, что Y—C2S обладает вяжущими свойствами даже несколько большими, чем р—C2S.
В. Ф. Журавлев указывает, что процесс взаимодействия двухкальциевого силиката с водой может происходить следующим образом:
2СаО • Si02 + «Н20 = 2Ca0-Si02-nH20, (12)
Где п очень близко к 2.
При действии больших количеств воды имеет место гидролиз (9), который может протекать до полного разложения на окислы. Если продукты реакции из системы не удаляются, гидролиз останавливается на промежуточной стадии с достижением равновесия.
Э. Тило указывает, что при всех до сих пор исследованных условиях у—Ca2[Si04](v—C2S) реагирует с водой преимущественно по уравнению
Са2 [Si04] + 2Н20 -—»Са [H2Si04] + Са(ОН)2. (13)
При 20° С гидролиз идет медленно; Р — модификация по отношению к воде ведет себя до 100° С так же, как и у—Ca2[Si04].
Кристаллическая природа безводных C3S и р—C2S в составе цементного клинкера установлена давно, природу же гидросиликатов кальция долго установить не удавалось. Н. А. Торопов на основании микроскопических наблюдений процессов гидратации цементных силикатов кальция сделал лишь общий вывод о коллоидальной дисперсности образующихся гидросиликатов и выделении их в форме геля на поверхности частиц исходных безводных C3S и P-C2S.
Рентгеновскими и электронно-микроскопическими исследованиями гидросиликатов, образующихся при гидратации силикатов цементного клинкера, подтверждена кристаллическая природа гидросиликатов.
Среди гидросиликатов значительное место занимают волокнистые гидросиликаты, причем отдельные их представители имеют аналоги среди природных соединений. Так, однокальциевый гидросиликат CSH, низкотемпературный и гидротермальный, по составу аналогичен природному тобермориту. Состав его (по данным Ж — Калоузека) 4Ca0-5Si02-0^; основность гидросиликатов серии CSH (В) может изменяться в пределах 0,8—1,5 и установлено наличие четырех индивидуальных фаз состава: С455-а<7, CS—Aq, C5S4-a<7 и C4Sr!-
Хотя эти фазы при изучении рентгеновскими методами неотличимы друг от друга, они легко различаются на кривых дифференциально-термического анализа: с увеличением содержания кальция в составе гидросиликата экзотермический пик, наблюдаемый у CS—Aq при 830° С, смещается в сторону более высоких температур.
В работе [8] состав тоберморита выражают формулой Ca4[Si„018H2]Ca-4H20. По данным Н. В. Белова и X. С. Маме — дова, формула тоберморита имеет следующий вид
CaJ0[Sil2O31l(OH)6.nH2O.
Высокая удельная поверхность гоберморитоподобных гидросиликатов установлена Ж — Калоузеком, а также другими исследователями [94]. Оказалось, что удельная поверхность гидросиликатов зависит от метода ее определения. Удельная поверхность, определенная по адсорбции паров воды, в несколько раз превышает величину, полученную методом адсорбции азота. Величина удельной поверхности, определенная первым методом, находилась в пределах 244—376 м2/г; при определении вторым методом (адсорбция азота) удельная поверхность изменялась от 40—50 до 300 м2/г. Было установлено, что удельная поверхность гидросиликатов по адсорбции азота в большой степени зависит от водо — твердого отношения и интенсивности перемешивания суспензий. В. Г. Красильников [32] нашел, что гидросиликаты невысокой основности (0,5 и 1,0) способны к объемному поглощению паров воды, что и является причиной повышенных величин удельной поверхности, полученных адсорбцией паров воды. В связи с этим данный метод непригоден для изучения удельной поверхности гидросиликатов.
Представляет интерес и вопрос о форме связанной воды в гидросиликатах кальция. Здесь также ряд исследователей высказывает предположение о том, что вода связана в гидросиликатах кальция в форме гидроксильных групп. Это подтверждается, в частности, исследованиями Э. Тило и др. В соответствии с этим, например, однокальциевый силикат состава Ca0-Si02-H20(CSH) имеет структурную формулу
Са I /SK I или CaHaSi04. [ох ОН J
Другие исследователи не обнаружили в спектре тоберморита полос колебаний гидроксильных групп. Обезвоживание гидросиликатов при нагреве обычно показывает непрерывное удаление воды во всем интервале температур вплоть до 500—550° С при атмосферном давлении.
Перейдем теперь к непосредственному рассмотрению процессов твердения смесей, содержащих жидкое стекло и двухкальциевый силикат в виде феррохромового шлака или нефелинового шлама.
Изучая композиции жидкого стекла и нефелиного шлама применительно к жаростойким бетонам А. П. Тарасова и К. Д. Некрасов отмечают, что процесс взаимодействия жидкого стекла с СаО, вероятно, протекает таким образом, что СаО или Са(ОН)2 разлагает силикат натрия жидкого стекла с образованием силикатов кальция.
По мнению В. И. Кавалеровой и П. И. Боженова, химическое взаимодействие в системе жидкое стекло — двухкальциевый силикат, если и имеет место, то в очень небольшой степени. Схватывание и твердение смесей объясняются главным образом выделением коллоидного кремнезема, который и является цементирующим веществом.
П. В. Черногоров и А. П. Никифоров [80], изучавшие механизм упрочнения жидкостекольных смесей с феррохромовым шлаком, считают, что твердение смесей является следствием адсорбции жидкого стекла на частицах шлака и коагулирования кремнезема жидкого стекла вместе с адсорбированным гидратом окиси кальция. Завершающим этапом упрочнения, по их мнению, является образование гидросиликатов кальция при химическом взаимодействии гидратированного кремнезема и гидрата окиси кальция.
И. В. Рыжков и В. С. Толстой [64] пришли к выводу, что твердение жидкого стекла и феррохромового шлака происходит в результате дегидратации жидкого стекла и гидролиза кальций — содержащих силикатов, вызывающих коагуляцию жидкого стекла.
Авторы работы [12] указывают, что процесс твердения жидкого стекла и двухкальциевого силиката «обусловлен в основном коагуляцией коллоидных частиц Si02 под воздействием гидролитически образующихся ионов Са++».
При петрографических исследованиях продуктов твердения жидкого стекла и нефелинового шлама [84] была обнаружена микрокристаллическая фаза с показателем преломления 1,507, которая классифицирована как мезолит Na2Ca2SiOAleO30-8H2O.
В работе [28] процессы взаимодействия жидкого стекла с феррохромовым шлаком изучали с помощью петрографических, рентгеноструктурных и электронно-микроскопических методов исследования. Возникающие при этом взаимодействии новообразования классифицированы авторами статьи, как силикагель, на основании чего они пришли к выводу, что решающая роль в процессе твердения смесей на жидком стекле и шлаке принадлежит силикагелю.
Общий анализ существующих представлении о механизме твердения жидкого стекла с кальцийсодержащими соединениями, в частности с двухкальциевым силикатом, свидетельствует о том, что рассматриваемые системы весьма сложны, мало изучены, а взгляды па природу их твердения противоречивы. Тем не менее все известные точки зрения можно свести к двум основным гипотезам:
Первая — твердение смесей на основе жидкого стекла и двухкальциевого силиката происходит в результате образования в системе геля кремневой кислоты, который является главной структурообразующей фазой;
Вторая ■— твердение смеси является следствием образования гидросиликатов кальция.
При изучении природы твердения смесей нами экспериментальной проработке подвергались обе гипотезы.
Природу твердения смесей изучали совместно с кафедрой коллоидной химии МГУ [7].
Кинетику и механизм твердения исследовали на смесях, в основном не содержащих поверхностно-активных веществ. В состав смесей входили: наполнитель — кварцевый песок К020, связующее жидкое стекло переменного модуля, изменявшегося в интервале от 1,0 до 3,4; отвердитель — двухкальциевый силикат в чистом синтезированном виде или в виде феррохромового шлака (около 75% C2S) и вода. Жидкой консистенции смеси достигали повышенным содержанием жидкой фазы, состоящей из жидкого стекла и воды. Количество жидкой составляющей выбирали исходя из необходимости получения седиментационно устойчивых (нерасслаивающихся) паст. Общий объем жидкой фазы был постоянным и составлял 20—24 мл на 100 г сухой смеси. Количество жидкого стекла и двухкальциевого силиката в смесях варьировали в широких пределах: для жидкого стекла от 4 до 20 мл (от 6 до 30% от массы сухой смеси), для двухкальциевого силиката от 4 до 13%. Зта смесь названа нами экспериментальной.
Применяли как техническое жидкое стекло, так и чистые, специально синтезированные силикаты натрия. Характеристика этих образцов жидкого стекла приведена в табл. 20.
Выявленные при изучении приведенных выше составов смесей закономерности в ряде случаев проверяли на типовых составах жидких самотвердеющих смесей, именуемых нами далее техническими.
При изучении природы твердения были использованы химические методы исследований, нефелометрические, рентгеновские, электронно-микроскопические исследования, дифференциальный термический и петрографический анализы.
|
Таблица 20. Характеристика образцов изучавшегося стекла
|
Химические методы исследований применяли для определения состава жидкой фазы при изучении химического взаимодействия между жидким стеклом и двухкальциевым силикатом или ферро — хромовым шлаком. В жидкой фазе определяли содержание Na. O И Si02 в процессе твердения смесей.
Кинетику растворения силикатов кальция в растворах силиката натрия изучали в разбавленных и концентрированных суспензиях, которые готовили в термостатических условиях (при 20° С). Растворение силиката кальция контролировали периодическим отбором проб суспензии, отделением жидкой фазы центрифугированием с анализом ее на содержание кальция комплексометрическим методом.
Жидкую фазу в концентрированных суспензиях отделяли в специальной стальной пресс-форме под давлением до 40 кгс/см2. Суспензию предварительно тщательно перемешивали для разрушения дисперсной структуры, возникавшей в процессе твердения.
Удельную поверхность новообразований определяли методом низкотемпературной адсорбции азота.
Рентгеновские исследования выполняли порошковым методом с использованием ионизационных счетчиков и автоматической записи дебаеграмм. Для анализа брали образцы смесей, состоящих из водных растворов силиката натрия и двухкальциевого силиката после их длительного твердения (в течение 10 суток). Отобранные для анализа образцы отделяли ог водной — фазы и высушивали в вакуумном шкафу при 80—90° С.
Электронно-микроскопические исследования проводили на микроскопе JEM—5у при ускоряющем напряжении 80 кВ с увеличением от 13 000 до 27 000. В отдельных случаях применяли увеличение до 80 000 (разрешение 10 А).
Образцы новообразований для устранения выщелачивания водой гидросиликатов и карбонизации иа воздухе обрабатывали Родными растворами этилового спирта (1 : 1). Затем их в виде суспензий наносили пульверизацией на угольные пленки — подложки.
Дифференциальный термический анализ (ДТА) выполняли на фотографирующем пирометре Курнакова.
Возможные пути и условия взаимодействия между жидким стеклом и двухкальциевым силикатом
Прежде всего необходимо рассмотреть возможность твердения смесей вследствие связывания воды двухкальциевым силикатом C2S при его гидратации или гидролизе с одновременным обезвоживанием жидкого стекла. Такую возможность исключить нельзя, так как с одной стороны C2S представляет собой минералогическую составляющую цементного вяжущего, твердеющего при затворе — нии водой, с другой — известна способность жидкого стекла и смесей на его основе затвердевать при удалении из связующего воды сушкой, вакуумированием и пр.
По данным В. Ф. Журавлева, QS, по сравнению с другими составляющими цемента, имеет наименьшую склонность к гидратации.
Степень гидратации цементных минералов через 7 дней следующая:
Формула минерала C2S C3S C4AF С3А
Степень гидратации,
%……………………………. 10,7 45,9 71,0 81,6
О. П. Мчедлов-Петросян отмечает, что скорость гидратации цемента в щелочной среде заметно повышается, особенно в первые часы. Результаты наших опытов по определению степени гидратации обеих модификаций C2S (оцениваемой величиной потерь при прокаливании) в водной (нейтральной) и щелочной среде при рН =11, близкой по щелочности к жидкому стеклу, приведены в табл. 21.
Как видим, в щелочной среде степень гидратации C2S несколько выше, чем в нейтральной (водной), однако в обоих случаях она незначительна.
Кроме того, расчеты показывают, что при взаимодействии 2Ca0-Si02 с водой и образовании гидроокиси кальция и силикатов кальция, по реакции (13), может связываться меньше 1 % воды.
Отсюда можно сделать вывод, что гидратация двухкальциевого силиката не играет существенной роли в процессе твердения смесей.
Рассмотрим первую гипотезу, объясняющую твердение системы жидкое стекло — двухкальциевый силикат образованием геля кремневой кислоты.
Р. Айлер [1] отмечает, что образование геля кремневой кислоты может происходить в щелочной среде при рН = 10,5—10,7 и ниже. Исследования условий гелеобразования в системе сили
кат натрия — соляная кислота — вода, выполненные О. И. Лукьяновой, показали, что граница гелеобразования наблюдается при достижении рН = 10,9. Следовательно, при значениях рН > > 10,9 гелеобразование не может иметь места. Так как водные растворы силиката натрия с М = 2,5-^2,9, обычно применяющегося для изготовления жидких смесей, всегда имеют величину рН больше 11, то в случае образования геля кремневой кислоты при твердении смесей должно наблюдаться снижение рН до 10,9 и менее. В связи с этим нами проводились многочисленные измерения величины рН в процессе твердения смеси с помощью водных вытяжек по общепринятой методике. Часть экспериментальных данных приведена в табл. 22.
Концентрация водородных ионов в смеси как на ранних, так и на поздних стадиях твердения остается практически неизменной и не опускается ниже 11. Следовательно, для образования геля кремневой кислоты в наших системах нет необходимых условий.
Гель кремневой кислоты хорошо изучен. Характерной его особенностью является очень большая величина удельной поверхности. По данным Р. Айлера [11, О. М. Джигит и др., удельная поверхность силикагеля колеблется в основном в пределах 300— 600 м2/г. Как показали дальнейшие исследования, продукты реакции между жидким стеклом и двухкальциевым силикатом также выделяются в гелеобразном состоянии.
|
Время от начала приготовления смеси, мнн |
РН |
Примечания |
|
5 |
11,8 |
|
|
15 |
11,02 |
Начало твер |
|
Дения |
||
|
32 |
11,01 |
Смесь затвер |
|
Дела |
||
|
64 |
11,08 |
То же |
|
110 |
11,04 |
» |
|
180 |
11,30 |
» |
|
300 |
11,10 |
» |
|
Таблица 22. |
|
Значения рН смеси в процессе ее твердения |
|
Таблица 21. Потери при Прокаливании (%) после различной продолжительности гидратации C2S в водной и щелочной среде
|
Исследования семи образцов новообразований, проведенные О. И. Лукьяновой методом низкотемпературной адсорбции азота, показали, что величина их удельной поверхности в основном находится в пределах 30—50 м2/г, т. е. она на порядок меньше, чем у силикагеля и примерно равна удельной поверхности гидросиликатов. Удельная поверхность новообразований в рассматриваемых смесях не является достаточно чувствительной характеристикой, способной четко отразить все изменения в системе,
ввиду ее сложности. Тем не менее это является еще оДним доказательством того, что продуктом твердения жидкого стекла и двухкальциевого силиката не может быть гель кремневой кислоты. Следовательно, первая гипотеза, основанная на образовании в системе геля кремневой кислоты, по нашему мнению, является несостоятельной.
Перейдем теперь к рассмотрению второй гипотезы — условий гидросиликатного твердения.
С увеличением содержания в смеси жидкого стекла или двухкальциевого силиката пластическая прочность и скорость твердения возрастают. Индукционный период твердения с повышением содержания жидкого стекла удлиняется, с увеличением количества отвердителя сокращается.
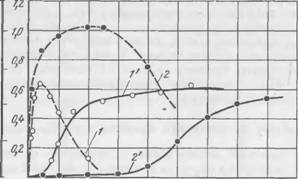
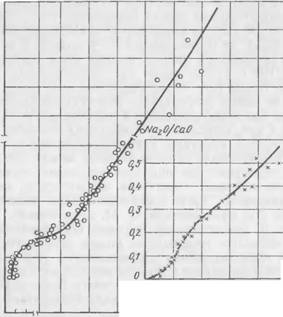
На рис. 36 показано влияние модуля жидкого стекла на кинетику твердения экспериментальной смеси. Чем выше модуль, тем больше скорость твердения, короче индукционный период и
Тем больше конечные прочности. При модуле жидкого стекла, равном 1, твердение смесей практически отсутствует
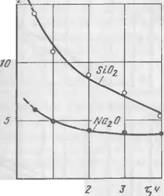
Химическое взаимодействие между жидким стеклом и двух — кальциевым силикатом. Полученные нами и представленные на рис. 37 экспериментальные данные свидетельствуют о химическом взаимодействии в процессе твердения между связующим и от- вердитслем. При этом из жидкой фазы происходит поглощение как Si02, так и Na20, причем Si02 поглощается в большей степени, чем Na20, в результате чего модуль жидкой фазы снижается. Наиболее интенсивное поглощение происходит в первые часы твердения. С течением времени скорость поглощения замедляется. Почти во всех случаях поглощение Si02 составляет около 62—77% от общего количества и, как показали исследования, не зависит ни от содержания в исходной смеси жидкого стекла, ни от количества двухкальциевого силиката. Na20 снижается в жидкой фазе в среднем на 12—30%. Поглощение из жидкой фазы Si02 и Na20 свидетельствует об образовании новых соединений, в со
став которых входят Si02 и Na20. Рентгеновскими исследованиями установлено, что в протекающих реакциях принимает участие также и двухкальциевый силикат, количество которого в процессе твердения смеси постепенно убывает.
На рис. 38 показана кинетика изменения состава жидкой фазы в процессе твердения смеси в зависимости от величины исходного модуля жидкого стекла при содержании 7% двухкальциевого силиката. Чем выше модуль, тем с большей скоростью меняется состав жидкой фазы н тем интенсивнее идет процесс твердения.
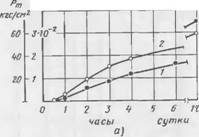
Наглядное представление о непосредственной связи между кинетикой поглощения Si02 из жидкой фазы и кинетикой струк — турообразования в смеси дает рис. 39. Поглощение Si02 из жидкой фазы в течение индукционного периода отсутствует. Начало твердения смеси совпадает с началом поглощения Si02. Ход соответствующих кривых в процессе твердения аналогичен.
|
Naz 0;5I0Z, маль/л |
|
1510 |
|
О 1 |
|
Рис. 37. Кинетика поглощения Si02 и NaoO из жидкой фазы в процессе твердения |
Проведенные исследования убедительно свидетельствуют о том, что твердение смеси является результатом химического взаимо-
Действия между жидким стеклом и двухкальциевым силикатом, протекающего с образованием новых соединении. Предполагая, что между силикатами натрия и кальция протекают обменные реакции и что продуктами этих реакций являются низкоосновные гидросиликаты кальция (Ca0/Si02 я» I), можно представить несколько гипотетических реакций для силиката натрия различного модуля:
(14)
(15)
(16) (17)
|
Для жидкого стекла (М = 2,0) 2Ca2Si04 + Na20-2Si02 + 5Н20 = 4CaH2Si04 + 2NaOH, Ca2Si04 + Na20 • 2Si02 + 3H20 = 2CaH2Si04 + Na2H2Si04; Для жидкого стекла (M = 3,0) 3Ca2Si04 + Na20 ■ 3Si02 + 7H20 = 6CaH2Si04 + 2NaOH, 2Ca2SiO. + Na20 — 3Si02 + 5H20 = 4CaH2Si04 — f Na2H, Si04. |
Такие же реакции могут быть написаны и для жидкого стекла другого модуля. Реакции (14) и (16) приводятся для случая, когда взаимодействие между компонентами идет до конца, до полного расходования Si02 из жидкого стекла. Реакции (15) и (17) заканчиваются на промежуточной стадии, когда модуль оставшегося жидкого стекла становится близким к 1. Если судить по результатам приводившихся выше анализов жидкой фазы
|
SiOz, Г/г |
|
Рис. 39. Кннетика поглощения Si02 (кривая 2) и изменение Рт (кривая /) экспериментальной Смеси, содержащей 10% C2S |
|
-г |
|
= 2, |
|
0): |
|
Содержание жидкого стекла, мл: а 22, б— 26, в — 30 |
F)
|
— г |
|
2 3 Часы |
|
В) |
|
6 1т Суши |
В процессе твердения смеси, то схемы (15) и (17), по-видимому, более правильно описывают протекание реакций в реальных системах.
Расчет по стехиометрической реакции (17) для чистого C2S и жидкого стекла М = 3,0 с плотностью 1,5 показывает, что для получения одноосновного гидросиликата кальция на 1 г QS необходимо взять 1,59 г жидкого стекла, или 1,06 мл.
Приближенные сгехиометрические расчеты по реакции (17) для технических (типовых) смесей с 5% феррохромового шлака,
Содержащего примерно 75% C2S и 6 мае. ч. жидкого стекла (М — = 3,0; р = 1,5 г/см3) на 100 мае. ч. сухих компонентов, дают следующие результаты.
Для получения одноосновного гидросиликата кальция на 5 мае. ч. феррохромового шлака (или 3,75 мае. ч. C2S) потребуется 5,95 6 мае. ч. жидкого стекла при условии, что прореагирует 100% C2S. Если учесть, что на самом деле прореагирует не более 70% C2S, тогда для получения такого гидросиликата потребуется только около 4,15 мае. ч. жидкого стекла. По приближенным расчетам, при указанном выше составе технической смеси и при условии, что в реакции принимает участие около 70% C2S, основность равновесных гидросиликатов кальция, образующихся в процессе реакции, будет близкой 0,75 или отношение
Вних-шг~и5-
Следует отметить, что во всех рассмотренных случаях подразумевается конечный, равновесный состав гидросиликатов, который может быть достигнут после выдержки смесей в течение нескольких суток, а то и недель.
При дальнейшем исследовании условий взаимодействия силикатов натрия и кальция и определении примерного состава новообразований как по поглощению СаО, Si02, Na20, так и химическим анализом образовавшихся осадков было установлено, что состав их меняется в широких пределах. Недостаток силиката натрия по сравнению со стехиометрическим количеством вызывает повышение основности гидросиликата кальция. Избыток силиката натрия ведет к увеличению содержания кремнезема в составе гидросиликата и одновременно к вхождению Na20 в его состав.
Растворение силикатов кальция в растворах силиката натрия. Для раскрытия и понимания природы протекающих при твердении физико-химических процессов целесообразно рассмотреть нашу систему связующее — отвердитель с позиций современной кристаллизационной теории твердения неорганических вяжущих веществ.
Напомним, что согласно этой теории необходимой стадией твердения является растворение исходного вяжущего в водной фазе системы с образованием пересыщенных растворов и последующим выкристаллизовыванием из этих растворов новообразования. Часто эта стадия является определяющей для последующего процесса твердения. В связи с этим была изучена кинетика растворения силикатов кальция в растворах силиката натрия.
Изучали влияние на скорость растворения силиката кальция его количества, концентрации и модуля силиката натрия; определяли также предельную концентрацию пересыщенного раствора.
Кинетика растворения р—C2S в водном растворе силиката натрия различной концентрации представлена на рис. 40. Для сравнения там же приведена растворимость силиката кальция
в чистой воде (кривая /). Из анализа приведенных на рисунке кривых можно сделать ряд важных заключений:
Растворимость двухкальциевого силиката в растворах силиката натрия во много раз больше, чем в чистой воде;
Растворимость C2S возрастает с повышением концентрации силиката натрия в растворе;
Наибольшая скорость растворения наблюдается в начале процесса; по мере насыщения раствора скорость растворения уменьшается;
При высоком содержании C2S (кривая 4) концентрация кальция в растворе после достижения максимума начинает падать, что свидетельствует об образовании и выделении новой фазы.
На рис. 41 показано влияние на кинетику растворения C2S количества последнего. С увеличением содержания C.2S растворимость его возрастает до тех пор, пока она не достигнет предельной, о чем свидетельствует слияние кривых растворимости при различных навесках C2S. Одновременно повышается и скорость растворения. В том же направлении оказывает влияние и увеличение удельной поверхности силиката кальция, так как и в том и в другом случаях возрастает общая поверхность силиката кальция, участвующая в растворении.
Учитывая способность двухкальциевого силиката к высокой растворимости в силикатах натрия с образованием пересыщенных растворов, можно было предположить, что подобными свойствами обладают и другие кальцийсодержащие соединения. На рис. 42 показана зависимость кинетики растворения C8S и C2S и их предельной растворимости от концентрации силиката натрия. Обра
щает па себя внимание, что величина предельной растворимости одинакова для C3S и C2S, т. е. она не зависит от природы Са-фазы при одной и той же концентрации силиката натрия. Различия между ними наблюдаются только в скорости растворения: для C3S она больше, чем для C2S. Аналогичным образом ведет себя в растворах силиката натрия и Са(ОН)2 с тем лишь отличием, что скорость его растворения из-за высокой удельной поверхности еще больше. Удельная поверхность Са(ОН)2 на порядок выше удельной поверхности QS и QS.
До сих пор мы рассматривали растворимость кальциевых соединений в разбавленных суспензиях при низкой концентрации силиката натрия, в то время как для нас важно знать растворимость силикатов кальция в концентрированных суспензиях с повышенным содержанием жидкого стекла, приближающихся к типовым составам смесей.
|
SiOZ) Мол1/л |
|
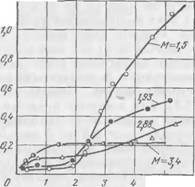
Рис. 43. Зависимость предельной концентрации Са от концентрации силиката натрия (по содержанию Si02) при различном модуле |
На рис. 43 показана зависимость растворимости силиката кальция от концентрации жидкого стекла (выраженной концентрацией Si02 в растворе) и его модуля. Концентрации Si02 —
|
Са J молT/л Са, молф_
Рис. 42. Зависимость кинетики растворения силикатов кальция и их предельной растворимости от природы Са-фазы при различной концентрации силиката натрия (М = 3,4): Концентрация SiOz Моль/л: 1 к 2 — 20-1&-»; 3 н 4 — 60-Ю-2; / и 3 — C.S; 2 н 4 — C3S. Навеска Са — силикат: ‘ и 2 — 3 г; 3 и 4 — 4 г |
5,0—5,5 моль/л примерно равны содержанию силиката натрия в типовых составах ЖСС. В табл. 23 приводятся предельные концентрации кальция для трех кальциевых соединений (QS, C3S и Са(ОН)2) при близких концентрациях силиката натрия для различных модулей.
На рис 43 можно выделить три области концентраций. В первой — с увеличением концентрации силиката натрия (область
|
Таблица 23. Предельная концентрация СаО в растворах силиката натрия различного модуля
|
Малых концентраций до 1 моль/л SiO.,) растворимость кальция возрастает для всех модулей. В интервале средних концентраций (примерно 1—2 моль/л Si02) растворимость кальция для одного и того же модуля не изменяется с повышением концентрации. Для этих концентраций растворимость кальция тем больше, чем выше модуль. При высоких концентрациях силиката натрия (>2 моль/л Si02) для всех модулей, кроме М = 3,4, наблюдается заметное возрастание растворимости кальция по мере повышения концентрации. В этой области растворимость кальция тем больше, чем ниже модуль. Исключение составляет лишь стекло (М = = 3,4), для которого предельная растворимость кальция практически не зависит от концентрации силиката натрия в широком интервале — от 1,5 до 5 моль/л и более Si02.
Данные табл. 23 подтверждают независимость величины предельной растворимости от природы кальциевых соединений (C2S, C3S, Са(ОН)2). Она определяется только концентрацией и модулем жидкого стекла.
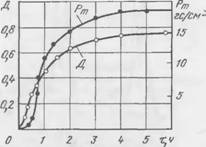
Обычно после достижения предельной концентрации кальция в жидкой фазе начинают выделяться новообразования — формируется прочность смеси; при этом концентрация кальция в жидкой составляющей снижается. Представление о связи процесса твердения с изменением концентрации кальция в жидкой фазе дают кривые рис. 44, построенные для двух смесей с различным содержанием растворимого стекла. Легко заметить, что на кривых максимум концентрации кальция совпадает с концом индукционного периода для обоих составов смесей. Кроме того, для достижения более высокой предельной концентрации кальция при повышенном содержании жидкого стекла требуется больше времени, что соответствует более продолжительному индукционному периоду твердения смеси.
Образование новой фазы в процессе взаимодействия силикатов натрия и силикатов кальция было установлено также и с помощью
Йефелометрических исследований, результаты которых представлены на рис. 45. Повышение оптической плотности свидетельствует об образовании новой фазы — гидросиликатов кальция. Некоторое Запаздывание формирования прочности в начальный момент
|
|
|
Рт Са, мол б/J кгс/сиг |
|
15 |
|
10 |
|
5 |
|
О 1 2 3 « 5 6 7 8 |
|
Рис. 44. Изменение концентрации кальция в жидкой фазе в процессе твердения смеси (Мж ст = 1,5; 7% C2S): / — CQ3 моль/л; /’ — Рт, кгс/см2; CsiOs = 3,38 моль/л; 2 — Сса — Моль/л; 2′ — Рт, кгс/см1; Csi02 = 4.84 моль/л |
|
20 |
Объясняется тем, что образование сплошной дисперсной структуры начинается только после накопления в системе достаточного количества новой фазы.
|
Рис 45. Кинетика изменения оптической плотности Д и Рт: Мж ст = 2,81; v — CjS; концентрация SiOj — 2,28 моль/л; СаО — 0.10 моль/л |
Приведенные выше данные свидетельствуют о том, что первой стадией взаимодействия жидкого стекла и силиката кальция является растворение последнего в силикате натрия, причем величина этой растворимости во много раз больше величины растворимости силиката кальция в чистой воде. При этом образуются пересыщенные по отношению к новообразованиям метастабиль — ные растворы с высоким содержанием кальция. Высокая растворимость кальция является основной причиной большой скорости твердения композиций жидкое стекло — силикат кальция. Было показано также, что высокая растворимость кальция в растворах силиката натрия не зависит от природы кальциевых соединений (C2S, C3S, Са(ОН)2). Она определяется лишь концентрацией и модулем жидкого
стекла, т. е. является свойством самих растворой силиката натрия.
Выявленные закономерности имеют также важное прикладное значение, так как, с одной стороны, указывают на возможность применения в качестве отвердителей не только двухкальциевого силиката, по и других соединений кальция, в частности трехкаль- циевого силиката или содержащих его материалов, например портландцемента, а, возможно, и гидроокиси кальция. С другой стороны, закономерности, выявленные при изучении кинетики растворения силикатов кальция в жидком стекле, дают возможность раскрыть природу одного из основных технологических свойств ЖСС — индукционного периода твердення и указывают пути его регулирования.
|
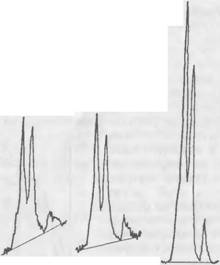
А) б) Рис. 46. Рентгенограммы C2S в образце после 6-часового твердения (а) и в эталоне (б) |
|
|
Комплексные исследования природы новообразований
Рентгеновские исследования. Содержание в смеси двухкальциевого силиката в процессе его взаимодействия с жидким стеклом определялось рентгеновским методом путем количественного сравнения высоты над фоном характерного для C2S дифракционного максимума с D= — 2,78 А в твердеющем образце смеси и в эталонном порошке C2S. Установлено, что в смеси, содержащей 7% C2S и повышенное количество (18 мл) высокомодульного жидкого стекла при общем содер-
Жании жидкой фазы 30 мл, после твердения в течение 6 ч прореагировало около 52% двухкальциевого силиката. Рентгенограммы образцов представлены на рис. 46. Через сутки в этой смеси остается непрореагировавшим более 40% C2S.
На рис. 47 показаны рентгенограммы образцов гидросиликатов с известным молярным отношением окислов, образовавшихся
при взаимодействии C2S с жидким стеклом в разбавленных суспензиях нри высоком общем содержании Si02. При взаимодействии с жидким стеклом (М — 2) в течение трех суток образовался хорошо закристаллизовавшийся гидросиликат состава СаО-l,48Si02-0,36Na20-o<? (кривая 2). На рентгенограмме виден четко выраженный максимум ей — 3,0 А, положение которого соответствует известной дифракционной картине для низкотемпературного тоберморитоподобного гидросиликата кальция. Со стеклом М = 3,4 после суточного твердения образовался рентгеноаморфнын гель состава СаО-l,83Si02-0,2Na20-fl<7 (кривая /).
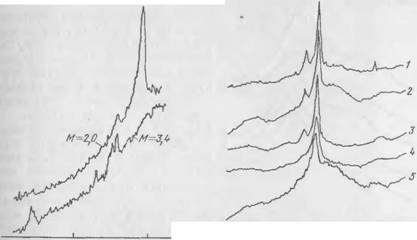
|
2,46 1,12 D —i——— 1____ i_____ i____ 1 43 39 35 31 27 в" |
|
Рис. 47. Рентгенограммы образцов гелей, полученных при взаимодействии CaS с жидким стеклом различного модуля |
|
2 3 6 D _ i______ i____ ._ i______ i__ 45 35 25 15 в° |
На рис. 48 приведены рентгенограммы различных составов низкоосновных (гоберморитоподобных) гидроспликатов, полу
реакции являюгся низкоосновные кальцийнатриевые гидросиликаты, близкие по составу к тоберморитоподобным. По мере увеличения в смеси силиката натрия по сравнению с силикатами кальция увеличивается рентгеноаморфность образующихся гидросиликатов.
При этом важно отметить, что природа новообразований и соответственно природа твердения смесей одинаковы для всех трех кальцийсодержащих соединений —- C2S, C3S и Са(ОН)2.
Электронно-микроскопические исследования. Изучали кальций — натриевые гидросиликаты известного химического состава, полученные при взаимодействии силикатов натрия и кальция, причем соотношение между ними выбирали таким, чтобы можно было получить гидросиликаты с различной основностью: отношение Si02/Ca0 изменялось в пределах 0,6—2,5.
|
Г з б D Рис. 49. Рентгенограммы высококремнеземистых гидросиликатов, полученных при взаимодействии жидкого стекла (М = 3,14) и CgS: 1 — СаО — i,82Si02-0,268Na20-a<7; 2 — CaO-2,26Si02-0,38iNa20-a<?; if — СаО — 2,39Si02* 0,398Na20- 4 — Ca0-2,87Si02. 0,490Na20- aq, 5 — CaO — 2,67Si02. 0,480NaЈ0* aq |
|
_!______ 1_____ 1_____ I———- So м зо го в" |
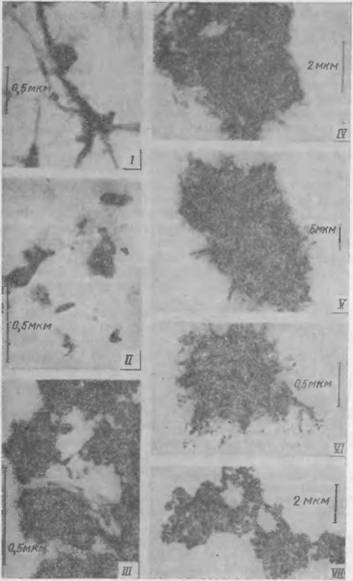
На электронных микрофотографиях (рис. 50) видно, что по мере увеличения отношения Si02/Ca0 внешняя форма частиц гидросиликата меняется. Иголочная структура в сочетании с вытянутыми пленками, характерная для низкоосновного гидросиликата с Si02/Ca0 = 0,59, при возрастании Si02/Ca0 до 1 постепенно переходит в пластинчатую. При росте Si02/Ca0 до 1,8—2 степень кристалличности уменьшается, плоские пленки скручиваются по краям, приобретая форму волокон, объединенных в сферолиты (образцы V, VI). При дальнейшем повышении Si02/Ca0 до 2,5 и более волокнистая форма переходит в форму неправильных частиц и их агрегатов. Форма частиц указывает на их аморфный характер. Структура образца VII напоминает гель. Как видно из рис. 50, образец III представляет собой микрофотографию одноосновного тоберморитоподоб — иого гидросиликата, не содержащего щелочи, а образец IV отличается от образца III только присутствием в составе гидросиликата Na20. Несмотря на это, форма частиц у обоих образцов одинакова. Наэлектронограммах, дополнительно полученных при исследовании гидросиликатов с Si02/Ca0 = 0,7—1,35, обнаружен полный набор тоберморитовых колец, в то время как электронно-графические съемки высококремнеземистых гидросиликатов подтверждают аморфный характер новой фазы
|
Рис. 50 Электронные микрофотографии гндросиликатов различной основности: |
! ~ CaO-0,59SiOs-0.0i2Na2O-a<?; // — СаО-0.82Si02-0,074NH!0-Aq: III —
<-f O- I,0SiO2-d<?; IV — CaO — i. CUSiOj-0,03Na20-a<?; V — СаО — 1,80SSi02-0,378Na,0-Aq; VI — CaO-2,02SiOi!-0(45Na2O. a<7; VII C. iO-2, lGSiOj-0.54Nn„О-Aq
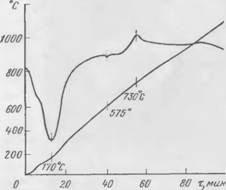
Дифференциально-термические исследования. При изучении самотвердеющих композиций с наполнителем методом дифференциально-термического анализа не удалось выявить термических эффектов, которые можно было бы отнести к новообразованиям. Поскольку полиморфные превращения кварца способны забивать термоэффекты новых соединений, в дальнейшем кривые ДТА снимались с композиций без наполнителей. Термограмма двух — компонентной смеси, состоящей из жидкого стекла и феррохромового шлака, приведена на рис. 51. На кривой при 730° С обнаружен четкий экзотермический эффект, характерный для новообразований, так как ни один компонент смеси в этой области температур термоэффекта не дает.
Такой же эффект, при той же температуре обнаружен и при замене в композиции феррохромового шлака чистым двухкальци — евым силикатом. Эндотермический эффект при 170° С объясняется выделением свободной воды. Эндотермический эффект при температуре 575° С связан с полиморфными превращениями кварца.
И при дальнейших исследованиях двухкомпонентных композиций на термограммах всегда отмечался экзотермический эффект в области температур 720—750° С. Для выяснения природы этого
Эффекта были дополнительно сняты термограммы трех систем: 2Ca0-Si02 + Н20; 2Ca0-Si02 + NaOH и жидкого стекла. Ни на одной из них подобного эффекта не обнаружено. Следовательно, этот эффект, вероятно, характерен для новообразования, предположительно для низкоосновного гидросиликата кальция.
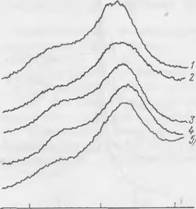
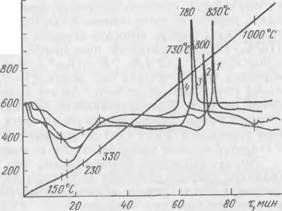
Для проверки этого предположения снимали термограммы с образцов гидросиликатов известного химического состава, полученных при взаимодействии жидкого стекла и двухкальциевого силиката. В табл. 24 приведен химический состав гидросиликатов и температуры характерных для них экзотермических эффектов, а на рис. 52 представлены кривые ДТА для этих гидросиликатов.
|
Рис. 51. Термограмма композиции жидкое стекло — феррохромовый шлак (соотношение компонентов 1 : 1 по массе) |
Результаты термографических исследований позволяют сделать вывод, что экзотермический эффект, обнаруженный нами при температурах —730° С, относится к низкоосновному гидросиликату, по составу близкому к СаО-1,44810;,-0,238-Na20-w/. По данным Ж — Калоузека, основность гидросиликатов кальция серии CSH(B) может изменяться от 0,8 до 1,5. Различие между
Г A It л и ц а 24. Химическим состав гидросиликлтов и температуры их экзотермических эффектов
|
№ по пор. (см. рис. 52) |
|
Температура. °С |
|
Химический состав |
|
CdO/SiO, |
|
1,36 1.15 1,0 0.7 |
|
850 800 780 730 |
СаО • 0,735Si02 ■ 0,235Na20 • Aq СаО ■ 0,872Si02 • 0,156Na20■ Aq СаО — 0,99Si02 • 0,123NazO- Aq CaO-1,44Si02 ■ 0,238Na20 — Aq
Этими гидросиликатами проявляется на кривых ДТА. С увеличением основности гидросиликата экзотермический эффект, соответствующий переходу обезвоженной решетки CSH(B) в Р-вол- ластонит, смещается с 800° С в сторону более высоких температур. Как видно из табл. 24 и рис. 52, с повышением основности изучавшихся нами гидросиликатов температура экзотермического эффекта повышается от 730 до 850° С. Некоторое расхождение в температуре экзоэффектов, по литературным и нашим данным,
Вероятно, объясняется вхождением решетку гидросиликатов.
|
|
|
"С |
|
1000 |
|
Рис. 52. Термограммы гидросиликатов различного состава |
Следовательно, термографические исследования также подтверждают образование низкоосновных кальцийнатриевых гидросиликатов при взаимодействии жидкого стекла и двухкальциевого силиката.
Вяжущие свойства гидросиликатов кальция
|
Na20 в кристаллическую |
На основании полученных результатов можно прийти к однозначному выводу, что продуктами взаимодействия между силикатами натрия и кальция являются гидросиликаты кальция, в со
став которых входит небольшое количество Na20, не оказывающего, по-видимому, заметного влияния на свойства самих гидросиликатов. Таким образом, следует признать, что образующиеся гидросиликаты являются основными носителями прочностных свойств смесей. Определенную (но второстепенную) роль в формировании прочности должно играть и непрореагировавшее жидкое стекло.
Несмотря на то, что вяжущие свойства гидросиликатов кальция, образующихся при твердении цементов, давно установлены, важно было выяснить степень их связующей способности в типовых составах ЖСС и возможность формирования ими прочности, близкой к действительным прочностным показателям смесей. С этой целью были поставлены специальные опыты, воспроизводящие условия образования гидросиликатов, близких по составу к наиболее хорошо изученным тоберморитоподобным гидросиликатам и в то же время приближающихся к тем гидросиликатам, которые способны образоваться в реальных составах ЖСС (при длительном твердении). Отношение Si02/Ca0 в них было выбрано равным 1,25.
Из литературы известно, что тоберморитоподобные гидросиликаты кальция образуются в гидротермальных условиях при температуре 175° С. Исходные образцы в виде кубиков готовили из 95% (по массе) кварцевого песка и 5% смеси СаО и Si02, взятых в соотношении, обеспечивающем образование гидросиликата кальция с указанной выше основностью. Образцы помещали в гидротермальную бомбу, которую ставили в термостат, нагретый до 175° С. Предел прочности при сжатии образцов, обработанных в бомбе, составлял 2,9—3,5 кгс/см2 [предел прочности исходных образцов (до обработки) был равен 0,1—0,14 кгс/см2]. Для того чтобы установить, не является ли эта прочность следствием твердения извести, были поставлены дополнительные опыты, для которых брали смесь, состоящую из песка и 5% чистой извести. При проведении опыта в тех же условиях образцы после обработки в гидротермальной бомбе прочности не имели.
Эти эксперименты подтверждают, что низкоосновные гидросиликаты кальция обладают достаточно высокой вяжущей способностью, а достигнутые прочности соизмеримы с прочностями типовых составов жидких смесей.
Влияние ПАВ на кинетику твердения и прочностные свойства смесей
Влияние двух наиболее часто применяющихся на практике поверхностно-активных пенообразующих веществ (ДС-РАС и контакта Петрова) на характер твердения смесей с жидким стеклом показано на рис. 53 и 54.
Введение в смеси ПАВ увеличивает индукционный период, снижает скорость твердения и прочность смесей. Это влияние тем
больше, чем выше содержание в смеси ПАВ. Характер и степень влияния ДС-РАС и контакта Петрова на прочностные свойства смесей примерно одинаковы. Прочность смесей при сжатии с повышением содержания ПАВ изменяется так же, как и пластическая прочность. Плотность образцов при этом снижается: для смесей с ДС-РАС с 1,525 (без ПАВ) до 1,196 г/см3 при 0,2% ДС-РАС; для контакта Петрова —до 1,192 г/см3 при 0,5% ПАВ.
Представляет интерес характер изменения пластической прочности жидкостекольных смесей при малых добавках ДС-РАС и контакта Петрова: при содержании 0,01 % ДС-РАС или 0,05% контакта Петрова пластическая прочность в начальный период затвердевания ниже, чем в смеси без ПАВ; некоторое время спустя пластическая прочность смеси с ПАВ заметно превосходит прочность смеси без добавок (см. рис. 53 и 54, кривые 1 и 2). Такие же
Рт, кгс/см2-
О 10 20 30 40 50 60 2 3 0 24 Г Минуты Часы
Рис. 54. Зависимость кинетики твердения смеси с жидким стеклом и феррохромовым шлаком от содержания в ней контакта Петрова (%):
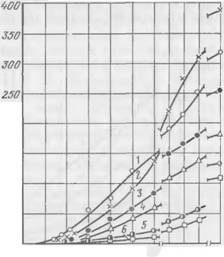
|
|
|
Рт, кгс/см г |
|
100 |
|
10 20 30 00 50 60 2 3 0 24 Г Минуты Vact/ |
|
Рис. 53. Зависимость кинетики Твердении смеси с жидким стеклом И феррохромовым шлаком от Содержании в ней ДС-РАС (%): |
|
‘ — 0; 2 — 0,01; 3 — 0,05; 4 — 0,1: 5 — 0,2 |
/ — 0; 2 — 0,05; 3 — 0,1; 4 — 0,2; 5 — 0.3; 6 — 0,5
Закономерности были обнаружены и для смесей с синтетической смолой и для цементных. Некоторое повышение прочности при введении в обычную смссь небольшого количества ПАВ, по-видимому, объясняется смачивающим действием добавок, улучшающим распределение связующего на поверхности зерен наполнителя. Так как ПАВ увеличивает индукционный период, то рост прочности проявляется на более поздней стадии твер — Дения.
Отмечающееся во всех случаях удлинение индукционного периода можно объяснить адсорбцией ПАВ на поверхностях феррохромового шлака или цемента, а также на поверхностях новообразований, в результате чего процесс формирования прочности замедляется.
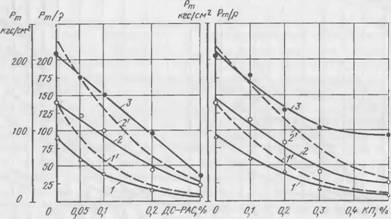
Существенное снижение прочности смесей в присутствии ПАВ (>0,01—0,05%) происходит, по-видимому, вследствие снижения плотности смеси в результате пенообразования и экранирования контактов срастания новообразований поверхностно-активными добавками. Чтобы исключить влияние пористости на прочность, для смесей на жидком стекле с ДС-РАС и контактом Петрова были определены значения удельной прочности смеси, представлявшей собой частное от деления Рт/Р, где р — плотность образцов. По расчетным данным строили зависимости Рт/Р — от содержания ПАВ в смеси для продолжительности твердения 1; 3 и 24 ч. Полученные результаты приведены на рис. 55, а и б. На тех же графиках штриховыми линиями для сравнения показана зависимость
|
А) 6) Рис. 55. Зависимость Рт1 р смеси с жидким стеклом и феррохромовый шлаком от содержания в ней ДС-РАС (а) и контакта Петрова (б): 1, 2. 3— Рт/Р после I; 3 и 24 ч; /’, 2′ — Рт после I и 3 ч |
Абсолютных значений пластической прочности от количества вводимого в смесь ПАВ.
Из приведенных на рис. 55, а, б зависимостей можно сделать однозначный вывод о том, что снижение прочности смесей в присутствии ПАВ происходит в основном за счет экранирования ими контактов срастания новообразований, тормозящего развития кристаллизационной структуры. Повышение пористости формовочной массы с увеличением ПАВ оказывает относительно небольшое влияние на снижение прочностных свойств смесей.
Структурообразование в технических (типовых) составах ЖСС
Рассмотренные выше закономерности структурообразования в системе силикат натрия — силикаты кальция были выявлены при изучении экспериментальных смесей, значительно отличающихся по составу от технических типовых составов смесей.
В экспериментальных смесях содержание жидкой фазы достигало 24 мл на 100 г сухих компонентов при концентрации жидкого стекла (по Si02), не превышающей 3—4 моль/л, в то время как в типовых технических смесях жидкая фаза составляла 5,5— 6,5 мл на 100 г сухой смеси при концентрации Si02 5,5— 5,75 моль/л. Кроме того, в экспериментальные смеси не вводили ПАВ. В то же время рассмотрение кинетики твердения и образования новых фаз непосредственно в типовых составах ЖСС представляет для нас, естественно, наибольший интерес.
Для изучения кинетики структурообразования в типовых смесях необходимо было установить связь между составом гидросиликатов, образующихся при взаимодействии жидкого стекла с силикатами кальция, и составом жидкой фазы, находящейся с ними в равновесии. Такие зависимости были найдены в работе, проведенной под руководством О. И. Лукьяновой, с помощью химических и рентгеновских методов исследования (рис. 56). Пользуясь основным графиком а, можно установить отношение Si02/Ca0 в образовавшемся гидросиликате, определив модуль в равновесной жидкой фазе и заранее рассчитав стехиометрический состав смеси, необходимый для получения гидросиликата заданного состава. По графику б определяли содержание Na20 в составе выделившегося гидросиликата.
Расчет состава исходной смеси для получения требуемых гидросиликатов при условии протекания реакции до конца проводился по уравнению
2СаО • Si02 + х (Na. O • nSi02) =
= 2(Ca0.mSi02./sNa20) +y (Na20-zSi02),
Где N — модуль исходного жидкого стекла; Z — модуль жидкой фазы, равновесной с гидросиликатом состава СаО — mSi02- ШааО. Приведенные на рис. 56 зависимости были получены для равновесных систем при длительном твердении композиций в течение многих суток.
Дополнительными исследованиями было установлено полное соответствие зависимостей SiOa/CaO в составе гидросиликатов от модуля жидкой фазы (Si02/Na20) в системах, находящихся в процессе твердения, и в системах, достигших состояния равновесия. Следовательно, состав гидросиликатов на любой стадии твердения смеси может быть определен, если в это время известен модуль жидкой фазы смеси.
На основании полученных экспериментальных данных О. И. Лукьяновой предложены формулы (18) и (19) для определения процента гидросиликата С, образовавшегося при взаимодействии жидкого стекла и двухкальциевого силиката, и процента
|
SiOi/CaO
0,5 1,0 7>5Si0i/Ca0 Рис. 56. Зависимость отношения Si02/Ca0 в составе гидросиликатов от состава равновесной жидкой фазы (а) и Na20/Ca0 в составе гидросилнкатов от отношения в них Si02/Ca0 (б) |
Прореагировавшего силиката кальция Сх на данной стадии взаимодействия:
„ аМг-100 . г аМс ■ 100
30 (2N — I) Q ‘ х ‘ 1 60 (2N —
Где а — количество поглощенного Si02 в г на 100 г сухой смеси; Мг и Мс — молекулярная масса соответственно гидросиликата и силиката кальция; N — молярное отношение Si02/Ca0 в составе гидросиликата; Q — общая масса смеси (100 г сухой смеси + + масса жидкой фазы); Q — количество кальциевой фазы в смеси, %.
Количество поглощенного Si02 (г) вычисляли по формуле
SiP2 моль/л (погл) Уж фМм 5Юг
1000 ‘
Si02 (Г) =
|
Таблица 25. Составы исследуемых ЖСС
|
|
* Кварцевый песок 1К020А; ** феррохромовый шлак Sy„ = 3000 смг/г. |
|
2ft |
|
7 2 3 Чаш |
|
7 20г Сутки |
|
ТВерДения (смесь Г If) и дисперсностью Отвердителя (смесь IV). Все это могло оказать определенное влияние на скорость твердения и прочность смесей и повлиять на состав и свойства образующихся продуктов твердения. По составу жидкой фазы определяли ее модуль, отношение Si02/Ca0 в составе гидросиликата и рассчитывали: количество поглощенного в процессе реакции Si02, процент образовавшегося гидросиликата и процент прореагировавшего C2S. Одновременно М/Н. ф. |
|
0.D |
Рис. 57. Кинетика поглощения Si02 из жидкой фазы, изменения ее модуля и пластической прочности в процессе твердения смеси I
|
1 2 3 * / 20т часы сутки |
|
%: SiOz/CaO |
Измеряли кинетику формирования пластической прочности смеси. Содержание чистого двухкальциевого силиката в составе феррохромового шлака принято равным 75%.
Рис. 58. Кинетика изменения отношения Si02/Ca0 в гидросиликате, количества прореагировавшего C2S, количества образовавшегося гидросиликага г. с. и Рт В процессе твердения смеси I
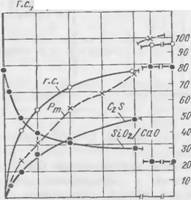
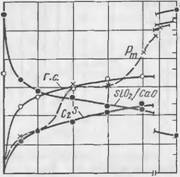
Результаты исследований представлены на рис. 57—61. Экспериментальные данные по смеси I приводятся на рис. 57 и 58. В начале твердения смеси происходит интенсивное поглощение из жидкой фазы Si02, вследствие чего модуль раствора быстро
Понижается. После 1V2 ч твердения поглощение Si02 и соответственно модуль жидкой фазы изменяются с течением времени незначительно. При сопоставлении рис. 57 и 58 легко заметить, что представленные на них кривые находятся между собой в непосредственной связи. Поглощение Si02 сопровождается увеличением количества выделяющегося гидросиликата.
По мере снижения модуля жидкой фазы отношение Si02/Ca0 в гидросиликате непрерывно падает, причем особенно сильно в первый час твердения. Постепенно отношение Si02/Ca0 в гидросиликате приближается к равновесному, равному 1,35, которое достигается уже после суточного твердения. Гидросиликату указанного состава соответствует модуль жидкой фазы, равной 0,51. К этому времени процент прореагировавшего двухкальциевого силиката повышается до 81,5, а количество образовавшегося гидросиликата превышает 5,5%.
Формирование прочности смеси Рт находится в полном соответствии с количеством поглощающегося SiOa и образующегося гидросиликата. ^ ^
Кгс/смг
Из рассмотрения кинетики структурообразования в типовом составе технической ЖСС можно сделать заключение, что твердение смесей сопровождается образованием высококремнеземистых кальцийнатриевых гидросиликатов с отношением Si02/Ca0 > 1,35, причем в первые четыре часа твердения состав гидросиликата, характеризуе мый отношением Si02/Ca0, изменяется от 4,75 до 1,8.
Изучение закономерностей структурообразования в экспериментальной смеси, близкой по составу к смеси I, показало, что между ними нет существенных различий.
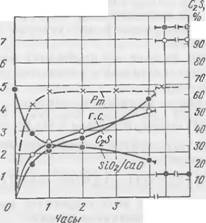
На рис. 59 и 60 представлены данные по кинетике структурообразования для смеси II, отличающейся от смеси I повышенным модулем жидкого стекла.
При сравнении кинетики структурообразования в смеси II и смеси I можно отметить, что повышение модуля силиката натрия приводит к большей скорости поглощения Si02, особенно в начальные периоды твердения, и к большей абсолютной величине 5
П. А. Борсук
поглощения. Более^резко изменяется и модуль жидкой фазы. Различия между смесями I и II наблюдаются и в кинетике образования гидросиликата, и в изменении его состава по Si02/Ca0. Гидросиликат, образующийся в смеси с высокомодульным стеклом, по составу более кремнеземистый, чем в смеси I, но выделяется он в меньшем количестве. После недельного твердения C2S в смеси II расходуется почти полностью.
Процесс структурообразования в смеси II идет интенсивнее, полнее, более продолжительное время.
Отличительной особенностью смеси II с высокомодульным стеклом, по сравнению с другими смесями, является необычный характер изменения пластической прочности. На кривой Рт четко выражены две ступени интенсивного роста прочности: в интервале 1—2 ч и 3—4 ч. Этот двухступенчатый характер изменения пластической прочности был зафиксирован нами многократно. Подобное изменение пластической прочности смеси, по-видимому, объясняется фазовыми превращениями в составе гидросиликатов. Возможность значительного повышения прочности смеси за счет применения высокомодульного стекла представляет также значительный практический интерес.
Увеличение удельной поверхности, так же как и повышение модуля стекла, интенсифицирует процесс образования новой фазы на ранней стадии твердения. На более поздних этапах скорость
Рис. 60. Кинетика изменения количества
|
Г-с., %;S10Z/Ca0
О 12 3 Часа Ь 1 7Т Сутки |
|
Кгс/смг |
|
6 5 3 2 1 |
Прореагировавшего C2S, отношения Si02/Ca0 в гидросиликате, количества образовавшегося гидросиликата (г. с.) и Рт В процессе твердения смеси II
Формирования прочности в смеси IV становится меньше, чем в смеси I. В смеси IV, как и следовало ожидать, процент участвующего в реакции двухкальциевого силиката больше, чем в смеси I, и расходуется он более полно: через четверо суток реагирует практически полностью. Во всех трех смесях (I, II, IV) образуется один и тот же конечный равновесный состав гидросиликата СаО X X l. SSSiOa-O^NaaO-cg1. Следовательно, изменение модуля жид-
Кого стекла, изменение величины удельной поверхности отвердители или его количества не оказывают существенного влияния на механизм и природу твердения жидких смесей.
Несколько иначе ведет себя смесь III, содержащая добавку гипса-ангидрита для ускорения твердения (рис. 61).
Введение в смеси гипса-ангидрита приводит к увеличению количества поглощенного Si02, процента образующегося гидросиликата и доли прореагировавшего отвердители. Величина пластической прочности через 1—2 ч твердения стабилизируется, несмотря на то, что количество образующегося гидросиликата и участвующего в реакции C2S продолжает возрастать. Это, по — видимому, связано с изменением структурообразующих свойств низкоосновных гидросиликатов кальция.
|
5* |
|
131 |
Интересной особенностью смеси С добавкой гипса является полное поглощение из жидкой фазы Si02 к концу твердения, вследствие чего модуль раствора падает до 0, а отношение Si02/Ca0 в составе гидросиликата после достижения системой равновесия равно 1. В конце процесса твердения образуется одноосновный тоберморитоподобный гидросиликат, характеризующийся субмикрокристаллической структурой.
|
|
|
Г. с ‘/O‘JSLOz/CaO |
|
Рис. 61. Кинетика изменения отношения Si02/Ca0 в гидросиликате, количества Прореагировавшего Q. S, количества образовавшегося гидросиликата (г. с.)нРт в процессе твердения смеси III |
|
100 |
|
Рт Кгс/смг |
Следует, однако, иметь в виду, что расчеты количества образовавшегося гидросиликата и доли прореагировавшего C2S в смеси III выполнены приближенно, так как расчетные формулы не учитывают погрешности, вносимой заменой в смеси части двухкальциевого силиката гипсом. По-видимому, этим можно объяснить и то обстоятельство, что, по расчетным данным, доля прореагировавшего C2S после суточного твердения превышала 100%.
Общие представления о механизме твердения ЖСС на основе силикатов натрия и силикатов кальция
Твердение смесей является следствием протекания обменных реакций между жидким стеклом и силикатом кальция, в результате которых образуются кальцийнатриевые гидросиликаты. На протекание обменных реакций указывает изменение концентрации и модуля жидкой фазы смеси, а также постепенное уменьшение в системе силиката кальция.
Необходимым условием прохождения обменных реакций являются высокая растворимость и достаточная скорость растворения силиката кальция в жидком стекле. Оказалось, что растворимость и скорость растворения силиката кальция в силикате натрия намного выше, чем в воде. В процессе растворения Са-со — держащей фазы в жидком стекле образуются растворы, сильно пересыщенные по отношению к новообразованиям (гидросиликатам), выделение которых из пересыщенных растворов и обусловливает характер твердения смесей. Было установлено, что это свойство присуще не только двухкальциевому, но также и трех — кальциевому силикату и гидроокиси кальция. Причем величина предельной растворимости для этих трех материалов одинакова, т. е. она не зависит от природы Са-фазы. Различия между ними наблюдаются только в скорости растворения. Это дало основание полагать, что последние два материала также можно применять в качестве отвердителей или ускорителей твердения смесей на жидком стекле.
В общем виде схему протекания реакции между силикатом натрия и двухкальциевым силикатом можно представить следующим образом:
2СаО ■ Si02 + Na20-nSi02 + Н20 —
-> 2 (СаО — mSi02-/cNa20) Aq + NaaO — zSi02.
Первой стадией этой реакции является гидролиз двухкальциевого силиката:
2СаО ■ Si02 + Н20 — Са (ОН)2 + СаО • Si02- Aq.
Выделяющаяся при этом гидроокись кальция вступает затем во взаимодействие с силикатом натрия.
Установлено, что состав образующихся гидросиликатов по мере твердения смеси непрерывно изменяется в сторону повышения их основности, постепенно приближаясь к равновесному составу, определяемому стехиометрией системы. Одновременно изменяется и состав жидкой фазы, модуль которой понижается. Отношение Si02/Ca0 в составе гидросиликата определяется модулем жидкой фазы смеси. Равновесные составы образуются после относительно длительного периода твердения — 1—3 суток и более. Конечный состав продуктов твердения определяется соотношением между исходными компонентами — жидким стеклом и силикатом кальция. Увеличение количества жидкого стекла в смеси вызывает повышение содержания кремнезема в гидросиликатах. Снижение содержания жидкого стекла вызывает повышение основности гидросиликата. В зависимости от исходного состава смеси и продолжительности ее твердения состав гидросиликатов может изменяться от Тоберморитоподобных субмикрокристаллических гидросиликатов, характеризующихся отношением Si02/Ca0 0,7— 1,25, до высококремнеземистых с отношением SiOa/CaO > 1,30. Эти последние гидросиликаты по мере повышения указанного отношения переходят в рентгеноаморфные и выделяются в форме геля.
Образование перечисленных гидросиликатов обнаружено рентгеновскими, электронно-микроскопическими и термографическими методами анализа.
При твердении различных составов технических (типовых) смесей (кроме смесей с добавкой гипса) состав гидросиликатов, характеризуемый отношением Si02/Ca0, изменяется от —4,75 (при модуле жидкого стекла — 2,9) в начале твердения до 1,35 после его окончания и достижения системой равновесия. Следовательно, формирование прочности в типовых составах ЖСС происходит вследствие образования высококремнеземистых, в основном аморфных кальцийнатриевых гидросиликатов с отношением Si02/Ca0 > 1,35. Образование гидросиликатов в процессе твердения смеси сопровождается поглощением Si02 из жидкой фазы, вследствие чего модуль ее непрерывно изменяется — от 2,9 в начале твердения до 0,5 в конце. Одновременно увеличивается доля прореагировавшего двухкальциевого силиката: после 4 ч твердения в реакцию вступает 40—60% C2S, а через 1—7 суток — 80—■ 96%. Повышение модуля жидкого стекла, а также изменение количества и удельной поверхности отвердителя не влияют на характер и природу структурообразования, несмотря на то что скорость твердения и прочность смесей при этом существенно изменяется.
Формирование прочности смеси находится в прямой зависимости от количества образовавшегося гидросиликата.
Можно полагать, что гидросиликаты являются основной структурообразующей фазой ЖСС, содержащих силикаты натрия и кальция.
Признавая за гидросиликатами ведущую роль в формировании прочности смеси, следует рассмотреть возможность влияния на твердение смеси и самого жидкого стекла. Основная роль жидкого стекла в процессе твердения ясна из вышеизложенного. С одной стороны, жидкое стекло служит «поставщиком» SiOa для образования гидросиликатов кальция, а с другой — является средой Для образования пересыщенных растворов. Наряду с этим жидкое стекло может быть и дополнительным источником формирования прочности смеси.
При снижении модуля жидкой фазы до 1 в рассматриваемых системах, имеющих низкую общую влажность, по нашему мнению, могут выкристаллизовываться гидратированные метасили — каты различных составов: Na2Si03-9Н20; Na2Si03-6H20 и Na2Si03-5H20, которые, по-видимому, также должны повышать прочность смеси. В этой связи обращает на себя внимание повторный заметный рост пластической прочности Рт в технических смесях I и II (см. рис. 57 и 59) при достижении модуля жидкой фазы, равного 1. Вполне возможно, что это связано с образованием кристаллогидратов метасиликата натрия. То обстоятельство, что эти составляющие, имеющие кристаллическую структуру, не были обнаружены применявшимися методами анализа, можно объяснить, с одной стороны, очень легкой растворимостью в воде указанных кристаллогидратов, а с другой — тем, что в экспериментальных смесях структурообразование изучалось при высокой общей влажности смеси.
Следует напомнить, что почти во всех случаях продукты реакции перед их исследованием по принятой методике промывали водно-спиртовыми растворами. Кроме того, жидкая фаза смеси, представляющая собой силикат натрия переменного состава, может придавать смесям дополнительную прочность вследствие ее частичного обезвоживания, вызванного связыванием воды гидросиликатами кальция и натрия и естественным ее испарением при длительной выдержке смеси на воздухе.
При введении в техническую смесь гипса состав конечного продукта твердения меняется — он представляет собой одноосновный тоберморитоподобный субмикрокристаллический гидросиликат. В процессе твердения смесей, содержащих гипс, вероятно, происходит превращение первоначальной аморфной фазы в субмикрокристаллическую. Этот переход может сопровождаться появлением и возрастанием внутренних напряжений, наблюдающихся при твердении кристаллизационных структур, что обычно приводит к снижению прочности системы. В данном случае это может проявляться в прекращении роста пластической прочности смесей, содержащих гипс, на более поздней стадии твердения, что не имеет места в смесях без гипса. Как уже упоминалось, в этих последних смесях прочность формируется за счет образования аморфных гидросиликатов. Прочность системы в этом случае определяется лишь количеством выделившейся новой фазы, так как увеличение площади фазовых контактов не приводит к появлению напряжений, снижающих прочность.
Пластическая прочность этих смесей непрерывно возрастает. Это дает основание сделать вывод о том, что закономерности структурообразования в рассматриваемых смесях, несмотря на ряд специфических особенностей, могут быть объяснены с точки зрения общих положений кристаллизационной теории твердения.
Второй возможной причиной замедления роста прочности смесей с гипсом и некоторого их разупрочнения может быть образование в системе миробилита (Na2S04-10Н20), который был обнаружен петрографическими методами исследования. Было установлено, что степень последующего разупрочнения смесей с гипсом тем выше, чем больше в них содержится гипса.
Исследования показали несостоятельность концепции, объясняющей твердение изучавшихся нами смесей образованием геля кремневой кислоты. Такой интерпретации продуктов твердения, вероятно, способствовало внешнее сходство гелей кремневой кислоты и высококремнеземистых гидросиликатов — и те и другие продукты выделяются в гелеобразном состоянии.
Изучение растворимости силикатов кальция в жидком стекле и связанных с ней процессов структурообразования помогает понять природу индукционного периода твердения, непосредственно связанного с важнейшим технологическим свойством жидких смесей — их живучестью. Выше было показано, что образование новой фазы — процесс твердения — начинается после достижения предельной растворимости кальция. Отсюда следует, что продолжительность индукционного периода твердения будет определяться временем достижения предельной растворимости кальция.
Рассмотрим влияние отдельных факторов на формирование индукционного периода.
Влияние количества жидкого стекла. Чем выше концентрация жидкого стекла в смеси, тем больше предельная растворимость кальция, тем больше нужно времени для того, чтобы она была достигнута, и тем продолжительнее индукционный период твердения. Это положение достаточно наглядно иллюстрируется кривыми на рис. 43 и 44.
Влияние модуля жидкого стекла. Чем выше модуль жидкого стекла (для рабочих концентраций), тем меньше предельная растворимость кальция (см. рис. 43), тем быстрее она достигается и тем меньше индукционный период твердения. При снижении модуля наблюдается обратная зависимость.
Влияние количества отвердителя (двухкальциевого силиката). Чем больше содержится в смеси отвердителя или чем выше его удельная поверхность, тем быстрее достигается предельная концентрация кальция, тем раньше начинается образование новой фазы и тем короче индукционный период. Так, высокая удельная поверхность Са(ОН)2 (~5 м2/г) является основным препятствием применения его в качестве отвердителя смесей на жидком стекле. Предельная растворимость кальция наступает в этом случае очень быстро, вследствие чего структурообразование в смеси начинается уже в процессе ее приготовления. При снижении количества отвердителя предельная растворимость кальция будет достигаться дольше и индукционный период будет увеличиваться.
Отсюда вытекают практические рекомендации по регулированию индукционного периода и соответственно живучести смеси (при достаточной устойчивости пены). Например, индукционный период в жидких смесях можно увеличить за счет: а) повышения содержания жидкого стекла в смеси; б) уменьшения количества шлака; в) снижения модуля жидкого стекла. Не менее важно установить связь между растворимостью Са-фазы в силикате натрия и скоростью твердения смесей. Чем больше скорость растворения и короче время достижения предельной растворимости кальция, тем быстрее будет твердеть смесь.
 19 ноября, 2012
19 ноября, 2012  admin
admin 

 Опубликовано в рубрике
Опубликовано в рубрике 