Свойства жидкого стекла
Свойства водных растворов силикатов щелочных металлов и их способность вступать в физико-химическое взаимодействие с различными веществами в большой мере определяются свойствами безводных силикатов — силикатных стекол. Безводные силикаты щелочных металлов изучены значительно лучше, чем их водные растворы. Существует несколько гипотез о строении силикатных стекол.
Все гипотезы допускают наличие в стекле высокополимерного, апериодического, но не лишенного отдельных упорядоченных микрообластей каркаса, приближающих стекло к кристаллической структуре.
Различные точки зрения по вопросу внутреннего строения кремнеземистого стекла могут быть сведены к двум важнейшим: к теории пространственной сетки Захариазена и цепочечной гипотезе Сосмэна — Тарасова. По мнению большинства исследователей, расхождения между этими представлениями носят больше качественный, чем количественный характер. Строение стекол лучше описывается той или иной теорией в зависимости от их состава и сложности.
Согласно современным представлениям стекла щелочных силикатов являются частным случаем рассмотренных систем. Они состоят из кремнекислородных комплексов, несущих отрицательный заряд, степень сложности и разветвленности которых может быть различной, и катионов металлов (Na+, К+ и т. д.). Для этих стекол характерно наличие связи двух типов: ионно-ковалентной (связь Si—О) и ионной (Me—О). Как показало изучение строения ряда силикатов [74], при большом содержании щелочных окислов силикаты состоят из щелочных или слоистых радикалов — Si—О—Si, сшитых катионами щелочного окисла. В этом случае свойства стекол будут определяться ионной связью. При малом содержании щелочных окислов образуются каркасные (непрерывные) структуры, а свойства стекол будут определяться ионно-ковалентной связью.
Детальным изучением диаграммы состояния бинарной системы Na20—Si02 установлено существование трех определенных силикатов натрия: 2Na20-Si02, Na20-Si02 и Na20-2Si02. По данным П. Н. Григорьева и М. А. Матвеева, к числу индивидуальных кристаллических силикатов натрия, обнаруживаемых современными методами, относится также трисиликат натрия Na20-3Si02. Растворимость силикатов натрия в воде ухудшается по мере увеличения их модуля.
По представлениям С. К. Дуброво и О. А. Шмидт, процесс взаимодействия силикатов натрия с водой и их растворение протекают в две стадии. На первой стадии происходит обмен ионов натрия стекла на ионы водорода раствора, вследствие чего на поверхности образуется слой кремневой кислоты, составляющей вместе с кремнеземом исходного стекла защитный слой на его поверхности. На второй стадии происходит взаимодействие защитного слоя с образовавшимся щелочным раствором, вызывающее растворение кремневой кислоты на поверхности.
Было установлено, что при взаимодействии силикатов натрия с водой вся переходящая в раствор кремневая кислота находится в молекулярной степени дисперсности. При этом, по мнению М. А. Матвеева, стеклообразные щелочные силикаты переходят в раствор, не гидролизуясь, и диссоциируют в растворе на комплексные гидратированные ионы щелочного металла и кремнекис — лородные анионы.
Система Na20—Si02—Н20 была изучена в интервале температур 10—450° С. При постепенном выпаривании водных растворов метасиликата натрия, по данным Р. Айлера [1] и Ю. Вейла, могут быть выкристаллизованы гидратированные метасиликаты различных типов, например Na2Si03-5H20; Na2Si03-6H20; Na2Si03-8H20 и Na2Si0s-9H20, с температурами плавления соответственно 72,2; 62,85; 48,35 и 47,85° С. Они очень хорошо растворимы в воде и имеют кристаллический характер.
Растворы силикатов натрия в воде изучали многие исследователи, однако их строение до настоящего времени выяснено недостаточно. Чаще всего жидкие стекла рассматривают как лиофиль — иые коллоидные системы. Так как взгляды на строение лиофиль — ных коллоидных систем в последнее время сильно изменились, то и представления о строении жидких стекол в известной мере устарели. Еще несколько десятилетий назад лиофильные коллоиды считались гетерогенными неравновесными системами, а теперь всеми признаются за истинные равновесные растворы полимеров [16J.
Последние представления о полимерном строении неорганических стекол вообще и щелочно-силикатных стекол, в частности, дают основание рассматривать жидкие стекла как растворы неорганических полимеров. Свойства их определяются подвижностью и гидратацией катионов щелочного металла и разветвлен — ностью полимерных кремнекислородных анионов. От настоящих полимеров органического происхождения стекла отличаются тем, что их полимерная часть (каркас) имеет характер высокополимерного анионного радикала. М. А. Матвеев и А. И. Рабухин отмечают, что особенностью силикатных и других стекол является то, что у них анион полимеризован, а катион мономерен. Э. Тило указывает, что для неорганических полимеров специфичным является наличие не полимерных молекул, а полимерных ионов. А. И. Рабухин, изучавший физико-химические свойства жидких стекол, указывает на двойственность их природы. По зависимости плотности жидких стекол от их состава, по сжимаемости, показателям преломления и отчасти эквивалентной электропроводности они ведут себя как водные растворы электролитов, а по свойствам вязкости, резко возрастающей с концентрацией, — как растворы полимеров.
Степень диссоциации силикатов в водных растворах невелика. Причина этого состоит в том, что свободный заряд полимерных анионов может возрасти настолько, что оставшиеся катионы чисто электростатически препятствуют диссоциации.
Жидкое стекло обладает высокой реакционной способностью. Как отмечается в специальной литературе, веществ, не реагирующих с жидким стеклом, известно меньше, чем веществ, вступающих с ним во взаимодействие.
Взаимодействие жидкого стекла с кислотами
Так как силикаты натрия являются солями очень слабой кремневой кислоты, последняя должна вытесняться из этих солей всеми растворимыми в воде неорганическими и органическими кислотами. При этом образуется гель кремневой кислоты, обладающий вяжущими свойствами. Приводим схему одной из таких реакций (по данным П. Н. Григорьева и М. А. Матвеева):
Na2Si03 + 2НС1 = 2NaCl + H2Si03.
По нашим данным, большинство кислот очень энергично взаимодействует с жидким стеклом, образуя хлопьевидные осадки — кремиегель. Твердение с индукционным периодом происходит только при большом разбавлении стекла (до плотности 1,1) и низкой концентрации кислот (10—20%), однако образующийся при этом гель малопрочен.
Ряд соединений (А1С13, Fe2(S04)3, A12(S04)3, Na2C03 и др.) подвергается гидролизу с образованием соответствующей кислоты, вступающей затем во взаимодействие с жидким стеклом (случай двухступенчатой реакции), но все они по тем или иным причинам не могут быть использованы для отверждения жидкого стекла.
Взаимодействие с кремнефтористоводородной кислотой. Крем- нефтористоводородная кислота является сильной двухосновной кислотой и относится к числу комплексных соединений. В водном растворе подвергается диссоциации и гидролизу в несколько последовательных стадий. В больших количествах H2SiF6 получают в технике поглощением водой SiF4, являющегося побочным продуктом производства суперфосфата и фосфорной кислоты. Это очень дешевый материал, сырьевые ресурсы которого неограниченны.
Условно состав раствора H2SiF6, по данным И. Г. Рысс, можно представить как смесь HF, SiF4 и Н20.
В водном растворе HF диссоциирует:
2HF^2H’+2F’.
Положение равновесия этой реакции смещается вправо вследствие связывания ионов фтора в относительно прочный комплексный ион SiFe:
2F’ + SiF4 раств <— SiFe-
Фтористый кремний подвергается гидролизу:
SiF4 + 2Н20 ^ SiO, гидр + 4HF.
Свойства водного раствора будут определяться условиями равновесия этих основных реакций. В щелочном растворе часть кислоты нейтрализуется мгновенно, а затем наступает протекающий во времени процесс разложения SiF|; по уравнению
SiF6^SiF4 +2F’.
При взаимодействии кремнефтористоводородной кислоты с жидким стеклом скорость реакции, по-видимому, определяется разложением SiFej и последующим гидролизом SiF4, в процессе которого образуются кремнегель и плавиковая кислота HF, реагирующая затем с силикатом натрия.
Условно в общем виде реакцию химического взаимодействия между H2SiF6 и жидким стеклом различного модуля можно записать следующим образом:
Для одномодульного стекла
H.,SiFc -1- 3NaSiOs + 7Н30 — 6NaF + 4Si (ОН)4; (7)
Для двухмодульного стекла H2SiF„ + 3Na2Si20B + 13НгО — 6NaF + 7Si (ОН)4. (8)
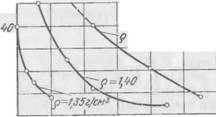
Образующаяся в процессе реакции ортокремиевая кислота выделяется в виде геля, вызывая затвердевание смеси. Кремний, входящий в состав H2SiF6, участвует в образовании дополнительных молекул ортокремневой кислоты, повышающих связующую способность системы. В качестве отвердителя применяли кремнефтористоводородную кислоту 8%-ной концентрации. В таком виде она чаще всего поставляется потребителям. Экспериментальные данные по продолжительности гелеобразования композиций жидкое стекло — H2SiFe при разной плотности жидкого стекла и переменном количестве кислоты приведены на рис. 28.
Весьма важной и интересной особенностью кремнефтористо — водородной кислоты является ее способность вызывать геле- образование в концентрированных растворах жидкого стекла с регулируемым индукционным периодом, причем до наступления момента коагуляции физические свойства раствора, в частности его вязкость, остаются практически неизменными. С повышением плотности жидкого стекла продолжительность гелеобразования возрастает. Прочность образующегося геля высока, но она уменьшается с понижением плотности жидкого стекла и повышением содержания кислоты.
Составы и свойства ЖСС с кремнефтористоводородной кислотой приведены в гл. 5.
|
Мин 50 |
|
,1 | | I (5S м |
|
30 |
^ОБг/см3
Го W 60 80 100 120 см3 Коли."сспЗп HzSlFe
Рис. 28.
П родолжительность гелеобразования композиций, состоящих из 100 см3 жидкого стекла различной плотности и переменного количества H2SiF„ (8%-иая концентрация)
Соли кремнефтористоводородной кислоты — фторосиликаты также отверждают жидкое стекло, взаимодействуя с ним по тем же схемам (7), (8). Примером этой группы соединения является кремнефтористый натрий Na2SiFe. Он находит применение в строительной промышленности для получения самотвердеющих кислотоупорных цементов на основе жидкого стекла [61 ] и может использоваться для приготовления самотвердеющих формовочных смесей на жидком стекле.
Взаимодействие жидкого стекла с гидроокисями щелочноземельных металлов и силикатами кальция
По данным П. Н. Григорьева и М. А. Матвеева, жидкое стекло легко и быстро реагирует с гидроокисями щелочноземельных металлов с образованием гелеобразных продуктов реакции.
Реакция, например, гидроокиси бария с жидким стеклом протекает по следующей схеме:
NaX> • nSi02 — f Ва(ОН)2 + 6Н20 =
= 2NaOH + (я — 1) Si02 + BaSi03 -6H20.
Эти же авторы отмечают, что аналогично идет реакция жидкого стекла с гидроокисями других щелочноземельных металлов:
Са(ОН)2, Mg(OH)3I Sr(OH)2.
Здесь также необходимо рассмотреть возможность двухста — дийного протекания реакции между жидким стеклом и веществами, образующими в водной среде гидроокиси щелочноземельных металлов.
Из строительной практики известна способность трехкаль — циевого и двухкальциевого силикатов, являющихся минералогическими составляющими портландцемента, подвергаться гидролизу при достаточном количестве воды с образованием Са(ОН)2 и различных гидросиликатов кальция в процессе твердения цемента.
Приводим схему реакций гидролиза трехкальциевого и двухкальциевого силиката по данным работы [61 ] и В. Ф. Журавлева:
2 (ЗСаО • Si02) + 6Н20 = ЗСаО • 2Si02- ЗН20 + ЗСа(ОН)2;
2СаО • Si02 + яН20 = Са(ОН)2 + СаО • Si02 (п — 2) Н20. (9)
Обе реакции гидролиза протекают медленно, особенно вторая.
Большое количество двухкальциевого силиката (более 50%) содержится в саморассыпающихся шлаках феррохромового производства, а также в отходах, получающихся при производстве глинозема из нефелиновых руд, так называемых нефелиновых шламах. В связи с этим нами были изучены чистые синтезированные ЗСаО Si02 и |3-2СаО SiOa, портландцемент, содержащий эти соединения в больших количествах, а также феррохромовый шлак и нефелиновый шлам, в состав которых входит двухкаль — циевый силикат. Материалы размалывали до примерно равной удельной поверхности (удельная поверхность C3S была равна 3200 см2/г, удельная поверхность |3-C2S — 3400 см2/г). Дисперсность феррохромового шлака и нефелинового шлама была близкой к дисперсности остальных материалов: удельная поверхность шлака (домолотого) составляла 3100 см2/г; а нефелинового шлама — 3000 см2/г. Диаграммы твердения композиций, состоящих из жидкого стекла (М = 2,9 и М = 2,4, р = 1,48 г/см3) и порошкообразных отвердителей, взятых в соотношении 1 : 1 (по массе) представлены на рис. 29.
При модуле 2,9 композиции с трехкальциевым силикатом (C3S) твердеют мгновенно в процессе их приготовления. Поэтому кривая твердения для C3S на рис. 29, а не приведена. Двухкаль — циевый силикат ^-модификации, нефелиновый шлам и феррохро — мовый шлак твердеют с жидким стеклом при наличии хорошо выраженного индукционного периода. Затвердевшие композиции имели однородный вид и достаточно высокую прочность. При замешивании портландцемента с жидким стеклом модуля 2,9 сразу же наблюдается частичное схватывание массы с образованием комочков. Индукционный период твердения отсутствует. Дальнейшее затвердевание композиции протекает очень медленно. Такой характер твердения объясняется, по-видимому, разнородностью состава портландцемента: одни минералогические составляющие (такие, как трехкальциевый силикат, алюминаты кальция) реагируют с жидким стеклом очень быстро, другие — медленно.
Снижение модуля жидкого стекла с 2,9 до 2,4 привело к замедлению скорости взаимодействия компонентов и существенно изменило характер твердения композиций (рис. 29, б). В этом случае не только C2S, но и C3S, и портландцемент твердеют при
|
Рис. 29. Кинетика твердения композиций жидкое стекло—силикаты кальция: А — М = 2,9; б — М = 2,4; / — р— C, S; 2 — нефелиновый шлам; 3 — феррохромо — вый шлак; 4 — портландцемент; 5 — C3S |
Заметном индукционном периоде, а интервал времени между началом и окончанием твердения сравнительно небольшой.
Судя по приведенным данным, чистый двухкальциевый силикат, а также феррохромовый шлак и нефелиновый шлам дают наиболее благоприятный характер твердения композиций и удовлетворяют основным требованиям, которые предъявляются к от — вердителям. Твердение формовочной массы происходит практически одновременно по всему объему. Те же данные свидетельствуют о возможности применения в качестве отвердителей также трехкальциевого силиката и портландцемента в сочетании с низкомодульным стеклом.
Двухкальциевый силикат в самостоятельном виде в природе не встречается. Поэтому, с точки зрения практического использования, особый интерес представляют дешевые и доступные ма
териалы, содержащие C2S в больших количествах: феррохромовый шлак, нефелиновый шлам, электропечные, мартеновские и доменные шлаки; шлаки, получающиеся при производстве ферромарганца и ферровадания, и др.

|
2130 С |
|
Жидкость |
|
600 |
|
1200 |
|
1800 |
|
Рис. 30. Полиморфные превращения (кривая Бредига) |
|
2Ш |
|
"С C,s |
Рассмотрим более подробно материалы, содержащие C2S, и их свойства.
Свойства двухкальциевого силиката и содержащих его материалов
Двухкальциевый силикат. Ортосиликат кальция (2СаО • Si02) существует в четырех модификациях: а, а’, р и у. Полиморфные превращения двухкальциевого силиката наглядно иллюстрируются кривой М. Бредига, представленной на рис. 30. При нагревании наблюдается следующий пор’ядок полиморфных превращений: y^-a’-t-a, а при охлаждении a — v a’ — v p ->- 7 [35 ].
A.—C2S устойчив при температурах выше 1447° С, при температуре 1447° С переходит в a’—C2S.
Ее’—C2S при нагревании, начиная от у-модификации, устойчив в интервале температур 850—1447° С; при охлаждении а’—C2S никогда не получается 7—C2S; при 670° С образуется р—C2S, а последний при температуре ниже 525° С медленно переходит в у—C2S. Плотность a—C2S 3,4 г/см3.
Р—C2S является мета — стабильной модификацией. При охлаждении чистый Р—C2S переходит в у-мо- дификацию. Плотность р— QS 3,28 г/см3. В присутствии примесей этот пере — ход может затянуться или |> вообще не произойти. ^
У—C2S образуется только при охлаждении других модификаций и представляет собой наиболее стабильную фазу. Она устойчива при температуре ниже 780—830° С. Плотность у—C2S 2,97 г/см3.
Фазовые переходы: расплав a, a ^ а’ и a’ ^ р являются обратимыми, а превращения р-v у и у—а’ идут только в одном направлении.
Из-за большой разницы в плотности переход р—C2S в у—C2S сопровождается увеличением объема примерно на 12%, что приводит к саморассыпанию шлака
Металлургические шлаки. Большое количество двухкальциевого силиката содержится в саморассыпающихся шлаках феррохромового производства, электропечных, мартеновских и доменных шлаках. Саморассыпающиеся шлаки представляют интерес
|
Таблица 10. Средний химический состав шлаков от производства феррохрома на различных заводах СССР
|
|
* После ввода в строй на этнх заводах цехов сепарации и просеивания шлака его удельная поверхность составляет 2000—2500 см2/г. |
По двум соображениям. Во-первых, склонность шлака к саморассыпанию косвенно указывает на высокое содержание в нем двухкальциевого силиката. Во-вторых, саморассыпающийся шлак является тонкодисперсным материалом и перед употреблением не требует дополнительного размола.
Саморассыпающиеся шлаки феррохромового производства. Такой шлак имеется в больших количествах на Челябинском электрометаллургическом комбинате, Актюбинском, Серовском и Запорожском ферросплавных заводах. Минералогический состав феррохромового шлака следующий [20]: 65% у—2Ca0Si02; 5% р—2СаО Si02; 20—25% шпинели Mg0Al203, FeO (Al, Cr)203.
Химический состав феррохромового шлака различных заводов представлен в табл. 10.
В табл. 11 приводятся полученные нами данные по определению величины удельной поверхности, влажности, химического состава и активности образцов шлака всех четырех ферросплавных заводов. Для шлаков Челябинского и Актюбинского заводов удалось установить длительность их хранения в отвале и тем самым выявить влияние возраста шлака на его свойства.
Шлаки четырех заводов по химическому составу немного различаются. В пределах одного и того же завода химический состав и основность различных партий шлака характеризуется достаточно высокой стабильностью.
Активность шлака в основном определяется его возрастом (продолжительностью хранения) при прочих равных условиях. Косвенным показателем возраста шлака в большинстве случаев может быть его влажность. С повышением влажности активность снижается.
Активность шлака тем больше, чем выше его удельная поверхность, о чем можно судить при сравнении двух образцов Запорожского шлака (см. № 16 и 15 в табл. 11).
Саморассыпающиеся электропечные, мартеновские и доменные шлаки. Электропечные и мартеновские шлаки могут также служить отвердителями жидкого стекла, однако химический состав шлаков, даже для одной и той же марки стали, от плавки к плавке колеблется (табл. 12), степень рассылаемое™ шлаков и соответственно их активность различны, что, естественно, осложняет получение ЖСС со стабильными свойствами. Мартеновские саморассыпающиеся шлаки по составу и свойствам аналогичны электропечным.
Саморассыпающиеся доменные шлаки в исходном состоянии имеют удельную поверхность 600—1000 см2/г и твердеют с жидким стеклом очень медленно (2,5—3,5 ч). После домола шлака до удельной поверхности 4000—5500 см2/г активность его существенно возрастает — время твердения композиций составляет 45—60 мин. Нет сомнений в том, что доменные шлаки после домола можно применять в качестве отвердителей для смесей на жидком стекле, что подтверждается также данными X. И. Вишнякова и работами французского Технического центра литейного производства.
Нефелиновый шлам. Нефелиновый шлам представляет собой побочный продукт производства глинозема из нефелиновых руд. Большое количество этого материала имеется на Волховском алюминиевом заводе им. Кирова, Пикалевском глиноземном комбинате им. 50-летия СССР и Ачинском глиноземном комбинате. Сырьевые ресурсы нефелинового шлама практически неограниченны.
По минералогическому составу нефелиновый шлам содержит 80—85% Р—2Ca0Si02. В связи с этим шлам как отвердитель ведет себя так же, как и чистый р—2СаО Si02, что подтверждается кривыми 1 и 2 рис. 29.
Данные о химическом составе нефелинового шлама на двух заводах (табл. 13) за длительный период производства свидетельствуют о незначительных колебаниях в составе и высокой стабильности этого материала.
По минералогическому составу нефелиновый шлам и феррохромовый шлак различаются главным образом тем, что в первом двухкальциевый силикат находится в p-форме, а во втором — в у-форме. Стабилизируют p-форму, т. е. препятствуют ее переходу в у-модификацию, такие примеси, как окислы бора, хрома, фосфора, а также присутствие небольших количеств щелочи. По-видимому, повышенное содержание щелочей в нефелиновом шламе (до 2,2—2,8%) оказывает стабилизирующее действие на Р—C2S, препятствуя его саморассыпанию.
Из изложенного ясно, что наиболее перспективными материалами для отверждения жидкого стекла, являются саморассыпа-
|
Таблица 12. Физико-химические свойства образцов саморассыпающегося шлака электропечного производства
|
Ющийся феррохромовый шлак и нефелиновый шлам. В принципе возможно применение для этой цели металлургических шлаков других производств — электропечных, мартеновских и доменных, однако они уступают первым двум. материалам по активности и стабильности. Процессы твердения ЖСС на жидком стекле с двухкальциевым силикатом и содержащими его материалами будут рассмотрены в самостоятельном разделе.
|
Таблица 13. Химический состав (%) образцов нефелинового шлама
|
 19 ноября, 2012
19 ноября, 2012  admin
admin 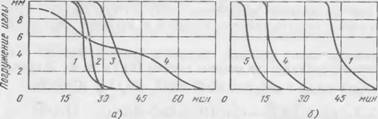
 Опубликовано в рубрике
Опубликовано в рубрике 