В основе процесса формирования полиуретановых покрытий и синтеза полиизоцианатов лежат реакции нуклеофильного присоединения к изоцианатной группе. Характер реакций, в которые вступают изоцианаты, определяется строением группы N=0 = 0. Изоцианаты относятся к классу соединений с гетеро — кумулированными двойными связями, легко вступающими в реакции с различными реагентами, а также друг с другом.
Группа N00 имеет линейное строение. Длина связи N = 0 равна 0,119 нм (1,19 А), связи С = 0 — 0,118 нм (1,18 А). Угол между заместителем И и ЫСО-группой в изоцианате ИМСО может меняться от 120 до 140° в зависимости от природы И.
Электронная плотность в группе N00 распределена так, что азот и кислород несут отрицательный заряд, а углерод — положительный. Поэтому изоцианатная группа подвержена как нуклеофильным, так и электрофильным атакам. Наиболее типичными реакциями для изоцианатов являются реакции нуклеофильного присоединения с участием соединений, содержащих при нуклеофильном центре подвижные атомы водорода (спирты, фенолы, карбоновые кислоты, амины, карбамид, вода и т. д.). Следует отметить также высокую активность изоцианатов в реакции анионной полимеризации.
При взаимодействии с нуклеофильными реагентами теоретически возможно раскрытие как N = 0-, так и С—О-связей. Однако энергия связи С = 0 в изоцианатах значительно больше энергии связи С = Ы (635 и 384 кДж/моль соответственно). Поэтому присоединение нуклеофильных реагентов к ЫСО-группе происходит по связи N=0:
О
Я—N=0=0 + Я’ОН ———— »- Я—N^1—С^ (6.2)
ОЙ’,
Уретан
TOC o "1-5" h z Я—N=0=0+^№1 ———— V И—РЩ— (6.3)
Замещенный карбамид
И—N=0=0 + птс^ ■—- V ЯШ—С—Ы—С^ (6.4)
ОИ’ я СЖ’.
Аллофанат
В отсутствие катализаторов скорость реакции изоцианатов с нуклеофильными агентами определяется нуклеофильностью последних и возрастает в ряду:
ЕКН2>Н0Н>Н20>СбН50НЖ8Н>НС00Н; в ряду аминов:
Н2Ш>НШ2>МНз>РЬМН2; в ряду других азотсодержащих соединений:
ИШИ’ > нынешни’ > 1^тНСО! Г > ИМНСООН’ амин карбамид амид уретан
Энергия активации взаимодействия нуклеофилов с изоцианатами, как правило, невысока (не превышает 21—42кДж/ /моль). При увеличении полярности среды скорость реакции возрастает, а при усилении электронодонорного характера растворителя снижается.
Строение изоцианатов существенно сказывается на его реакционной способности. Ниже приведены данные об относительных скоростях взаимодействия КСб^НСО со спиртами:
Относительная Относительная
Скорость у скорость
1
|
Н (фенилизоцианат) п-ЖО П-Ш2 41 |
![]() И-СН3 0,5
И-СН3 0,5
5 о-СНз 0,04
Скорость реакции определяется как электронными, так и стерическими факторами. Введение электроноакцепторных заместителей в бензольное ядро арилизоцианатов приводит к увеличению доли положительного заряда на атоме углерода изоцианатной группы, облегчению атаки этого атома нуклеофилом и увеличению тем самым скорости реакции. Так, введение второй МСО-группы в пара-положение способствует увеличению реакционной способности первой Г^СО-группы в 5 раз, а введение нитрогруппы — в 41 раз. Алифатические изоцианаты менее активны, чем ароматические.
Помимо электронных эффектов заместителей важную роль играют стерические факторы. Реакции ароматических изоцианатов тормозятся заместителями, находящимися в орто-положении, алифатических — разветвленными заместителями, расположенными вблизи реакционного центра. Так, введение группы СН3 в орто-положение в фенилизопианат вызывает уменьшение скорости в 25 раз, а в пара-положение — только в 2 раза.
В 2,4-толуилендиизоцианате Н3С—^ у—N00, широко при-
Меняемом для получения полиуретанов, ЖЮ-группа в положении 4 в 3—7 раз (в зависимости от условий реакции) активнее 1ЧС0-группы в положении 2 из-за о-СНг заместителя.
Реакции изоцианатов с соединениями, содержащими подвижный водород (вода, спирты и др.), могут протекать в присутствии различных катализаторов. Наиболее распространенными катализаторами являются третичные амины, из которых самый активный — триэтилендиамин:
|
N1 |
![]() К
К
Эффективными катализаторами являются также металлоргани — ческие соединения — алкилкарбоксилаты и алкилгалогениды Эп; ацетилацетонаты и нафтены Си, Ре, Со; стеараты и капри — латы Сг, №, Ре, Со; ацетаты К, N8, Со, 2п, Си, Са, Мд и др. Данные об относительной активности катализаторов аминного типа и оловоорганических соединений приведены в табл. 6.1.
Рассмотрим подробнее те реакции изоцианатов, которые имеют наибольшее значение в процессах получения пленкообразующих и их отверждения.
Реакции изоцианатов со спиртами. Реакция изоцианатов со спиртами лежит в основе как процессов получения полиизоцианатов, так и процессов пленкообразования полиуретановых материалов. Она легко протекает уже при 20—30 °С (особенно в присутствии катализаторов), что очень важно для получения лакокрасочных материалов естественного отверждения.
|
Таблица 6.1
|
Первичные спирты активнее вторичных в реакции уретано — образования; еще медленнее реагируют третичные спирты. Так, константы скорости реакции фенилизоцианата со спиртами при 20 °С в ряду спиртов СН3ОН, С2Н5ОН, СН3СН (ОН)СН3, трет-С4Н9ОН соответственно равны: 0,28-10-4; 0,48-10~4; 0,23- •Ю-4; 0,008-10-4 л/(моль-с).
Для катализа реакции изоцианатов со спиртами можно использовать различные соединения, однако наибольшее распространение получили третичные амины и оловоорганические соединения.
Механизм катализа третичными аминами предполагает возможность активирования молекулы изоцианата (схема 1) или молекулы спирта (схема 2):
Схема 1
0
II е+
TOC o "1-5" h z 1ГЫСО+М}3 ч—^ 1ГЫС-№*3, (6.5)
6-
И’МС+ІГОН ———- ► ІГІШСОІГ + Щз (6.6)
N1*3
Схема 2
ИЮН+МИз =<==* іу^-Н-ОК’, (6.7)
О
ИзИ-НОІГ + ІГНСО ———- >> П"Ы—С^ +N1*3 (6.8)
Н (Ж’
Последняя реакция может протекать с образованием четырехчленного (в случае мономерного) или шестичленного (в случае димерного спирта) активированного комплекса:
И’—N—0=0
: : Н О—И’
І^-Н-О—И’ /
Я’—О-Н-ОДз
Оловоорганические соединения — чрезвычайно активные катализаторы уретанообразования. К ним относятся алкилкарб — оксилаты и алкилгалогениды 5п(1У), например ди-н-бутилди-
ацетат олова, ди-я-бутилхлорид олова и др. Эти соединения в 102—10“ раз более активны, чем средние по активности амин — ные катализаторы (см. табл. 6.1). Каталитическое действие соединений четырехвалентного олова заключается в возможности образования донорно-акцепторного комплекса SnIV—ROH за счет вакантных бе^-орбиталей олова и неподеленной пары электронов кислорода спирта
|
J |
Sniv-iц — —Ц— J—№+
Видимо, главным результатом взаимодействия спирта с оловоорганическим катализатором является изменение свойств ОН — группы, а именно удлинение связи О—Н и увеличение подвижности атома водорода. Реакция может протекать в одну стадию с одновременной передачей неподеленной пары электронов от атома азота изоцианата к протону спирта и от кислорода спирта к углероду изоцианата:
|
RO Н — І I, 0=с—NR |
|
—н — І), —NR |
|
|
R- |
|
О—С- |
|
0=с—NR’ |
 |
|
|
|
Удлинение связи О—Н и приближение ее размеров к длине связи С = И в изоцианатной группе (1,18 А) существенно облегчает протекание реакции.
Реакция изоцианатов с фенолами. Фенолы гораздо медленнее реагируют с изоцианатами, чем алифатические спирты, что объясняется их большей кислотностью (рЛа фенола — 9,99, р/Са алифатических спиртов— 16—18):
О
II
RNCO+XCвH4OH <—>- RNHC—ОСвН4Х. (6.10)
Характерной особенностью этой реакции является ее обратимость— при повышении температуры образовавшийся фенил — уретан может диссоциировать на исходные вещества. Именно поэтому эта реакция положена в основу получения так называемых блокированных изоцианатов, т. е. продуктов, характеризующихся ограниченной термической устойчивостью.
Реакция изоцианатов с водой. Реакция изоцианатов с водой положена в основу процесса получения полиизоцианатов биу —
Ретовой структуры, а также процесса отверждения некоторых полиуретановых композиций.
Гидролиз изоцианатов представляет собой многостадийный процесс, на первой стадии которого происходит нуклеофильное присоединение молекулы воды к группе N(30 с образованием карбаминовой кислоты, быстро распадающейся на СОг и первичный амин. Последний в следующей стадии присоединяется к другой молекуле изоцианата с образованием замещенного карбамида, который в свою очередь может взаимодействовать с ЙСО-группами:
Н О
ИКгС0 + Н20 ——- * ИЫ— V 1УМН2 + С02 (6.11)
Карбаминовая кислота ЯШ
ИЫСО + ШЧН2 —— ► ^)С=0 (6.12)
ЯШ
Замещенный карбамид КГЧН О И
^С=0+1№С0 ———— »- ЯНН—с—N (6.13)
К—НЫ биурет
Скорость гидролиза лимитируется скоростью первой стадии образования карбаминовой кислоты и ускоряется обычными катализаторами реакций нуклеофильного присоединения к изоцианатной группе.
Реакция изоцианатов с аминами. Изоцианаты легко взаимодействуют с аминами с образованием замещенного карбамида:
О
II
1ШСО+ К’Ш2 ——— > ИШСМНИ’, (6.14)
II
1№СО + К2’ЫН ——- >- 1*ЫНСМ1*2. (6.15)
С алифатическими аминами реакция быстро протекает при
О—25 °С без катализатора. Ароматические амины реагируют аналогичным образом, хотя и с меньшей скоростью.
Полимеризация изоцианатов. Полимеризация изоцианатов
Легко протекает по анионному механизму под действием третичных аминов, алкоголятов и карбоксилатов щелочных металлов и т. д. Реакция инициируется взаимодействием соответствующего катализатора и мономера с образованием активного центра — аза-аниона:
|
|
||
|
|||
Рост цепи представляет собой последовательное присоединение молекул мономера к активному центру, причем в зависимости от условий проведения реакции и типа инициатора образуются различные продукты. Если цепь обрывается с потерей группы X на стадии присоединения двух молекул мономера, то образуются циклические димеры (I); если присоединяется третья молекула изоцианата, то образуется циклический тример (И); если же обрыв цепи происходит относительно редко, образуется линейный полимер структуры ]Ч-замещенного полиамида (III):
II _ ідасо II II _ шчсо || || || _
ХС—N ——- >■ X—С—N—С—N ——- >■ X—С —N—С—N—С—N
|
|
|
|
||||
|
|||||||
|
СО Х-+ИМ^ ^N1* СО |
|
Со Яг/" ц* І I ОС со V II |
|
—N I П и |
|
-N-41— I И III |
|
|
|
|
|
|
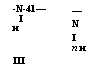 |
|
Практическое применение в лакокрасочной промышленности в настоящее время находят тримеры диизоцианатов изоциану — ратной структуры (II). Это обусловлено как возможностью получения на их основе полифункциональных изоцианатов, так и высокой термостойкостью изоциануратного цикла. Так, урета — новое звено полимера рвется уже при 150—200 °С, в то время как термическая деструкция изоцианурата начинается лишь при 300 °С.
 10 сентября, 2013
10 сентября, 2013  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 